erificar as tendências periódicas de propriedades atômicas dos
Transcrição
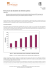
QUÍMICA I AULA 03: MATÉRIA E MEDIDAS TÓPICO 04: PROPRIEDADES ATÔMICAS DOS ELEMENTOS OBJETIVOS: Verificar as tendências periódicas de propriedades atômicas dos elementos de um período ou grupo. 4.1 INTRODUÇÃO TEÓRICA A tabela periódica dos elementos organiza os elementos em um padrão enfatizando as similaridades eletrônicas em relação aos espaços. A tabela periódica é em geral atribuída ao químico russo Mendeleev. Enquanto outros haviam apenas notado que as propriedades químicas repetiam-se periodicamente entre os elementos (por exemplo: lítio, sódio e potássio são quimicamente similares), na Tabela de Mendeleev os elementos estavam originalmente arrumados pela massa atômica e pela similaridade em reatividade química. Ele propôs que algumas lacunas deveriam ser deixadas na tabela para elementos ainda não descobertos e foi o primeiro a predizer a existência e as propriedades dos elementos até então desconhecido. Por exemplo, Mendeleev sabia que o elemento com massa atômica após o Zinco era o Arsênio. Esse seria então o lugar do arsênio, abaixo do alumínio, se a ordem de massa molar fosse seguida com precisão. O arsênio tem uma pequena similaridade química com o alumínio, mas quimicamente é muito similar com o fósforo. Mendeleev, portanto, deixou dois espaços em branco para elementos desconhecidos entre o alumínio e o silício (os quais ele chamou de “eka-alumínio” e “eka-silício”, os quais depois foram descobertos e chamados de gálio e germânio) e o lugar que diz respeito quimicamente ao arsênio é abaixo do fósforo. Em 1913, H.G.J. Moseley estudando o espectro de raio X dos elementos complementou o trabalho de Mendeleev e verificou que quando os elementos são arranjados em ordem crescente de número atômico, certas propriedades químicas e físicas são repetidas periodicamente. Na tabela periódica, os elementos estão distribuídos em colunas verticais, chamadas de famílias ou grupos. Todos os membros de uma Fonte[1] família particular (por exemplo: os metais alcalinos ou grupo 1 que contém o Li, Na, K, Rb, Cs, Fr), tem a mesma configuração eletrônica na ultima camada, e então, propriedades similares PROCEDIMENTO EXPERIMENTAL Utilizando a Tabela Periódica e dados da literatura, construa os gráficos especificados a seguir: 1– Massa atômica (eixo Y) versus número atômico (eixo X) para os elementos de número atômico 11 a 19. 2 – Raio atômico (eixo Y) versus número atômico (eixo X) para o 2o período da Tabela Periódica. 3 – Repita o procedimento do item 2 para os elementos do 1o grupo com exceção do H. 4 - Raio atômico (eixo Y) versus número atômico (eixo X) para (coloque todos as curvas em um mesmo gráfico): 4.1) Rb e Cs; 4.2) Sr e Ba; 4.3) Y e La; 4.4) Zr e Hf 5– Número atômico (eixo X) versus a 1a energia de ionização (eixo Y) do 2o período da Tabela Periódica 6 – Repita o procedimento do item 5 para o 1o grupo da Tabela Periódica. 7 – Afinidade eletrônica (eixo Y) versus número atômico (eixo X) para o 2o período da Tabela Periódica. 8 – Eletronegatividade (eixo Y) versus número atômico (eixo X) para os elementos do 2o período da Tabela Periódica. 9 – Repita o procedimento do item 8 para os halogênios. SÍMBOLO H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Rb Cs Sr Ba Y La Zr Hf RAIO ENERGIA DE AFINIDADE NO. ELETRONEGATIVIDADE ATÔMICO IONIZAÇÃO ELETRÔNICA ATÔMICO (PM) (KJ/MOL) (KJ/MOL) 1 2,1 37 1312,0 -72,77 2 <0 140 2372,3 >0 3 1,5 157 520,2 -59,63 4 1,5 112 899,4 241,0 5 2,0 89 800,6 -26,7 6 2,5 77 1086,4 -121,8 7 3,0 74 1402,3 0 8 3,5 66 1313,9 -140,9 9 4,0 64 1681,0 -328,0 10 <0 154 2080,6 >0 11 0,9 191 495,8 -52,87 12 1,2 160 737,2 >0 13 1,5 143 577,6 -42,5 14 1,8 117 786,5 -133,6 15 2,1 110 1011,7 -72,03 16 2,5 104 999,6 -200,0 17 3,0 99 1251,1 -349,0 18 <0 188 15200,5 >0 19 0,8 235 418,8 -48,0 37 0,8 250 403 -47,0 55 0,7 272 375,7 -45,0 38 1,0 215 549,5 56 0,9 224 502,9 39 1,2 182 615,0 57 1,1 185 538,0 40 1,4 155 660,0 72 1,3 155 681,0 - DESAFIO Leia a aula, faça uma reflexão e tente resolver mentalmente os desafios. Clique aqui para abrir. FÓRUM CROMATOGRAFIA EM PAPEL Durante a prática você utilizou a técnica de filtração para separar o precipitado. Essa técnica se baseia na diferença de solubilidade entre os constituintes da mistura. Aquele menos solúvel se mantém insolúvel e pode ser separado facilmente por filtração. O vídeo, cujo link se encontra abaixo, mostra outra técnica bastante usada nos laboratórios. Trata-se da cromatografia. Assista ao vídeo e pesquise qual o princípio que faz com os componentes de uma mistura sejam separados por cromatografia. Poste o resultado de sua pesquisa mostrando a fonte em que encontrou a resposta MULTIMÍDIA O vídeo ilustrativo trata de um experimento de cromatografia em papel. http://qnint.sbq.org.br/qni/visualizarSalaAula.php?idSalaAula=12[2] FONTES DAS IMAGENS 1. http://www.physics.umd.edu/courses/Phys420/Spring2002/Parra_Spring2002/Image g2002/Images/Physicists_Big/Moseley_Big.jpg 2.http://qnint.sbq.org.br/qni/visualizarSalaAula.php?idSalaAula=12 Responsável: Eduardo H. Silva de Sousa Universidade Federal do Ceará - Instituto UFC Virtual
Documentos relacionados
Apresentação do PowerPoint
 Na sua tabela apareciam lugares vagos que Mendeleev admitiu corresponderem a
elementos ainda não conhecidos. A partir desse trabalho Mendeleev anunciou a lei
periódica segundo a qual as propriedade...
Na sua tabela apareciam lugares vagos que Mendeleev admitiu corresponderem a
elementos ainda não conhecidos. A partir desse trabalho Mendeleev anunciou a lei
periódica segundo a qual as propriedade...
História da Tabela Periódica
 casos, a ordem crescente das massas atómicas.
Foi o caso do berílio, que na altura se julgava ter uma massa
atómica relativa de cerca de 14 – e Mendeleev postulou que o valor
correto deveria ser ce...
casos, a ordem crescente das massas atómicas.
Foi o caso do berílio, que na altura se julgava ter uma massa
atómica relativa de cerca de 14 – e Mendeleev postulou que o valor
correto deveria ser ce...
Tabela periódica Œ Wikipédia, a enciclopédia livre
 foram agrupados como sendo metais suaves e reativos. Döbereiner observou também que, quando organizados por peso
atômico, o segundo membro de cada tríade tinha aproximadamente a média do primeiro e...
foram agrupados como sendo metais suaves e reativos. Döbereiner observou também que, quando organizados por peso
atômico, o segundo membro de cada tríade tinha aproximadamente a média do primeiro e...
Breve história da Tabela Periódica
 atómico dos elementos e as respectivas massas atómicas. Representou graficamente o
volume atómico em função da massa atómica relativa e, através da curva obtida, conseguiu
agrupar vári...
atómico dos elementos e as respectivas massas atómicas. Representou graficamente o
volume atómico em função da massa atómica relativa e, através da curva obtida, conseguiu
agrupar vári...
Quem inventou a Vodca? - IFTO
 chegou à composição ideal para a vodca: 40% de álcool e 60% de água. E já no ano de 1894 a
Vodca Russa já seguia por lei a fórmula proposta por ele.
Por estas e outras razões o professor Mendeleev ...
chegou à composição ideal para a vodca: 40% de álcool e 60% de água. E já no ano de 1894 a
Vodca Russa já seguia por lei a fórmula proposta por ele.
Por estas e outras razões o professor Mendeleev ...