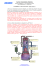Experiência 1 Propriedades e Transformações da Matéria
Transcrição
Experiência 1 Propriedades e Transformações da Matéria
Experiência 1 Propriedades e Transformações da Matéria Parte Experimental 1. Mudanças de estado Fusão do nitrato de potássio Coloque, em um tubo de ensaio seco, uma pequena quantidade de nitrato de potássio e aqueça, lentamente, até a fusão completa. Retire da chama e observe mudanças no aspecto do mesmo. Deixe esfriar e acrescente um pouco de água destilada no tubo de ensaio para a dissolução do resíduo (se necessário aqueça ligeiramente para facilitar a dissolução). Divida a solução formada em dois tubos de ensaio e realize os dois testes que se seguem: a. Acrescente ao primeiro tubo 20 gotas de ácido sulfúrico concentrado, resfrie a solução, e escorra lentamente pelas paredes do tubo, 5 gotas de solução de sulfato de ferro (II) 0,10 mol/L. Observe e anote o resultado. b. Acidule a solução contida no segundo tubo com solução de ácido sulfúrico 0,10 mol/L e adicione uma gota de solução de permanganato de potássio 0,10 mol/L. Observe e a note o resultado. Verifique no manual “Handbook of Chemistry and Physics” o ponto de fusão do nitrato de potássio. 2. Ensaios por via seca e úmida a. Coloque, em um tubo de ensaio seco, uma pequena quantidade de nitrato de potássio e aqueça, fortemente. Continue aquecendo mesmo depois que o sal fundir. Deixe esfriar e acrescente um pouco de água destilada no tubo de ensaio para a dissolução do resíduo (se necessário aqueça ligeiramente para facilitar a dissolução). Transfira um pouco da solução para um tubo de ensaio e realize o seguinte ensaio para identificação de nitrito. Acidule com solução de ácido sulfúrico 0,10 mol/L a solução contida em outro tubo de ensaio e depois adicione uma gota de solução de permanganato de potássio 0,10 mol/L. Observe e anote o resultado. Verifique no manual “Handbook of Chemistry and Physics” o ponto de fusão do nitrito de potássio. Compare os resultados obtidos com os realizados no item 1b . b. Coloque em um tubo de ensaio seco, uma pequena quantidade de cloreto de amônio, aqueça e observe a aparente sublimação desse composto. c. Coloque em um tubo de ensaio seco, uma pequena quantidade de sulfato de cobre(II) pentaidratado, aqueça lentamente e observe o que ocorre. Após o resfriamento, adicione uma gota de água e observe novamente. Verifique no manual “Handbook of Chemistry and Physics” o ponto de fusão do sulfato de cobre(II) pentaidratado. d. Coloque em um tubo de ensaio seco, uma pequena quantidade de bicarbonato de sódio, aqueça e observe o que ocorre. Após o resfriamento, adicione algumas gotas de solução de ácido clorídrico 6,0 mol/L e observe novamente. Verifique no manual “Handbook of Chemistry and Physics” o ponto de fusão do bicarbonato de sódio. e. Coloque em um tubo de ensaio seco, uma pequena quantidade de cloreto de níquel(II) hexaidratado, aqueça lentamente e observe o que ocorre. Após o resfriamento, guarde parte do resíduo e ao restante adicione uma gota de água e observe novamente. f. Coloque em um tubo de ensaio seco, uma pequena quantidade de cloreto de sódio, aqueça cuidadosamente. Observe o fenômeno da crepitação. Verifique no manual “ Handbook of Chemistry and Physics” o ponto de fusão do cloreto de sódio. 3. Eflorescência, deliqüescência, oxidação de sais e absorção de dióxido de carbono. a. Eflorescência de sais hidratados Sobre uma folha de papel de filtro, coloque alguns cristais dos seguintes sais hidratados: sulfato de cobre(II) pentaidratado, sulfato de zinco heptaidratado e tiossulfato de sódio pentaidratado. Deixe até a próxima aula e observe o que ocorre. b. Deliqüescência de sais Coloque, em um vidro de relógio ou béquer, uma pequena quantidade de cloreto de cálcio anidro e deixe sobre a bancada. Se não ocorrer nenhuma mudança perceptível até o final da aula, deixe até a próxima aula e observe o ocorrido. c. Oxidação de sais Observe a cor do sal de Mohr recém-preparado e compare com o mesmo sal que está armazenado há mais tempo no laboratório. Depois faça os seguintes testes: coloque em tubos de ensaio diferentes, quantidades iguais do sal armazenado e do sal recém-preparado , dissolva com água, adicione um pouco de solução de tiocianato de amônio 0,10 mol/L, observando o que ocorre. Explique o ocorrido. d. Absorção de dióxido de carbono d.1. Coloque, em um vidro de relógio ou béquer, algumas pastilhas de hidróxido de sódio e deixe exposto ao ar até a próxima aula. À solução resultante adicione algumas gotas de solução de ácido clorídrico 6,0 mol/L e verifique o que ocorre. d.2. Coloque 15 mL de água de barita em um béquer e com o auxílio de um canudo plástico, borbulhe dentro do líquido durante algum tempo. Observe o ocorrido. Transfira parte do conteúdo do béquer para um tubo de ensaio e centrifugue. Despreze o sobrenadante e ao resíduo obtido acrescente cinco gotas de solução de ácido nítrico 3,0 mol/L. Explique o ocorrido. 4. Bibliografia GIESBRECHT, E.(coord.) Experiências de química: técnicas e conceitos básicos: PEQ-Projetos de Ensino de Química. São Paulo: Ed. Moderna, USP, 1979. EFLORESCÊNCIA E DELIQÜESCÊNCIA Eflorescência Diz-se que um sal hidratado é eflorescente (do latim: florescer), quando ele perde água ao ser exposto à atmosfera. A eflorescência ocorrerá, quando a pressão de vapor do sistema hidratado for maior que a do vapor de água na atmosfera. Deliqüescência Diz-se que uma substância é deliqüescente (do latim: tornar-se líquido), quando ela forma uma solução ou fase líquida ao ficar exposta ao ar. A condição essencial é que a pressão de vapor da solução saturada no mais alto grau de hidratação, à temperatura ambiente, deve ser menor que a pressão parcial do vapor de água na atmosfera. Deve-se ficar atento que deliqüescência e eflorescência são propriedades relativas, já que dependem da presença real de vapor d’água na atmosfera, que varia consideravelmente conforme o lugar e o tempo. Uma substância é dita higroscópica, quando ela retira umidade da atmosfera. Portanto, todos os compostos deliqüescentes são higroscópicos, mas existem muitas substâncias higroscópicas que absorvem vapor d’água sem serem deliqüescentes. Bibliografia VOGEL, A. I. Química Orgânica: Análise Orgânica Qualitativa; 1ª ed.; Rio de Janeiro: Ao Livro Técnico S.A, vol. 1, 1977. Curvas TG e DTG do ácido acetilsalicílico recristalizado comprimido, razão de aquecimento de 10,0ºC/min. sob atmosfera dinâmica de ar Curvas TG e DTG do amido sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. 2. Determinação da porcentagem de pureza de uma amostra de calcário As curvas TG e DTG de uma amostra de calcário, representadas abaixo, foram obtidas com razão de aquecimento de 40ºC/min e sob atmosfera dinâmica de ar comprimido. Analisando as curvas dê o se parecer quanto: a) estabilidade térmica do material b) porcentagem de pureza do CaCO3 3. Bibliografia - WENDLANDT, W. W. Thermal Methods of Analysis; 3ª ed.; Interscience; 1985 Curvas TG e DTG de sulfato de cobre(II) pentaidratado sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. Curvas TG e DTG de sulfato de cobre(II) pentaidratado sob atmosfera dinâmica de nirtogênio, razão de aquecimento de 10,0ºC/min. Curvas TG e DTG de sulfato de cobre(II) hidratado – exposto ao ar durante uma semana - sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. Curvas TG e DTG de bicarbonato de sódio sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. Curvas TG e DTG de sulfato de zinco heptaidratado sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. Curvas TG e DTG de sulfato de zinco hidratado – exposto ao ar durante uma semana - sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. Curvas TG e DTG de tiossulfato de sódio pentaidratado comprimido, razão de aquecimento de 10,0ºC/min. sob atmosfera dinâmica de ar Curvas TG e DTG de tiossulfato de sódio hidratado – exposto ao ar durante uma semana - sob atmosfera dinâmica de ar comprimido, razão de aquecimento de 10,0ºC/min. EFLORESCÊNCIA DE SAIS HIDRATADOS DADOS TERMOANALÍTICOS DE SAIS HIDRATADOS Perda de Massa (%) Composto Experimental Calculada Temperatura / ºC 1 H2O (%) ZnSO4.7H2O 42,37 43,84 33-311 6,26 Na2S2O3.5H2O 34,93 36,30 35–233 7,26 CuSO4.5H2O 36,03 36,08 33–296 7,22 DADOS TERMOANALÍTICOS DE SAIS HIDRATADOS EXPOSTOS AO AR DURANTE UMA SEMANA Composto Perda de Massa (%) Temperatura / ºC Experimental n* H2O ZnSO4.nH2O 34,93 29-350 5 Na2S2O3.nH2O 33,22 34-166 4,5 CuSO4.nH2O 11,68 40-290 1 * Valor obtido a partir dos dados de perda de massa experimental Experiência 2 Obtenção e Caracterização da Amônia Introdução Comercialmente a amônia pode ser obtida a partir de N2 e H2 em presença de um catalisador (ferro com pequenas quantidades de óxido de alumínio e potássio) à temperatura de 450 - 600 o C e a pressões de até 600 atm (método Haber). Pode-se obter também grandes quantidades de NH3 como sub-produto da produção do coque. No laboratório, NH3 pode ser obtido pelo aquecimento de um sal de amônio, como o NH4 Cl, com uma solução saturada de base forte, como o Ca(OH)2 . 2NH4 Cl(aq) + Ca(OH)2(s) → CaCl2(aq) + 2NH3(g) + 2H2 O(l) A amônia gasosa é extremamente solúvel em água (45 g de NH3(g) em 100 g de H2 O(l) a 25o C), apresenta cheiro "sui generis", é um gás irritante, lacrimejante e incolor. Na dissolução de amônia em água há formação de hidróxido de amônio em pequena proporção. 2 (l) NH3(g) → NH3(aq) H O NH3(aq) + H2 O(l) → NH4 OH(aq) NH4 +(aq) + OH-(aq) NH4 OH(aq) NH3(aq) + H2 O(l) NH4 +(aq) + OH-(aq) K 25 o C = [NH +4 ] [OH- ] = 1,81x10-5 (pK b = 4,75) [NH 3 ] (Uma solução 1 mol/L de NH3 é somente 0,0042 mol/L em NH4 + e OH-). Derivados: ácido nítrico, uréia e fosfato de amônio. Principais usos: fertilizantes (80 %), plásticos e fibras (10 %), explosivos (5 %). Nesta experiência, o gás NH3 será obtido e caracterizado. Parte Experimental Materiais béquer de 50 mL (1), de 250 mL (2) e de 400 mL (1); proveta de 100 mL; balão de destilação de 500 mL; bastão de vidro; funil de vidro comum; funil para pó; funil de segurança; funil de colo curto; frasco lavador de gás; tubos de ensaio (4) e suporte; conta-gotas; tubo de vidro em "T"; tubos de borracha; almofariz com pistilo; balança; vidro de relógio; espátula; conjunto para aquecimento (tripé, bico de gás, tela de amianto, fósforos de segurança); suporte metálico para buretas (3); garra (3); pinça de Mohr (5); plástico para embalagens tipo Magipack; régua; tubo de vidro de 70 cm de comprimento; algodão; rolhas; garrafa lavadeira; frascos para guardar o produto obtido. Reagentes NH4 Cl; Ca(OH)2 ;sílica-gel com indicador de umidade; HCl concentrado (d=1,18 g/mL; 36 % em massa ou 12 mol/L); soluções 0,10 mol/L de CuSO4 e NiCl2 ; solução alcoólica de fenolftaleína 1 % p/v; reagente de Nessler; papel tornassol azul e vermelho; papel indicador universal de pH. Procedimento Obtenção • Fazer a montagem conforme o esquema indicado na Figura 2.2 (trabalhar dentro da capela). • Adaptar o funil F a superfície da água contida no béquer de 250 mL (100 mL de água destilada), deixando-o mergulhar na água mais ou menos 0,5 cm. • No frasco lavador B, pode-se colocar sílica-gel com indicador de umidade, porém, a sílica-gel absorve o NH3 . • Triturar, se necessário (em um almofariz), e pesar 15 g de Ca(OH)2 em um béquer seco. • Transferir o hidróxido para o balão A com o auxílio de um funil para pó. • Dissolver 15 g de NH4 Cl em 60 mL de água destilada. • Transferir a solução de NH4 Cl para o balão A com o auxílio de um funil de vidro. • Penetrar a extremidade do tubo de vidro no interior da solução do balão A. • Vedar todas as conexões da montagem com plástico Magipack (se necessário). • Manter a pinça d fechada e a pinça f aberta. • AQUECER SUAVEMENTE A MISTURA NO BALÃO A . • Aproximar um bastão de vidro molhado em HCl as conexões da montagem. A formação de fumaça branca indica a ocorrência de vazamento de NH3 . Que reação ocorre e qual é o estado físico do produto ? • Após 10 minutos de reação efetuar os procedimentos da caracterização de NH3(g) . • Na montagem, fechar a pinça f e abrir as pinças d e g até a expulsão completa do ar. Isto será constatado pela observação da formação de muita fumaça branca, que aparecerá ao se aproximar um bastão de vidro molhado em HCl conc. da abertura da pinça g . Fechar a pinça g e recolher o gás amônia durante alguns minutos, até que a mistura reagente no balão A comece a subir no tubo de vidro. Explicar porque isto ocorre. Fig.2.2. Montagem para obtenção de NH3 . • Fechar a pinça d e abrir a pinça f . Retirar da montagem o tubo de vidro contendo a amônia, sem invertê-lo. • Continuar a aquecer (cuidadosamente), após fechar a pinça d e abrir a pinça f , até que a reação se complete. O fim da reação pode ser verificado aproximando-se um bastão de vidro molhado em HCl conc. do funil F e observando se não há mais saída de NH3 . • Depois da reação ter-se completado, retirar o aquecimento do balão A . • Fechar a pinça f . • Verificar com papel indicador universal o pH da solução obtida no béquer C . • Substituir o béquer C por um outro béquer contendo água como medida de segurança. • Fazer a caracterização de NH3(aq) . Determinação do Rendimento da Reação Calcular o rendimento teórico do processo usado. Caracterização da Amônia Caracterização do NH3(g) • Adicionar a um béquer de 500 mL cerca de 250 mL de água destilada e 10 gotas de fenolftaleína. • Imergir a extremidade do tubo no béquer preparado anteriormente, prendendo-o em um suporte, conforme indicado na Figura 2.2. Observar e anotar o resultado. Explicar. Caracterização do NH3(aq) Com a solução de amônia obtida fazer em tubo de ensaio as reações indicadas a seguir. • Com um pedaço de papel tornassol vermelho, testar e observar o que se passa quando em contato com a amônia obtida. • Adicionar 2 a 3 gotas da solução de amônia obtida à 5 gotas da solução de Cu2+. Agitar. Observar e anotar o resultado. Adicionar solução de amônia em excesso. Agitar. Observar e anotar o resultado. • Adicionar 2 a 3 gotas da solução de amônia obtida à 5 gotas da solução de Ni2+.. Agitar. Observar e anotar o resultado. Adicionar solução de amônia em excesso. Agitar. Observar e anotar o resultado. • Adicionar à 5 gotas de NH3 (aq) obtida 1 a 2 gotas do reagente de Nessler. Observar a coloração desenvolvida. Fazer uma prova em branco. (O reagente de Nessler é o complexo [HgI4 ]2- alcalinizado com solução de NaOH ou KOH). Verificação da Lei de Graham Neste experimento será verificada a lei de Graham através da medida das distâncias percorridas pelos gases HCl e NH3 no interior de um tubo fechado. A efusão de gases obedece a lei de Graham: v v 1 2 = M M 2 1 onde v1 e v2 = velocidades dos gases 1 e 2 M 1 e M 2 = massas molares dos gases 1 e 2. Fig.2.3. Montagem para determinação da velocidade de difusão dos gases NH3 e HCl. • Fixar o tubo de vidro de 70 cm de comprimento em um suporte metálico na posição horizontal. • Colocar chumaços de algodão natural nas extremidades do tubo e com o auxílio de conta-gotas umedecer simultaneamente uma extremidade com HCl conc. e a outra com NH3 conc. Tampar com rolhas apropriadas. • Iniciar a contagem do tempo. • Observar a formação de um anel e medir a posição em que foi formado. • Comparar com o valor teórico e interpretar o resultado obtido. Observação : Guardar a solução estoque em frascos especialmente rotulados para isto. Esta solução será reaproveitada posteriormente. Questionário2 Obtenção e Caracterização da Amônia 1. 2. Calcular o rendimento teórico da obtenção de amônia em gramas e em litros nas CNTP e nas condições do laboratório (verificar pressão e temperatura). Calcular a porcentagem de excesso de Ca(OH)2 usado na prática. 3. 4. 5. Dar todas as equações das reações envolvidas no experimento, inclusive as das caracterizações. Que produto se obtém da mistura de HCl(g) e NH3(g) e para que se utiliza esta reação na prática ? A que se deve a basicidade da amônia ? 6. 7. Explicar a causa do fenômeno ocorrido na experiência do tubo imerso na água contendo fenolftaleína. É mais correto chamar a solução de gás amônia em água de amônia aquosa ou solução de hidróxido de amônio ? Explique. 8. O composto insolúvel AgCl obtido na caracterização do íon cloreto com AgNO3 pode ser dissolvido com NH3. Escrever a equação da reação de dissolução. Em que NH3 e HCl parecem e em que diferem ? 9. 10. Discutir : (a) a alta polaridade da amônia. (b) sua elevada solubilidade em água. 11. Explicar a intensificação do cheiro de amônia quando a solução é aquecida ou tratada com base forte. 12. Por que não se deve pipetar NH3 concentrado ? 13. Qual o pH de uma solução 0,1 mol/L de amônia ? 14. Qual a utilidade do reagente de Nessler em saúde pública ? 15. Calcular a concentração em quantidade de matéria de NH3 concentrada (25 % em massa e d = 0,91 g/mL). Experiência 3 Obtenção e Caracterização da Água Oxigenada Introdução A água oxigenada é uma solução de peróxido de hidrogênio H2 O2 . O H2 O2 se desproporciona, decompondo-se espontaneamente: H2 O2(aq) → H2 O(l) + ½ O2 (g) Como em H2 O2 o oxigênio possui estado de oxidação -1, a água oxigenada pode atuar tanto como oxidante (mais comum) quanto como redutor (quando reage com oxidantes muito fortes). Existem 2 processos industriais de obtenção de H2 O2 . Um dos processos envolve a oxidação de etil-2-antraquinol (veja no livro “Química Inorgânica” Cotton e Wilkinson). Neste processo as matérias primas são, na realidade, H2 O, O2 e H2 e se obtém uma solução a 20 %. O outro processo consiste na eletrólise de uma solução a 50 % de H2 SO4 . Eletrólise H2 O → H2 O2 + H2 H2 SO4 Obtém-se uma solução a 30-35 %. Em ambos os casos, pode-se concentrar a água oxigenada por destilação fracionada à pressão reduzida até a 98% em massa. No laboratório, o H2 O2 é comumente obtido pela reação de peróxidos metálicos com ácidos minerais. Por exemplo: CaO 2(s) + H2 SO4 (aq) → CaSO4(s) + H2 O2(aq) A concentração de água oxigenada é expressa em % p/v ou volume de O2 (mais usado comercialmente). Volume da água oxigenada é o volume de O2(g) em mL liberado pela decomposição de 1,0 mL da solução. Encontra-se no comércio água oxigenada nas seguintes concentrações: 130 vol.=39,5 % p/v; 100 vol. = 30,4 % p/v; 20 vol. = 6,1 % p/v e 10 vol. = 3,0 % p/v. Para o cálculo das concentrações p/v e volume de O2(g) procede-se da seguinte forma: Exemplo: H2 O2 10 vol. = 3 % p/v A reação é: H2 O2(aq) → H2 O(l) + ½O 2 (g) 1 mol de H2 O2(aq) libera ½ mol de O2(g) nas CNPT Assim, VO2 (CNTP) = 1 mL sol. H 2 O 2 . 3g de H 2O 2 1 mol H 2O 2 0,5 mol O 2 22,4 L O 2 . . . 100 mL sol. H 2 O 2 34g H 2 O 2 1 mol H 2O 2 1 mol O 2 VO2 (CNTP) = 9,88 x 10 -3 L VO2 (CNTP) ≈ 10 mL Portanto, 1 mL de solução de H2 O2 a 3 % libera 10 mL de O2(g) nas CNTP. A solução é chamada de “solução de água oxigenada a 10 volumes”. A água oxigenada é usada como reagente de laboratório, como antisséptico, como alvejante, etc.. Ela é conservada em meio ácido, em frascos lisos de cor âmbar. Há substâncias como o H3 PO4 , acetanilida e maloniluréia que retardam sua decomposição e são usadas como conservadores da água oxigenada. Em contraposição, luz, calor, meio alcalino, superfície rugosa, presença de íons metálicos (tais como Fe3+ e Cu2+ ) aceleram sua decomposição. Parte Experimental Materiais béquer de 50 e de 250 mL; proveta de 5 e de 50 mL; bureta de 50 mL; erlenmeyer de 250 mL (3); balão volumétrico de 250 mL; pipeta volumétrica de 20 mL; bastão de vidro; funil de vidro comum; tubos de ensaio (4) e suporte; conta-gotas; papel de filtro; suporte para funil de vidro comum; cápsula de porcelana grande (para banho de gelo); balança; espátula; vidro de relógio; garrafa lavadeira; gelo; frascos para guardar o produto obtido. Reagentes e indicadores H3 PO4 concentrado (d=1,75 g/mL; 89 % em massa); H2 SO4 diluído (1:5); BaO2 ; éter; dispersão de amido recentemente preparada; soluções 0,1o mol/L de: K2 CrO 4 , FeCl3 , KI, CuSO4 , NaOH e H2 SO4 ; solução padronizada de KMnO 4 ; H2 O2 a 10 volumes. Procedimento Obtenção • Transferir 3,0 g de BaO 2 para um erlenmeyer de 250 mL e adicionar 20 mL de água destilada fria em pequenas porções, agitando o frasco vigorosamente após cada adição. Observar e explicar porque se faz a agitação. • Em um béquer de 50 mL diluir 3,0 mL de H3 PO4 conc. em 20 mL de água destilada, resfriando se necessário. • Adicionar a solução ácida à suspensão de BaO 2 em pequenas porções. Agitar bem após cada adição e conservar a solução fria em banho de gelo. Explicar porque se faz o resfriamento. • Após ter sido adicionado todo o ácido, aguardar a sedimentação e filtrar utilizando filtração simples usando 2 folhas de papel de filtro pregueadas separadamente e recebendo o filtrado em um béquer de 250 mL. Quais são as substâncias retidas no filtro ? • Adicionar vagarosamente ao filtrado, sob resfriamento, 15 mL de solução 1:5 de H2 SO4 . • DEIXAR SEDIMENTAR O PRECIPITADO FORMADO. • Filtrar usando filtração simples utilizando 2 folhas de papel de filtro. Quais são as substâncias retidas no filtro ? • Centrifugar se necessário. • Transferir o filtrado para um balão volumétrico de 250 mL e completar o volume com água destilada. O que contém o filtrado ? Equações BaO 2(s) + H3 PO4(aq → BaHPO4 (pouco solúvel) + H2 O2(aq) BaHPO4(aq) + H2 SO4 (aq) → BaSO4(s) + H3 PO4 (aq) * BaO 2(s) + H2 SO4 (aq) → BaSO4(s) + H2 O2 (aq) * O H3 PO4 atua como conservador. Determinação do Rendimento • Pipetar 20,00 mL de água oxigenada obtida e transferir para um erlenmeyer de 250 mL. Juntar 20,0 mL de H2 SO4 diluído (1:5) e titular com solução padronizada de KMnO 4 cerca de 0,0200 mol/L, até viragem para róseo. Explicar como ocorre a viragem para róseo sem o uso de indicador. • Repetir este procedimento mais uma vez e tirar a média. • Calcular o rendimento da reação. • Calcular a porcentagem p/v e o volume de O2 da água oxigenada obtida. • Comparar o rendimento encontrado com o rendimento teórico para este processo. Caracterização de H2 O2 Fazer em tubo de ensaio as reações indicadas a seguir. • Adicionar a um tubo de ensaio 10 gotas de solução de K2 CrO 4 , 5 gotas de H2 SO4 (1:5), 20 gotas de éter e 10 gotas da solução estoque de água oxigenada. Não agitar a mistura. Observar e explicar o ocorrido. • Colocar em um tubo de ensaio 10 gotas de solução de iodeto de potássio e 5 gotas de H2 SO4 dil. (1:5). A seguir, adicionar 10 gotas da solução estoque de água oxigenada. Agitar. Observar e anotar o resultado. Adicionar gotas de dispersão de amido. Observar e explicar o ocorrido. • Colocar 10 gotas de H2 O2 a 10 volumes em 4 tubos de ensaio. Adicionar sucessivamente aos 4 tubos 2 gotas de solução 0,10 mol/L dos seguintes reagentes: H2 SO4 , NaOH, FeCl3 , CuSO4 . Usar um só reagente em cada tubo. Observar o que ocorre, comparar os resultados e explicálos. Observação: Guardar a solução obtida em frascos especialmente rotulados para isto. Questionário 3 Obtenção e Caracterização da Água Oxigenada 1) 2) Dar as equações de todas as reações efetuadas nesta prática. Por que a água oxigenada pode atuar tanto como oxidante quanto como redutor ? Citar um exemplo de reação química de cada caso. 3) 4) O PERIDROL é uma água oxigenada a 40 % p/v. Qual é a sua concentração expressa em volume de O2 ? A água oxigenada se decompõe espontaneamente. Se você tivesse o H2 O2 com KMnO4 em meio ácido, o que você observaria visualmente: 5) 6) a) se ele estivesse bom ? b) se ele estivesse totalmente decomposto ? Citar um agente que em contato com H2 O2 acelera e um que retarda a sua decomposição. H2 O2 puro pode ser usado juntamente com combustível apropriado em motores de foguete. Para que serve o H2O2 neste caso ?
Documentos relacionados
utilização e organização dos laboratórios escolares
 1. Colocar um pouco da amostra a analisar, devidamente
alcalinizada, num tubo de ensaio.
2. Aproximar da boca do tubo de ensaio um pedaço de fita de
papel vermelho de tornesol, previamente humedeci...
1. Colocar um pouco da amostra a analisar, devidamente
alcalinizada, num tubo de ensaio.
2. Aproximar da boca do tubo de ensaio um pedaço de fita de
papel vermelho de tornesol, previamente humedeci...