Lista 3: Espectroscopia
Transcrição
Lista 3: Espectroscopia
Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia 1) O berílio(II) forma um complexo com a acetilacetona (166,2 g/mol). Calcular a absortividade molar do complexo, dado que uma solução 1,34 ppm apresenta uma transmitância de 55,7% quando medida em uma célula de 1,00 cm a 295 nm, o comprimento de onda de máxima absorção. Resposta: O cálculo da absorvidade é realizado pela fórmula: A = ε . b . c sendo A correspondente a Absorvidade, ε absorvidade molar, b caminho óptico e c concentração em mol/L. Para realizar esse cálculo é preciso transformar a concentração de 1,34 ppm para unidade em mol/L, como 1,34 ppm a 1,34 mg/L ou 1,34.10-3 g/L. Para transformar massa em mol, basta fazer a divisão pela massa molar já informada (166,2 g/mol). 1,34.10 -3 g/L / 166,2 g/mol resulta em 8,0.10-6 mol/L. A transmitância deverá ser transformada em absorbância e realizar o cálculo final: 2) Um composto X deve ser determinado por espectrofotometria UV/visível. Uma curva de calibração é construída a partir de soluções padrão de X com os seguintes resultados: (0,50 ppm, A_0,24); (1,5 ppm, A_0,36); (2,5 ppm, A_0,44); (3,5 ppm, A_0,59); (4,5 ppm, A_0,70). Uma amostra de X forneceu uma absorbância igual a 0,50 nas mesmas condições de medida dos padrões. Encontre a inclinação e a interseção da curva de calibração, o erro padrão em y, a concentração da amostra de X de concentração desconhecida, o desvio padrão na concentração de X. Construa um gráfico da curva analítica e determine, ppm A 0,50 0,24 1,50 0,36 2,50 0,44 Absorbância empregando o gráfico, a concentração da amostra. 0,80 0,70 0,60 0,50 0,40 0,30 0,20 0,10 0,00 y = 0,115x + 0,1785 R² = 0,9935 0,00 1,00 2,00 3,00 Concentração (ppm) Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br 4,00 5,00 Centro Universitário Padre Anchieta Resposta: Na Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia tabela abaixo estão listados os dados da curva 3,50 0,59 de calibração: 4,50 0,70 0,80 0,70 Absorbância 0,60 X 0,50 0,40 0,30 0,20 2,79 0,10 0,00 0,00 1,00 2,00 3,00 4,00 5,00 Concentração (ppm) Gráfico 2: Indica valor correspondente ao ponto da absorbância do composto X. Tabela abaixo mostra como os dados de desvio padrão foram obtidos no excel: ppm A 0,50 0,24 Coeficiente Angular 1,50 0,36 Paramentro 0,1150 0,1785 2,50 3,50 0,44 0,59 Desvio-padrão R^2 0,0054 0,9935 0,0155 0,0170 4,50 0,70 2,79 0,50 Saida da PROJ.LIN Coeficiente Linear Desvio-padrão (Y) Células marcadas I3:J5 Digite "=PROJ.LIN(C2:C6;B2:B6;VERDADEIRO;VERDADEIRO)" Aperte CRTL + SHIFT + ENTER fórmula do excel (colocar = antes) PREVISÃO(C8;B2:B6;C2:C6) F(X) = 0,1150 ± 0,0054 X + 0,1785 ± 0,0155 3) Quais são os cinco componentes principais utilizados nos equipamentos de espectroscopia óptica (molecular e atômica). Resposta: Os cinco componentes são: Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia 1- Fonte de radiação (energia): Responsável pela excitação eletrônica dos compostos em estudo. 2- Seletor de comprimento de onda (grade de difração ou prismas): Sistema responsável para isolar da radiação total um comprimento de onda específico () para que ser sobreposto a amostra em estudo. 3- Sistema amostral (amostra): Após a seleção do comprimento de onda () o sistema amostral é o local onde é disposto a amostra em estudo para que seja incidido a radiação. 4- Detector (TFM, Diodos, CCD...): O detector na verdade é um transdutor que transforma a radiação luminosa () incidente em sinal elétrico para o processador. 5- Processador de dados (CPU): Atualmente os processadores de dados são realizados no equipamento por sistemas elétricos/computacionais, a fim de medir a quantidade de corrente elétrica e transformar em gráficos, ou dados de tabelas. 4) Por que há equipamentos com dois tipos de lâmpadas, por exemplo uma lâmpada de H2 e D2 e outra de tungstênio/halogênio? Skoog, FQA, Pg.707. Resposta: As lâmpadas de H2 ou D2 são emissoras de radiação na região do ultravioleta, enquanto as lâmpadas de tungstênio/halogênio são responsáveis para emissão de radiação na região do visível e no infravermelho. 5) Qual a função da fenda existente de espectroscopia? Skoog, FQA, Pg.713. Resposta: A fenda possui a função de atenuar o feixe de radiação que será incidente na amostra ou o feixe de radiação emitido. A absorção de radiação é diretamente dependente da concentração, das espécies absorventes. Se o feixe de radiação incidente ao detector com alta intensidade ocorre saturação do detector e as medidas tornam incorretas, ao mesmo tempo se o feixe de radiação for muito atenuado, a radiação que irá incidir ao detector poderá estar próximo ao limite de detecção e também poderá gerar dados incorretos. Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia 6) Quais os principais detectores de radiação utilizados em espectroscopia óptica e descreva o funcionamento de uma fotomultiplicadora. Skoog, FQA, Pg.719-723. Resposta: Os principais detectores de radiação eletromagnética são: - tubos fotomultiplicadores (TFM); - arranjo de fotodiodos de sílico; - fototubos; - células fotocondutivas; Todos os detectores de fótons são baseados na interação da radiação com uma superfície reativa para produzir elétrons (fotoemissão) ou para promover elétrons para os estados energéticos nos quais podem conduzir eletricidade (fotocondução). Somente as radiações UV, visível e infravermelha próxima possuem energia suficiente para provocar a fotoemissão; assim, os detectores fotoemissivos estão limitados a comprimentos de onda menores que 2 mm (2.000 nm). Os fotocondutores podem ser empregados nas regiões do IV próximo, médio e distante do espectro. 7) Esboce um diagrama de um espectrofotômetro de simples feixe, com os principais instrumentos listados na questão 3. Resposta: As figuras abaixo mostram diagramas de simples feixe de um espectrofotometro. Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia 8) Esboce um diagrama de um espectrofotômetro de duplo feixe, com divisor de feixe espacial e com divisor de feixe temporal, e apresente os principais instrumentos listados na questão 3. Skoog, FQA, Pg.730. Resposta: 9) Explique ou descreva um modelo que ilustre a absorção de um determinado comprimento de onda (energia) em nível molecular. Resposta: Geralmente a absorção de energia está associada a uma transição eletrônica do nível fundamental de energia de um orbital atômico ou de um orbital molecular para um orbital de maior energia que é denominado orbital excitado. A absorção segue o princípio mostrado na figura abaixo, no esquema (a) a amostra recebe a radiação incidente P0 e transmite a radiação P, a diferença entre P 0 - P é igual à Absorbância. Essa absorbância é responsável para excitação eletrônica Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia dos elétrons no estado fundamental 0, como demostra o esquema (b), para os níveis 1 ou 2, com as energias correspondentes E 1 ou E2. No esquema (c) é mostrado um espectro da absorção das energias E 1 e E2. No caso de moléculas geralmente o nível fundamental que é excitado é o HOMO (orbital molecular de maior energia ocupado) e o nível de excitação de maior energia é o LUMO (orbital molecular de menor energia desocupado. 10) Se um analista desejar prever um espectro na região do ultravioleta/visível do hexano (CH3CH2CH2CH2CH2CH3), sabendo que só há ligações C-H e C-C quais os tipos de transições possíveis e qual a faixa que elas seriam apresentadas. Qual o tipo de equipamento que deveria ser utilizado para a visualização do espectro? Xa) UV-vácuo; b) UV-próximo (near); ou c) VIS-Vísivel. Justifique sua escolha. Resposta: O hexano só possui ligações simples entre os carbonos assim não ocorre o efeito de conjunção (pi) que é responsável para o deslocamento do comprimento de onda () e aumento da absorvidade molar(ε). A região correspondente a C-C e C-H são por volta de 150 – 180 nm, dessa maneira o item de escolha devem ser a resposta A, pois a faixa corresponde a absorção no UV. Usa-se UV-Vácuo devido à alta absorção da molécula de agua que sai na mesma região. 11) Por qual razão o licopeno apresenta-se com coloração vermelha? Justifique a absorção de radiação do licopeno visto que uma dupla possui transição π π* na ordem de 200 nm (região do ultravioleta = invisível) Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia Resposta: O licopeno possui coloração vermelha, pois ocorre o efeito de conjunção (pi) que é responsável para o deslocamento do comprimento de onda () e aumento da absorvidade molar(ε). A coloração vermelha é a transmitida (vista), mas a absorção é verde-azulado, na faixa de 460-500 nm. 12) Descreva as diferenças básicas entre a espectroscopia de absorção a e de emissão atômicas. Skoog, FQA, Pg.797 Resposta: A espectroscopia de absorção atômica necessita de uma lâmpada de cátodo oco (específica para cada amostra) para excitação atômica, enquanto na espectroscopia de emissão atômica a excitação é realizada via plasma (ICP) que possui alto poder de excitação. O fato da espectroscopia de absorção atômica necessitar de uma lâmpada de cátodo oco específica para cada elemento de análise acarreta a limitação da diversidade de análises por conta da disponibilidade de lâmpadas, no entanto o custo operacional do equipamento é menor. Já na espectroscopia de emissão atômica a diversidade de análises não é limitada ao sistema, no entanto o custo operacional é alto para manter o funcionamento do plasma, em geral se gasta 20 L de argônio por minuto. Ambos os equipamentos possuem limites de absorção típicos, assim devem ser realizados estudos para aquisição destes equipamentos. 13) A respeito de espectroscopia atômica, defina os seguintes conceitos: (a) atomização. (b) nebulizador. (c) plasma. (d) lâmpada de cátodo oco. Resposta: Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia (a) Atomização: é a primeira etapa de todos os procedimentos de espectroscopia atômica é a atomização, um processo no qual a amostra é volatilizada e decomposta de forma a produzir uma fase gasosa de átomos e íons. A eficiência e a reprodutibilidade da etapa de atomização pode ter grande influência na sensibilidade, precisão e exatidão do método. Em resumo, a atomização é uma etapa crítica em espectroscopia atômica. (b) Nebulizador: Os métodos gerais de se introduzir as soluções das amostras no plasma e nas chamas. A nebulização direta é empregada com maior freqüência. Nesse caso, o nebulizador introduz constantemente a amostra na forma de uma nuvem de gotículas, denominada aerossol. Com essa introdução contínua da amostra na chama ou no plasma, é produzida uma população em estado estacionário de átomos, moléculas e íons. (c) Plasma: Os atomizadores de plasma, os quais se tornaram disponíveis comercialmente em meados dos anos 1970, oferecem diversas vantagens em espectroscopia atômica analítica. A atomização em plasma tem sido empregada para emissão, fluorescência e espectrometria de massa atômica. Por definição, um plasma é uma mistura gasosa condutiva contendo uma concentração significativa de cátions e elétrons. No plasma de argônio utilizado para a espectroscopia atômica, os íons argônio e elétrons são as espécies condutoras principais, embora os cátions da amostra possam também contribuir. Os íons argônio, uma vez formados no plasma, são capazes de absorver potência suficiente de uma fonte externa para manter a temperatura em um dado nível, de forma que a ionização adicional sustenta o plasma indefinidamente; temperaturas tão altas como 10.000 K são obtidas. (d) Lâmpada de cátodo oco: fonte de radiação mais útil para a espectroscopia de absorção atômica é a lâmpada de cátodo oco. Esta consiste em um ânodo de tungstênio e de um cátodo cilíndrico selado em um tubo de vidro, contendo um gás inerte, como o argônio, a pressões de 1 a 5 torr. O cátodo é fabricado com o metal do analito ou serve de suporte para um recobrimento desse metal. Aplicando-se cerca de 300 V através dos eletrodos produz-se a ionização do argônio e a geração de uma corrente de 5 a 10 mA quando os cátions e os elétrons migram para os eletrodos. Se o potencial é suficientemente alto, os cátions de argônio se chocam com o cátodo com energia suficiente para desalojar alguns átomos do metal e assim produzir uma nuvem atômica; esse processo é denominado sputtering. 14) Monte um diagrama que ilustre os processos atômicos envolvidos na espectroscopia de absorção atômica e emissão atômica, bem como os componentes dos instrumentos facilitadores para ação requerida. Resposta: Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia Esquema de um equipamento de espectroscopia de absorção atômica. Esquema de um equipamento de espectroscopia de emissão atômica. Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br Centro Universitário Padre Anchieta Análise Química Instrumental Prof. Vanderlei Paula – [email protected] Gabarito da Lista 3: Espectroscopia Diagrama de energia e seu gráfico correspondente de absorção de energia. Prof. Vanderlei I Paula – contato: [email protected] www.aquitemquimica.com.br
Documentos relacionados
Gabarito Lista-2 - Aqui Tem Química
 17) Monte as reações de neutralização total entre os seguintes ácidos e bases:
a) H2CO3 + 2 NaOH Na2CO3 + 2 H2O
b) H2SO4 + 2 NaOH Na2SO4 + 2 H2O
c) 3 H2SO3 + 2 Al(OH)3 Al2(SO3)3 + 6 H2O
d) H3...
17) Monte as reações de neutralização total entre os seguintes ácidos e bases:
a) H2CO3 + 2 NaOH Na2CO3 + 2 H2O
b) H2SO4 + 2 NaOH Na2SO4 + 2 H2O
c) 3 H2SO3 + 2 Al(OH)3 Al2(SO3)3 + 6 H2O
d) H3...
Centro Universitário Anchieta
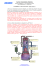 o que absorve grande quantidade de calor, consequentemente a temperatura é reduzida
o suficiente para liquefazer o ar atmosférico (N2 e O2),ou seja, passagem na fase
líquida. O líquido é então aque...
o que absorve grande quantidade de calor, consequentemente a temperatura é reduzida
o suficiente para liquefazer o ar atmosférico (N2 e O2),ou seja, passagem na fase
líquida. O líquido é então aque...







