Cisto Epidermóide
Transcrição
Cisto Epidermóide
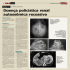
Este encarte é parte integrante da edição de nº 304 do Jornal da Imagem Reunião do Clube Roentgen - Outubro de 2003 Escola Responsável: Hospital Nove de Julho Coordenadores: Dr. Fernando A. Moreira e Dra. Luciana P. S. Baptista São Paulo, dezembro de 2003 Caderno Dois Dr. Eduardo Bancovsky Cisto Epidermóide História Clínica Masculino, 66 anos, branco. H.P.M.A.: Deu entrada no PS deste serviço com quadro de confusão mental e cefaléia intensa. Exames físico e laboratorial: Sem alterações significativas. Realizou TC e RM sem contraste por solicitação dos familiares. Diagnóstico Cisto Epidermóide Discussão Os cistos epidermóides podem ter origem congênita ou mais raramente adquirida. Cistos epidermóides congênitos são na verdade cistos de inclusão não neoplásicos. Surgem provavelmente da inclusão de elementos epiteliais da ectoderme no período de fechamento do tubo neural, entre a 3a e a 5a semanas de gestação ou durante a formação das vesículas cerebrais secundárias. Os adquiridos são resultantes de trauma e nestes casos, a epiderme é implantada nos tecidos profundos subjacentes, formando um cisto que tem seu crescimento relacionado à descamação de queratina. São lesões císticas bem definidas que se insinuam ao longo das cisternas liquóricas, apresentando superfície externa normalmente lobulada, freqüentemente de aspecto peroláceo. O interior da lesão é preenchido por material queratohialínico resultante da descamação progressiva de parede cística. Podem envolver vasos e nervos, invaginando-se profundamente no tecido encefálico adjacente. O crescimento tumoral é lento e maleável, tendendo a se adaptar ao formato das estruturas adjacentes. Acometem indivíduos entre 20 e 60 anos de idade, com pico de incidência na 4a década, sem predileção por sexo. Quanto a localização, 90% são intradurais, ocorrendo primariamente nos espaços subaracnóides basais. Cerca de 40 a 50% são encontrados nas cisternas ângulo-pontocerebelares, sendo a 3a massa mais comum nesta topografia (schwanoma do acústico e meningioma são as mais comuns). Nas regiões supra e para-selar, sua incidência é cerca de 7%. A localização intra-axial é incomum. Dentre os Figura 1 : TC de crânio sem contraste: Imagem hipodensa arredondada em topografia do III ventrículo, com coeficiente de atenuação de gordura, observando-se dilatação dos ventrículos laterais, mais importante à esquerda. quatro ventrículos, o quarto é o mais acometido. Raramente ocorrem nos hemisférios cerebrais ou tronco encefálico. Aproximadamente 10% são extradurais, a maioria intradiplóicos, nos ossos frontal, parietal e occipital. Características Radiológicas O aspecto tomográfico é de lesão hipodensa, de contornos bem definidos, com densidade semelhante à do líquido cefalo-raquidiano (LCR), contendo calcificações em 10-25% dos casos. Ocasionalmente podem aparecer hiperdensos, em decorrência de sangramento, conteúdo protéico elevado ou depósito de pigmentos que contenham ferro. À ressonância magnética (RM) tipicamente apresentam tempos de relaxamento longos tanto em T1 como em T2 e características de sinal semelhantes às do LCR. Raramente apresentam intensidade mista de sinal. Apresentam margens lobuladas, com leve aumento na intensidade de sinal em relação à porção central do cisto. Em alguns casos, podemos observar uma margem Figuras 2 e 3: RM de crânio, cortes axiais (Figura 2: T2; Figura 3: FLAIR). Imagem nodular, heterogênea, de contornos anfractuosos, em topografia do III ventrículo, com região central apresentando hipersinal nas seqüências T2 e FLAIR, obliterando os forâmes de Monro, com dilatação associada dos ventrículos laterais, notadamente à esquerda, com sinais de transudação ependimária. Figuras 4 e 5: A lesão descrita apresenta hipersinal na seqüencia de difusão e leve hipersinal periférico com hipossinal central no mapa de ADC. hiperintensa fina que provavelmente representa LCR represado ao redor da lesão. Alguns cistos epidermóides aparecem iso ou mesmo hiperintensos em relação ao parênquima encefálico nas imagens ponderadas em T1, sendo chamados de “epidermóides brancos”, apresentando alto teor lipídico na espectroscopia. Em contrapartida, epidermóides com valores de T1 longos (epidermóides pretos) apresentam conteúdo lipídico reduzido à espectroscopia. Astrocitomas císticos, hemangioblastomas e outras lesões hipodensas das cisternas também podem ser raramente confundidos com tumores epidermóides. Devemos considerar ainda: ependimoma, subependimoma, neurocitoma, astrocitoma subependimário de células gigantes, papiloma de plexo coróide, carcinoma de plexo coróide, meningioma e metástase, que devido à possibilidade de apresentação intraventricular podem ser incluídos no diagnóstico diferencial. Diagnóstico Diferencial Referências Bibliográficas Embora schwanomas completamente císticos possam mimetizar tumores epidermóides, o diagnóstico diferencial mais importante a ser considerado é o cisto aracnóide. Aquisições de RM em difusão podem ser úteis na diferenciação entre os cistos aracnóides e os epidermóides. O coeficiente de difusão aparente (ADC) do cisto aracnóide é similar ao da água estacionária, enquanto o ADC dos tumores epidermóides é similar ao do parênquima cerebral. 1- Osborn, A.G.; Diagnostic Neuroradiology, St Louis: Mosby, 1994. 2- Som, P.M.; Curtin, H.D.; Head and Neck Imaging- 3a ed St Louis: Mosby, 1996. 3- Atlas, S.W.; MRI of the Brain and Spine. New York: Raven Press, 1991. 4- Koeller, K.K.; Sandberg, G.D.; Cerebral intraventricular neoplasms: radiologic pathologic correlation. Radiographics, 22(6): 1473-1505, 2002. 2 Caderno Dois São Paulo, dezembro de 2003 Feocromocitoma Dr. Daniel B. Pedral Sampaio História Clínica MSL, 33 anos, masculino, branco, natural e procedente de São Paulo. H.P.M.A.: Quadro de cefaléia holocraniana associada a dor lombar, febre e calafrios há dois dias. Nega outras alterações associadas ou relato de antecedentes importantes. Exame Físico: Abdome globoso, flácido, RHA +, sem visceromegalias, não há sinal de dor à descompressão brusca, giordano negativo. Pressão Arterial 120 x 80 mmHg. Febre (38° C). Exame neurológico normal. Exames Laboratoriais: · Metanefrina urinária : 1500 mcg/24 h (normal até 1.000). · Noradrenalina urinária : 560 mcg/24 h (normal até 55). Diagnóstico Feocromocitoma Discussão A prevalência de feocromocitomas confirmados à autópsia é de 0,13% e essas neoplasias incomuns são responsáveis por 0,1 a 0,3% dos casos de hipertensão arterial. Ocorre liberação sistêmica de epinefrina, norepinefrina e, em alguns casos, de dopamina01,02. É o tumor funcionante mais comum da adrenal03. O tumor é composto por células cromafins que são embriologicamente derivados do neuroectoderma. Além das catecolaminas, os feocromocitomas podem produzir vasopressina, somatostatina, substância P, Interleucina-6, calcitonina e outras substâncias que podem contribuir para manisfestações atípicas02. Seguindo a “regra dos 10”, aproximadamente 10% dos feocromocitomas são extra-adrenais, bilaterais, extra-abdominais, malignos, familiares, pediátricos ou sem elevação dos níveis pressóricos01,04. Os feocromocitomas extra-adrenais, denominados de paragangliomas secretores de catecolaminas, associam-se intimamente ao órgão de Zuckerkandl, cadeia simpática em nível da bifurcação aórtica01,04. Os feocromocitomas familiares exibem transmissão autossômica dominante, sendo associados à síndrome de von Hippel-Lindau, neurofibromatose tipo I e síndromes de neoplasia endócrina múltipla tipo I e II01. Aproximadamente 90% dos feocromocitomas liberam catecolaminas, sendo a história típica de hipertensão refratária à terapia medicamentosa usual, respondendo apenas aos antagonistas aadrenérgicos. A tríade clássica de sintomas do feocromocitoma é de palpitações, diaforese e cefaléia, sendo que 90% dos pacientes tem um ou mais elementos dessa tríade. Outros sintomas encontrados são palidez, vermelhidão, náusea, tremores, fadiga, ansiedade e dor01. Caracteristicamente os sintomas são paroxísiticos e elicitados por mudanças de decúbito ou por aumento da pressão abdominal. Atualmente a pesquisa clínica mais recomendada é a avaliação dos níveis urinários em 24 horas das catecolaminas e seus metabólitos01. O tratamento definitivo do feocromocitoma é a excisão cirúrgica, acrescentando o bloqueio aadrenérgico pré-operatório e o seguimento dos níveis de catecolaminas e derivados na urina de 24 horas para averiguar se há tumor residual, outra lesão primária ou metástases. Feocromocitomas malignos e benignos são indistinguíveis à análise histológica. Lesões benignas podem ser localmente invasivas, invadir estruturas Figuras 1 e 2 - TCH do abdome sem e com contraste: formação sólida, hipervascular, de contornos lobulados, contendo áreas de necrose/liqüefação, localizada no retroperitôneo em situação interaortocaval anterior, deslocando anteriormente a terceira porção do duodeno. Há compressão da veia mesentérica superior sem sinais de trombose. adjacentes como VCI ou cápsula renal. Os feocromocitomas são considerados malignos quando metástases estão presentes (13% dos casos). Sítios comuns de metástases são o esqueleto axial, fígado, pulmões e linfonodos retroperitoneais ou mediastinais. A taxa de sobrevida em 5 anos do feocromocitoma maligno é de menos de 50%02. Características Radiológicas O diagnóstico por imagem é utilizado para a localização da neoplasia. A tomografia computadorizada (TC) atualmente é a modalidade de escolha para a investigação de feocromocitoma e para o estudo das glândulas adrenais e do retroperitôneo. A aparência típica do feocromocitoma é de uma massa de tecidos moles arredondada, bem circunscrita, homogênea, medindo acima de 3,0 cm. A calcificação é muito rara01,04. O uso do meio de contraste iodado para caracterização da lesão pela TC é controverso na literatura, tendo em vista os riscos intrínsecos, não sendo necessário para a detecção da maioria das lesões considerando o seu tamanho, mas pode ajudar na caracterização e detecção de lesões extra-adrenais. Na maioria das lesões o realce é heterogêneo. Há uma discussão em torno de se administrar o bloqueio a-adrenérgico antes da administração do meio de contraste iodado, pois poderia aumentar os níveis de catecolaminas. Hoje, a maioria dos serviços prefere utilizar meios de contraste não-iônicos e não utilizar bloqueio adrenérgico para a administração do meio de contraste intravenoso, sendo necessário na investigação por arteriografia01,04. As características à ultassonografia são bastante variáveis, sendo arredondados e bem circunscritos na maiorias dos casos e são isoecóides a hipoecóides em relação ao parênquima renal01. Na ressonância magnética, pequenos feocromocitomas são isointensos ao músculo e hipointensos ao fígado em T1. Nas imagens pesadas em T2 são hiperintensos. Como são pobres em gordura, o sinal não cai nas seqüências “out-of-phase”01. A radiocintilografia com Iodo131 Meta-iodo-benzilguanidina (I131MIBG) ajuda na localização da lesão primária ou secundárias. I131MIBG é um análogo da guanetidina e compete com a noradrenalina na captação dos receptores, tendo uma sensibilidade de 85% e uma especificidade de 96% para visualização de feocromocitomas produtores de catecolaminas01. São lesões bastante vascularizadas, desenvolvendo ocasionalmente degeneração cística focal ou parcial. A degeneração cística subtotal ou total é bastante incomum. Postula-se que a degeneração cística ocorre por crescimento excessivo em relação ao suporte vascular. Os componentes císticos refletem necrose e liquefação. O diagnóstico diferencial de lesões adrenais císticas inclui cisto adrenal, pseudocisto, carcinoma adrenal e feocromocitoma01. Referências Bibliográficas 1. Lee, T.H.; Slywotzky, C.M.; Lavelle, M.T.; Garcia, R.A.; Radiographics. 2002;22:935-940. 2. Greenspan, F.S.; Gardner, D.G.; Basic & Clinical Endocrinology, Sixth edition, Lange Medical Books/ McGraw-Hill, cap11, p411-420. 3. Taveras, J.M.; Radiology on CD, 1995 CD-ROOM Edition, The Adrenal gland, v4, cap82. 4. Suton, D.; Tratado de Radiologia e diagnóstico por imagem,, sexta edição, Revinter, cap36, vII, p1079-1083. Figuras 3 (RM FSE T1), 4 (RM FSE T2), 5 (RM T1 pós-contraste) e 6 (AngioRM com gadolíneo Reconstrução MIP) - Massa sólida, heterogênea contendo áreas de liquefação ou necrose central, apresentando contornos bocelados, medindo 6,8 x 6,5 x 4,0 cm, localizada no retroperitôneo, limitada pela aorta abdominal e VCI inferiormente, superiormente pela terceira porção duodenal. Caracteriza-se por hipossinal nas imagens ponderadas em T1, leve hipersinal em T2, com realce heterogêneo após o contraste. A lesão comprime a VCI sem obstruir ou invadi-la, desloca superiormente a terceira porção duodenal e os vasos mesenteriais. São Paulo, dezembro de 2003 Caderno Dois 3 Tumor Carcinóide do Pulmão Dra. Renata Belletato Scaion Figura 1 - Raio-X de tórax em P.A.: opacidade homogênea regular, adjacente a borda cardíaca direita, indissociável desta e obliteração do seio costo-frênico ipsilateral. Figura 2 - TC axial de tórax sem contraste: opacidade heterogênea e áreas calcificadas de permeio no lobo inferior direito, com derrame/ espessamento pleural associado. Historia clínica L.R.D.M.S.J., 20 anos, masculino, branco, natural e procedente de Guarulhos – SP. H.P.M.A: Apresentou-se com tosse, febre e expectoração há mais ou menos 15 dias com piora da tosse há aproximadamente 2 dias associado à cefaléia e dor de garganta refratária ao uso de medicamentos. Negava quaisquer outras alterações ou antecedentes patológicos. Ao exame físico estava febril com temperatura axilar de 39ºC. Murmúrio vesicular reduzido no hemitórax direito. Laboratório: · Leucograma: 17.000. · Líquor: normal. · Realizados raio-X e tomografia computadorizada (TC) de tórax. Diagnóstico Tumor Carcinóide Discussão O carcinóide brônquico é atualmente classificado como um tumor neuroendócrino do pulmão. Ele cresce do epitélio brônquico e bronquiolar e é derivado de células de Kulthitsky, corpos neuroepiteliais e células totipotentes brônquicas. Tem a capacidade de sintetizar, armazenar e secretar hormônios peptídeos e neuroaminas como a serotonina, ACTH, somatostatina e bradicinina. Ocorre com maior freqüência no TGI (90% dos casos) e em segundo lugar no pulmão, sendo, porém uma neoplasia rara neste local, representando apenas 1 a 2% das neoplasias pulmonares. Em geral atinge a população uma década mais cedo do que o carcinoma broncogênico, com média de idade de 45,5 anos. O carcinóide brônquico representa a neoplasia pulmonar primária mais comum na criança Figuras 3, 4 e 5 - TC axial do tórax pós-contraste: volumosa massa infrahilar, retro e paracardíaca, no lobo inferior direito, com áreas de calcificação de permeio, realçando heterogeneamente após o contraste, associada a importante componente de consolidação do espaço aéreo/atelectasia sobrejacente, com brônquios dilatados e preenchidos por conteúdo hipodenso. Derrame pleural laminar basal posterior à direita coletado em decúbito dorsal horizontal. e na adolescência tardia. Afeta igualmente homens e mulheres e tem prevalência maior em brancos do que em negros, não existindo associação com o fumo ou outros agentes carcinogênicos. Podem ser classificados de acordo com sua localização em centrais (80%) e periféricos (20%). Por outro lado, podem também ser classificados segundo sua agressividade variando de uma neoplasia mais branda como típicos de baixo grau, atípico de grau intermediário até o carcinoma neuroendócrino de grandes células de alto grau e carcinoma de pequenas células, de acordo com seu comportamento clínico e achados histológicos. Muitos pacientes são assintomáticos, sendo o diagnóstico um achado de exame. Os sintomas clínicos incluem tosse, febre, expectoração, hemoptise, dor torácica, dispnéia e pneumonia obstrutiva. Na faixa pediátrica raramente os pacientes são assintomáticos apresentando-se muitas vezes com tosse, hemoptise ou pneumonia, sendo que chiado, pneumonia e atelectasia estão presentes em aproximadamente 50% dos pacientes com carcinóide brônquico. A síndrome carcinóide é raramente vista em pacientes com carcinóide brônquico e normalmente encontrada naqueles que tem metástases hepáticas. As metástases ocorrem em aproximadamente 15% dos casos e normalmente são para o fígado, ossos, adrenais e cérebro. A taxa de sobrevida em 5 e 10 anos é de 92% e 88% respectivamente, sendo altamente dependente dos achados histológicos, apresentando um excelente prognóstico mesmo com metástases linfonodais ipsilaterais. Pacientes com carcinóides atípicos tem um pior prognóstico com taxas de sobrevida em 5 e 10 anos de 69% e 24-52%, respectivamente. De acordo com o estudo de Gould e colaboradores, o tamanho do tumor, subtipo histológico e envolvimento linfonodal são os fatores que mais influenciam a recorrência e sobrevida. O único tratamento efetivo para o carcinóide brônquico é a ressecção cirúrgica completa do tumor primário, mas na grande maioria dos carcinóides atípicos, a cirurgia não é curativa. Características Radiológicas Carcinóides típicos e atípicos tem padrões imaginológicos semelhantes sendo a manifestação mais comum massa hilar ou peri-hilar que pode ser um achado isolado ou estar associado com doença parenquimatosa distal. As massas hilares normalmente são bem circunscritas, redondas ou ovais e podem ter um contorno lobulado ou chanfrado. O tamanho varia de 2 a 5 cm e massas irregulares com margens mal definidas são raramente vistas. Carcinóides atípicos são maiores, porém os multifocais são raramente observados. Calcificações são comuns especialmente em carcinóides centrais e dificilmente identificadas nas radiografias convencionais, mas facilmente vistas na TC, podendo calcificar difusamente e simular broncolitíase. O diagnóstico de carcinóide brônquico deve ser sugerido quando houver uma massa hilar ou peri-hilar que estreita, deforma e obstrui a via aérea adjacente e contém calcificações puntiformes ou difusas, sendo a cavitação rara. Os carcinóides são tipicamente bem vascularizados e na TC com contraste podem ter uma contrastação homogênea e simular varizes pulmonares ou aneurisma da artéria pulmonar. Os carcinóides atípicos podem ter contornos irregulares e uma contrastação menos uniforme. Tanto os carcinóides típicos como atípicos podem estar associados com linfonodomegalias mediastinais, hiperplasias decorrentes de pneumonia de repetição ou metástases. Nódulos endobrônquicos são freqüentemente demonstrados nos tumores carcinóides, muitas vezes se estendendo ao parênquima adjacente e a TC consegue visualizar a localização anatômica de ambos os componentes intra e extra-luminal. Figura 6 Peça cirúrgica demonstrando o aspecto macroscópico. Carcinoma neuroendócrino moderadamente diferenciado em parênquima pulmonar intercalado com grandes áreas de pneumonia em organização e hemorragia alveolar, interessando todo o lobo direito. A atelectasia é um dos achados mais comuns que demonstra a obstrução endobrônquica, podendo também ter pneumonia pós-obstrutiva associado. A TC contrastada permite diferenciar um carcinóide centralmente contrastado de atelectasia adjacente ou consolidação. Infecções de repetição distal ao tumor podem resultar em bronquiectasia ou abscesso pulmonar. Nódulos periféricos aparecem como manifestação solitária em aproximadamente 20% dos casos. Normalmente são lesões redondas ou ovais com bordas lisas ou lobuladas. Os carcinóides típicos quando encontrados na periferia tem um crescimento lento e devem ser considerados no diagnóstico diferencial de nódulos pulmonares solitários. Impactação mucóide é outro achado que pode ser visto em radiografias e na TC, quando múltiplos brônquios contíguos estão preenchidos e dilatados pode ser visto o sinal “dos dedos de luva” ou do V e Y. Referências Bibliográficas 1. Christenson M.L.R.; Abbott, G.F.; Kirejczyk, W.M.; Galvin, J.R., Travis, W.D.; Thoracic carcinoids: radiologic-pathologic correlation. RadioGraphics 1999; 19:707-736. 2. Mi-Young J.; Gasser, B.; Gangi, A.; Charneau, D.; Ducroq, X.; Kessler, R.; Quoix, E.; Roy. C.; Bronchial Carcinoid Tumors of the Thorax: Spectrum of Radiologic Findings. RadioGraphics 2002; 22:351-365. 3. Martini, N.; Zaman, M.B.; Bain, M.S.; Treatment and prognosis in bronchial carcinoids involving regional lymph nodes. J Thor Cardiovasc Sur, 1994; 107:1-7. 4. Fink, G.; Krelbaum, T.; Yellin, A.; Bendayan, D.; Saute, M.; Glazer, M.; Kramer M.R.; Pulmonary Carcinoid: Presentation, diagnosis, and outcome in 142 Cases in Israel and Review of 640 cases from the literature. Chest 2001; 119:1647-1651. 4 Caderno Dois São Paulo, dezembro de 2003 Carcinoma Renal de Células Papilíferas Dr. Antonio Lopes Rocha Historia clínica M.L.G., 20 anos, branco, masculino, natural e procedente de São Paulo-SP. HPMA: Hematúria de início súbito acompanhada por dor no flanco esquerdo de fraca intensidade que regredia após o uso de analgésicos comuns. Negava disúria, polaciúria ou febre. Não havia história de traumas pregressos. Negava antecedentes de litíase renal ou de infecções do trato urinário. Ao exame físico, abdome normotenso, indolor à palpação, sem visceromegalias, giordano negativo. Dados Laboratoriais: Urina I com mais de 300 hemáceas e 25 leucócitos degenerados por campo; cristais ausentes. Uréia, creatinina e hemograma dentro dos limites da normalidade. Diagnóstico Carcinoma Renal de Células Papilíferas Discussão O carcinoma renal de células papilíferas é uma variante histológica incomum do carcinoma de células renais, sendo o adenocarcinoma o tipo mais comum. Acomete mais homens, predominando entre a quinta e a sexta décadas de vida. Possui aspectos imunohistoquímicos, microscópicos e genéticos característicos. Enquanto os carcinomas renais não-papilíferos, representados pelos tumores de células claras e de células granulosas, se caracterizam geneticamente por deleções do cromossomo 3p, os papilíferos cursam com trissomias do sétimo e décimo sétimo pares. A determinação precisa do subtipo histológico dos tumores renais influencia no prognóstico de cada doente. Via de regra, os carcinomas renais de células papilíferas devem ser constituídos histologicamente por ao menos 50% de componente papilar verdadeiro. Podem ser subdivididos em tipos 1 e 2 de acordo com sua cito-estrutura e classificados em alto ou baixo graus de malignidade, mas isto pouco influi nas taxas de sobrevida dos doentes. São multifocais em até 30% dos casos e por vezes estão associados à tumores coexistentes geneticamente distintos. Os carcinomas renais mantêm-se clinicamente ocultos durante a maior parte da sua evolução, sendo encontrados incidentalmente na maioria dos casos. Hematúria, dor, febre, hipertensão, proteinúria, massa abdominal e perda de peso são os principais sinais/sintomas desta patologia. A tríade clássica de hematúria, dor e massa abdominal palpável manifesta-se em apenas 19% dos casos, quando sinaliza doença avançada. No momento do diagnósti- co, os carcinomas papilíferos são pseudocapsulados e estão confinados ao sítio primário. O screening tradicional se inicia pela urografia excretora (UGE), passando a seguir para ultrasonografia (US), tomografia computadorizada (TC) e ressonância magnética (RM). A UGE tem sensibilidade muito menor que a TC e a RM no diagnóstico das massas renais. A TC é fundamental para o estadiamento do carcinoma renal, sendo que este diagnóstico baseia-se no reconhecimento da alteração do contorno renal, do parênquima, do sistema coletor e da gordura do seio renal, além das características próprias da massa. As indicações de TC para a investigação de massas renais incluem: UGE com suspeita de massa renal; US com suspeita de massa renal, excluindo cisto benigno; achados normais a UGE / US em pacientes com sinais e sintomas suspeitos; metástases de neoplasias primárias desconhecidas; síndromes paraneoplásicas; síndromes com alta incidência de neoplasias renais (doença de Von Hippel–Lindau, doença cística adquirida, etc); tratamento anterior de carcinoma de células renais e estadiamento. O aspecto tomográfico mais característico do carcinoma renal de células papilíferas é o discreto realce pelo meio de contraste iodado, inferindo hipovascularização, o qual é captado de forma homogênea. Realce acentuado e captação heterogênea são características que excluem a possibilidade diagnóstica de carcinoma renal papilífero. Apresentam-se a US, hipoecogênicos em relação ao parênquima renal preservado, o que se explica pela presença de áreas centrais de necrose cística. Até mesmo os tumores papilíferos de curso favorável podem possuir necrose maciça. Hipovascularização ou até mesmo avascularização são achados radiológicos típicos dos estudos angiográficos destes tumores. Os critérios de diagnóstico por imagem das massas renais são: massa que causa saliência no contorno renal; as características de valor de atenuação ou de intensidade de sinal da massa diferem do parênquima renal normal; realce que difere do parênquima renal normal (menor do que o tecido renal preservado); margem indistinta entre a massa e o parênquima renal é muito sugestiva de malignidade (entretanto, tal padrão é comum apenas entre os carcinomas maiores); quando presente, a parede de um carcinoma de células renais é perceptivelmente espessa e geralmente irregular; sinais secundários, quando presentes, como extensão venosa, metástases, linfadenopatia ou invasão de órgãos adjacentes, são indicativos de malignidade. O estadiamento clínico-radiológico é considerado o principal fator prognóstico para os portadores da doença. As taxas de sobrevida atingem até 78% cinco anos após o tratamento cirúrgico Figura 1 - Ultra-som: Nódulo sólido, hipoecogênico, heterogêneo no terço médio do rim esquerdo. Figuras 2 e 3 Nódulo sólido, pseudoencapsulado com realce discreto e homogêneo pelo meio de contraste. Figuras 4 e 5 Lesão hipovascular no terço médio do rim esquerdo. Figura 6 - Aspecto macroscópico de um corte longitudinal renal: note os focos centrais de necrose cística. (nefrectomia parcial ou total) para aqueles com tumor restrito ao rim. Pacientes com estadio M1 (metástase à distância) apresentam sobrevida inferior a 12% em cinco anos. Estadiamento do Carcinoma Renal pela TC (Classificação de Robson): • Estadio I: confinado pela cápsula renal. • Estadio II: confinado pela fáscia de Gerota. • Estadio III a: acomete a veia renal e/ou a veia cava inferior. • Estadio III b: linfonodos regionais. • Estadio IV: órgãos adjacentes ou metástases à distância. Observação: como as adrenais localizam-se no espaço perirrenal, o acometimento da glândula ipsilateral ainda é estadio II. Correlação entre a classificação de Robson e o estadiamento TNM: Robson Extensão da doença TNM I Tumor limitado ao rim (pequeno, intra-renal)Tumor limitado ao rim (grande) II Disseminação do tumor para a gordura perirrenal, mas na fáscia de Gerota III a Disseminação do tumor para a veia renal ou veia cava III b Disseminação do tumor para os linfonodos locais III c Disseminação do tumor para os vasos e linfonodos locais IV a Disseminação do tumor para os órgãos adjacentes IV b Metástases à distância T1T2 T3a T3b N1-N3 T3b N1-N3 T4 M1a-dN4
Documentos relacionados
Carcinoma Renal de Células Papilíferas
 parcial. A degeneração cística subtotal ou total é
bastante incomum. Postula-se que a degeneração cística ocorre por crescimento excessivo
em relação ao suporte vascular. Os componentes císticos re...
parcial. A degeneração cística subtotal ou total é
bastante incomum. Postula-se que a degeneração cística ocorre por crescimento excessivo
em relação ao suporte vascular. Os componentes císticos re...
Pseudomixoma Peritoneal
 mesmo da descoberta da neoplasia primária.
Quando há sintomas, estes incluem dor
abdominal, distensão, massas palpáveis,
náuseas, vômitos e fadiga.
As radiografias podem mostrar deslocamento
centra...
mesmo da descoberta da neoplasia primária.
Quando há sintomas, estes incluem dor
abdominal, distensão, massas palpáveis,
náuseas, vômitos e fadiga.
As radiografias podem mostrar deslocamento
centra...