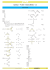Untitled - Professor Ávila
Transcrição
Untitled - Professor Ávila
VESTIBULAR ULBRA VERÃO 2014 Instrução: Leia o texto abaixo sobre os ganhadores do Prêmio Nobel de Química de 2013. Os químicos moleculares Martin Karplus (austríaco), Michel Levitt (sul-africano) e Arieh Warshe (israelense) ganharam o Prêmio Nobel de Química em 2013, anunciou nesta quarta-feira (9) a instituição em Estocolmo, na Suécia. Eles foram laureados por elaborarem simulações de computador que são utilizadas para entender e prever processos químicos complexos como fotossíntese e combustão, declarou o júri. "A força dos métodos que Martin Karplus, Michel Levitt e Atieh Warshel desenvolveram é que eles são universais", declarou o painel Nobel. "Eles podem otimizar células solares, catalisadores em veículos automotores ou mesmo drogas, para citar apenas alguns exemplos", completou. 42. O texto cita que uma das aplicações resultantes da pesquisa dos químicos laureados com o Prêmio Nobel em 2013 foi a otimização dos catalisadores usados em veículos automotivos. A função de um catalisador é: (A) tornar possível uma reação. (B) diminuir a energia de ativação da reação. (C) impedir a formação do produto. (D) fortalecer as ligações nos reagentes. (E) diminuir a energia cinética da reação. 43. Leia o texto abaixo sobre o relatório do IPCC e marque a alternativa que apresenta uma possível consequência do assunto discutido no referido relatório. As temperaturas têm aumentado mais lentamente nos últimos 15 anos apesar do aumento nas emissões de gases do efeito estufa, mas há uma retomada da tendência de aquecimento que provavelmente vai causar ainda mais ondas de calor, secas, enchentes e elevamento do nível do mar. A temperatura do planeta subirá quase 5 graus Celsius (°C) até 2100, afirma a previsão mais pessimista do novo relatório do Painel Intergovernamental sobre Mudanças Climáticas (IPCC, na sigla em inglês), divulgado nesta sexta-feira (27). O painel reunido em Estocolmo, na Suécia, analisou quatro cenários possíveis sobre as mudanças climáticas até 2100, mas sem definir a probabilidade de cada um deles tornarem-se realidade. No caso mais otimista, a elevação da temperatura varia entre 0,3°C e 1,7°C no período 2081-2100 frente à média observada entre 1986 e 2005. Já na hipótese mais pessimista, o planeta ficará entre 2,6°C e 4,8°C mais quente na mesma comparação. Essa variação do aquecimento depende de quanto o planeta vai emitir, nas próximas décadas, os gases que provocam o efeito estufa na atmosfera. (A) O aumento na velocidade de derretimento das geleiras no Ártico e na Antártica. (B) A diminuição do nível do mar. (C) O aumento de grandes erupções de vulcões. (D) Maior frequência de tremores de terras em lugares próximos ao litoral. (E) Diminuição da acidez das águas das chuvas. Instrução: Leia o texto abaixo, sobre o acidente ocorrido em São Francisco do Sul, no mês de outubro de 2013. A pequena ilha de São Francisco do Sul carrega, além das belezas a marca de ser a cidade mais antiga de Santa Catarina, ocupada em 1553 por espanhóis tornando-se vila em 1640, já sob domínio dos portugueses. É quase um pequeno paraíso estendido na margem do mar, com casarios portugueses e praias de absurda beleza. Tem o quinto maior porto do país e conta com grandes armazéns de carga. E foi justamente aí que se deu o acidente que coloca a cidade na triste estatística dos grandes desastres ambientais e humanos, Desde o dia 24 de setembro, alguma coisa ainda não sabida deu início a um incêndio de grandiosas proporções, envolvendo produtos químicos em um dos armazéns da Flobal Logística na região do porto. O desastre provocou uma gigantesca nuvem de poeira e gás tóxico, cujo destino fatalmente será o coração da terra e o corpo das gentes. O armazém da Global estava fabricando toneladas de fertilizantes, cujo principal componente é o nitrato de amônio. Atingido pelo fogo, ele libera óxido nitroso, um gás que provoca contrações involuntárias nos músculos da face, por isso conhecido como gás do riso. Isso, por si só, já é um problema, mas ainda não se sabe se outros produtos químicos estão associados ao caso. Já nos primeiros dias de nuvem de poeira ou gás a produção começou a sentir as consequências. A pior delas atinge as vias respiratórias. 44. Considerando que a decomposição do nitrato de amônio produz óxido nitroso (N2O) e água e supondo um rendimento próximo de 100%, qual seria a massa de N2O obtida a partir de 1 tonelada de nitrato de amônio? (A) 200 kg (B) 360 Kg (C) 550 Kg (D) 770 Kg (E) 810 Kg Instrução: O texto abaixo trata dos cem anos da formulação do modelo atômico de Bohr. Há um século, o dinamarquês Niels Bohr (1885-1962) formulava o modelo teórico que explicou a estabilidade do átimo e abriria a porta para uma nova concepção da realidade a partir da física quântica. Interlocutor de Einstein e de outros grandes cientistas do século 20, foi também um importante filósofo da ciência. Em 19 de junho de 1913, uma carta partiu de Manchester, na Inglaterra, para a Dinamarca. Nela havia a passagem: "Talvez eu tenha feito uma pequena descoberta sobre a estrutura dos átomos. Não conte para ninguém". De pequena, a descoberta nada tinha: ela marcava o início da conquista do interior do átomo pela teoria quântica. 45. A luz amarela que aparece quando um pouco de sal de cozinha cai na chama de um fogão pode ser explicada pelo modelo proposto por Bohr há cem anos, como resultado: (A) da quebra do núcleo atômico. (B) da ruptura das ligações químicas. (C) da colisão dos elétrons com núcleos atômicos. (D) da transição dos elétrons entre diferentes níveis de energia. (E) da fusão dos núcleos atômicos. 46. A seguir está representada a fórmula estrutura do gás sarin, conforme reportagem ONU comprova uso de gás sarin em ataque da Síria. A fórmula molecular do gás sarin é: (A) C4H10FO2P (B) C3H9FO2P (C) C3H9FO2P (D) C10H12FO2P (E) C7H9FO2P 47. Professor e alunos do curso de Química da ULBRA publicaram artigo sobre obtenção de biodiesel na mais importante revista de química do Brasil (Química Nova, v 36 n.5, 2013). Os dois principais processos de síntese indicados no artigo são: A partir da análise dos dois processos indicados, pode-se afirmar que o biodiesel é uma mistura de: (A) hidrocarbonetos. (B) álcoois. (C) ésteres. (D) éteres. (E) fenóis. 48. O princípio ativo na aspirina é o ácido acetilsalicílico (HC9H7O4, massa molar = 180 g/mol), um ácido monoprótico com ka= 10-4. Qual é o pH aproximado de uma solução obtida pela dissociação de dois tabletes de aspirina extraforte, cada um contendo 450 mg de ácido acetilsalicílico, em 500 mL de água? (A) 1,0 (B) 3,0 (C) 6,0 (D) 8,0 (E) 13,0 Gabarito 42 B 43 A 44 C 45 D 46 A 47 C 48 B VESTIBULAR ULBRA VERÃO 2015 Instrução: Leia o texto a seguir e responda à questão 42. Beber água pode melhorar desempenho em provas, diz estudo Alívio da ansiedade pode ser uma das explicações Um estudo feito pelas universidades de East London e Westminster concluiu que estudantes que beberam água durante as provas tiraram notas cerca de 5% menores do que aqueles que não beberam, informou o site da BBC. Foram 447 voluntários, todos estudantes de psicologia da Inglaterra. Chris Pawson, um dos autores do estudo, acredita que o consumo de água tenha um efeito fisiológico positivo sobre o raciocínio e ajude a aliviar a ansiedade, uma das principais causas de mau desempenho em provas. (Fonte disponível em: www.uol.com.br Acesso em 11/11/2012) 42. Qual a informação incorreta sobre a água? (A) É uma substância molecular composta por hidrogênio e oxigênio. (B) É formada por moléculas que apresentam geometria angular. (C) É uma substância apolar. (D) Na forma sólida é menos densa que na forma líquida. (E) Apresenta ligações interatômicas covalentes e interações intermoleculares do tipo ligações de hidrogênio. 43. Um medicamento usado no tratamento da miastenia grave (doença crônica caracterizada por fraqueza muscular e fadiga rápida quando o músculo é exigido) apresenta guanidina. Qual a porcentagem, aproximada, em massa de nitrogênio na guanidina representada ao lado? (A) 71,2% (B) 89,4% (C) 42,1% (D) 29,8% (E) 94,9% 44. Qual o volume de ácido sulfúrico concentrado (contendo 98% em massa de H2SO4 e d=1,84g/mL) é necessário diluir para preparar 500 mL de solução aquosa 0,25 mol/L? (A) 12,3 mL (B) 6,8 mL (C) 31,3 mL (D) 18,7 mL (E) 2,5 mL 45. Qual o pH da solução resultante da mistura de 5 mL de HCl 0,1 Mol/L com 5 mL de água? Dado: log 5=0,7 (A) 1,30 (B) 1,00 (C) 0,70 (D) 0,07 (E) 1,70 Instrução: Leia o texto abaixo e responda as questões 46 e 47. Tratamento de água é um conjunto de processos físicos e químicos que são aplicados na água para que esta fique em condições adequadas para o consumo, ou seja, para que a água se torne potável. Numa estação de tratamento de água o processo ocorre em etapas: 1. Pré coloração – Primeiro o cloro é adicionado assim que a água chega a estação. Isto facilita a retirada de matéria orgânica e metais. 2. Pré-alcalinização – Depois do cloro, a água recebe cal ou soda, que servem para ajustar o *pH aos valores exigidos nas fases seguintes do tratamento. *Fator pH – O índice pH refere-se à água ser um ácido, uma base, ou nenhum deles (neutra). Um pH de 7 é neutro; um pH abaixo de 7 é ácido e um pH a cima de 7 é básico ou alcalino. Para consumo humano, recomenda-se um pH entre 6,0 e 9,5. 3. Coagulação – Nesta fase, é adicionado sulfato de alumínio, cloreto férrico ou outro coagulante, seguido de uma agitação violenta da água. Assim, as partículas de sujeira ficam eletricamente desestabilizadas e mais fáceis de agregar. 4. Floculação – Após a coagulação, há uma mistura lenta da água que serve para provocar a formação de flocos com as partículas. 5. ______________ - Neste processo a água passa por grandes tanques para separar os flocos de sujeira formados na etapa anterior. 6. ______________ - Logo depois, a água atravessa tanques formados por pedras, areia e carvão antracito. Eles são responsáveis por reter a sujeira que restou da fase de decantação. 7. Pós-alcalinização – Em seguida, é feita a correção final do pH da água para evitar a corrosão ou incrustação das tubulações. 8. ______________ - É feito uma última adição de cloro no líquido antes de sua saída da Estação de Tratamento. Ela garante que a água fornecida chegue isenta de bactérias e vírus até a casa do consumidor. 9. Fluoretação – O flúor também é adicionado à água. A substância ajuda a prevenir cáries. (Fonte: Site da sabesp) 46. Quais são as fórmulas das substâncias citadas no processo de coagulação? (A) AlSO4 e FeCl (B) Al2SO4 e FeCl2 (C) Al2(SO4)3 e Fe2Cl3 (D) Al3(SO4)2 e FeCl2 (E) Al2(SO4)3 e FeCl3 47. Quais são as etapas descritas nos itens 5, 6 e 8, respectivamente? (A) Filtração, decantação e desinfecção. (B) Desinfecção, filtração e decantação. (C) Decantação, filtração e desinfecção. (D) Filtração, desinfecção e decantação. (E) Decantação, desinfecção e filtração. Instrução: Observe a imagem e responda à questão 48. parte apolar 48. O desenho acima representa a estrutura de um detergente. A ação de limpeza do detergente na remoção de gorduras pode ser explicada da seguinte maneira: (A) A parte apolar (hidrofílica) interage com a gordura enquanto a parte polar (hidrófoba) interage com a água. (B) A parte apolar (hidrófoba) interage com a gordura, enquanto a parte polar (hidrofílica) interage com a água. (C) A parte polar (hidrofílica) interage com a gordura, enquanto a parte apolar (hidrófoba) interage com a água (D) A parte polar (hidrófoba) interage com a água, enquanto a parte apolar (hidrofílica) interage com a gordura. (E) A parte apolar (hidrofílica) e a parte polar (hidrófoba) interagem com a gordura. Gabarito 42 C 43 A 44 B 45 A Anotações e cálculos . 46 E 47 C 48 B
Documentos relacionados
ENS5160 - Universidade Federal de Santa Catarina
 gerais de tratamento. Sedimentação simples. Aeração. Coagulação. Mistura. Floculação.
Flotação. Decantação. Filtração rápida e lenta. Técnicas por membranas. Adsorção e troca
iônica. Desinfecção. T...
gerais de tratamento. Sedimentação simples. Aeração. Coagulação. Mistura. Floculação.
Flotação. Decantação. Filtração rápida e lenta. Técnicas por membranas. Adsorção e troca
iônica. Desinfecção. T...