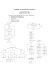Propriedades das Substâncias Puras
Transcrição
Propriedades das Substâncias Puras
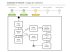
EM – 524 : aula 3 Capítulo 3 : Propriedades das Substâncias Puras 1. 2. Definições; Equilíbrio de fase; • • • • • 3. Diagrama temperatura – volume; Título de uma mistura líquido-vapor; Diagrama pressão – temperatura; Diagrama pressão – volume específico; Superfícies de pressão – volume específico – temperatura; Tabela de propriedades; Definições • • • • • • • • • • • Para uma determinada substância vamos relacionar propriedades que devem ser conhecidas para descrever o estado ou mudança de estado de um sistema; Substância pura é aquela que é uniforme e invariante em composição química em qualquer fase que se encontre (sólida, líquida ou gasosa); Substâncias simples : um único elemento químico; Substâncias puras : elementos químicos e compostos estáveis (água em qualquer fase, ar sem mudança de fase de componentes, nitrogênio, etc; Substâncias não puras : ligas metálicas, soluções líquidas e mistura de gases; Determinação das propriedades relevantes : condut. elétrica, térmica, etc. Substância compressível simples : despreza-se efeitos tensão superficial, efeitos magnéticos elétricos, gravitacionais e cinéticos, única forma de trabalho reversível é a variação de volume (P.dV); Princípio de estado : o número de propriedades independentes requerido para especificar um estado termodinâmico de um sistema é igual ao número possível de formas de trabalho mais um (observação experimental); Duas propriedades independentes : não se pode determinar uma delas através do conhecimentos da outra; Pressão de saturação : pressão na qual ocorre uma mudança de fase em uma determinada temperatura; Temperatura de saturação : temperatura na qual ocorre uma mudança de fase em uma determinada pressão (Ex: para P=101,3 kPa temos Tsat = 100oC e para P=500 kPa temos Tsat = 151,9oC); Equilíbrio de Fase • Sólido contido em um cilindro vertical (sólido = sistema); • Processo adição de calor a pressão constante (peso pistão); • Fluido do exemplo não é água! • Nos estados 2, 3 e 4 e nos estados 6, 7 e 8 as propriedades pressão e temperatura são dependentes (duas fases coexistem em equilíbrio); Diagrama Temperatura x Volume • • • • • • • • • • Os diagramas em geral são ferramentas para visualizarmos processos e também ajuda na determinação do estado do sistema; A região dentro do chapéu é designada : região de equilíbrio líquido-vapor, região de saturação, região úmida, região de duas fases; 6-10-13-c : linha de líquido saturado; 8-12-14-c : linha de vapor saturado; Região de vapor superaquecido; Região de líquido comprimido / subresfriado; Acima do ponto crítico a mudança de fase não é distinta (líquido para vapor), substância é designada de fluido; Título de uma mistura líquido-vapor = x x = Mv / M v = (1-x).vl + x.vv Reparar no Caminho das isobáricas (p=cte); Diagrama Pressão x Temperatura • • • • Inclinação da linha de fusão (substância se contrai quando solidificando); Ponto triplo : corresponde a uma pressão e temperatura na qual as três fases (sólido, líquido e vapor ) coexistem em equilíbrio; 17 – 18 : processo que vai da região de sólido para a região de vapor (gelo seco (CO2 sol) que a pressão atmosférica sublima-se a aprox. –77oC e tem pressão do ponto triplo igual a 0,52 MPa); Ponto crítico : acima do ponto crítico não existe uma mudança de fase distinta e repentina, a mudança é gradual e contínua; Diagrama Pressão – Volume Específico • Caminho das isotérmicas; Superfícies de pressão – volume específico temperatura • Regiões em que existe uma única fase, e portanto as propriedades pressão, temperatura e volume são independentes; • Regiões de duas fases (sólidolíquido, sólido-vapor e líquidovapor) onde as propriedades temperatura e pressão não são independentes; • Na linha tripla as três fases existem em equilíbrio; Diagramas P x V x T Tabela de Propriedades • Tabelas de propriedades termodinâmicas de algumas substâncias de interesse foram desenvolvidas (medidas e tabuladas) para auxiliar nos cálculos de desempenho em turbinas a vapor, reatores nucleares, geradores de vapor, ciclos de refrigeração, etc. Exercícios Resolvidos • • • • • • • Exemplo 3.1 Exemplo 3.2 Exemplo 3.3 Exemplo 3.4 Exemplo 3.5 Exemplo 3.6 Exemplo 3.7
Documentos relacionados
Capítulo 2
 Na ausência de dados relativos aos líquidos comprimidos, pode-se tratar,
por aproximação, o líquido comprimido como líquido saturado a uma dada
temperatura, ou seja, y y f(T) onde y pode ser v, u o...
Na ausência de dados relativos aos líquidos comprimidos, pode-se tratar,
por aproximação, o líquido comprimido como líquido saturado a uma dada
temperatura, ou seja, y y f(T) onde y pode ser v, u o...
Propriedades de uma Substância Pura
 • Para uma substância pura simples compressível,
normalmente duas propriedades independentes
definem o estado (p e v ou T e v ou p e T).
• Obs.: no estado de saturação, temperatura e
pressão não sã...
• Para uma substância pura simples compressível,
normalmente duas propriedades independentes
definem o estado (p e v ou T e v ou p e T).
• Obs.: no estado de saturação, temperatura e
pressão não sã...