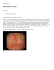
Relatório Executivo – 7ª campanha de monitoramento de
Transcrição
Relatório Executivo – 7ª campanha de monitoramento de
RELATÓRIO DO MONITORAMENTO DA FAUNA TERRESTRE DA USINA HIDRELÉTRICA SÃO DOMINGOS Cutia (Dasyprocta azarae) registrada na área de influência da UHE São Domingos em julho de 2014. 7ª Campanha – Fase pós-enchimento Setembro/2014 1 SUMÁRIO APRESENTAÇÃO ................................................................................................................. 3 1. EQUIPE TÉCNICA ......................................................................................................... 4 2. INTRODUÇÃO ............................................................................................................... 6 3. OBJETIVOS ................................................................................................................... 8 4. METODOLOGIA............................................................................................................. 9 5. 4.1 Área de estudo ....................................................................................................... 9 4.2 Procedimentos Metodológicos ............................................................................. 9 4.2.1 Herpetofauna ................................................................................................ 10 4.2.2 Avifauna ........................................................................................................ 17 4.2.3 Mastofauna.................................................................................................... 21 RESULTADOS E DISCUSSÃO .................................................................................... 27 5.1 Herpetofauna ....................................................................................................... 27 5.2 Avifauna ............................................................................................................... 36 5.3 Mastofauna........................................................................................................... 59 6. CONSIDERAÇÕES FINAIS.......................................................................................... 67 7. REFERÊNCIAS BIBLIOGRÁFICAS ............................................................................. 70 ANEXOS ............................................................................................................................. 80 2 APRESENTAÇÃO O presente relatório apresenta os resultados obtidos durante as sete campanhas do Programa de Monitoramento da Fauna Terrestre referente à fase de pós-enchimento da Usina Hidrelétrica (UHE) São Domingos, empreendimento localizado no rio Verde, na divisa das cidades de Ribas do Rio Pardo e Água Clara, Mato Grosso do Sul. O Monitoramento da Mastofauna Não Voadora, Avifauna e Herpetofauna compõe o “Programa de Monitoramento e Conservação da Fauna Silvestre”, que teve início durante a fase de pré-enchimento da UHE São Domingos. O Programa segue as diretrizes e determinações do Projeto Básico Ambiental (PBA) do empreendimento e é composto pelo monitoramento dos quatro grupos de vertebrados terrestres (Anfíbios, Répteis, Aves e Mamíferos), com periodicidade trimestral entre as campanhas de campo. Este relatório contém a descrição das atividades desenvolvidas durante as sete campanhas de campo do monitoramento pós-enchimento (para todos os grupos da fauna), que se iniciou em 2013, ano em que foram realizadas quatro campanhas nos períodos de 20 a 25 de fevereiro de 2013 (primeira campanha, estação chuvosa), 5 a 9 de maio de 2013 (segunda campanha, estação seca), 22 a 26 de julho de 2013 (terceira campanha, estação seca) e 14 a 18 de outubro (quarta campanha, estação chuvosa). As duas primeiras campanhas do segundo ano de monitoramento (2014) foram realizadas nos períodos de 20 a 24 de janeiro (quinta campanha, estação chuvosa), 07 a 11 de abril (sexta campanha, estação seca) e 21 a 25 de julho (sétima campanha, estação seca), respectivamente. O presente documento inclui as metodologias utilizadas para a coleta de dados e análise preliminar dos resultados obtidos. 3 1. EQUIPE TÉCNICA Nome do Profissional Registro no Conselho Formação Responsabilidade no projeto 072522/01-D Biólogo, Mestre e Doutorando em Ecologia e Conservação PPGEC/UFMS Responsável pelos estudos de campo e elaboração do relatório de Mastofauna Mauricio Neves Godoi _ Bacharel em Ecologia (UNESP), Mestre e Doutorando em Ecologia e Conservação (UFMS) Responsável pelos estudos de campo e elaboração do relatório de Avifauna Camila Aoki 054178/01-D Bióloga, Mestre e Doutora em Ecologia da Conservação (UFMS) Co-responsável pelo monitoramento da Avifauna Paulo Landgref Filho 047883/01-D Bacharel e Licenciado em Ciências Biológicas, Mestre em Ecologia e Conservação Responsável pelos estudos de campo e elaboração do relatório de Herpetofauna José Antonio da Silva Menezes _ Auxiliar de campo Auxílio na campanha de campo Renato Martins de Oliveira _ Auxiliar de campo Auxílio na campanha de campo Fernando Henrique Martin Gonçalves 4 _________________________________________ Fernando Henrique Martin Gonçalves – Biólogo, CRBio N° 072522/01-D Coordenador Geral de Campo e Responsável pelo Monitoramento da Mastofauna 5 2. INTRODUÇÃO Comunidades de diversos organismos podem sofrer mudanças ao longo do tempo através da perda ou surgimento de espécies e também pela alteração na densidade ou abundancia de suas populações (Hero & Ridgway, 2006). Monitoramentos de comunidades e populações podem ser entendidos como uma importante estratégia para se averiguar e compreender as alterações às quais estão submetidas as comunidades de fauna estudadas. Hartmann et al. (2008) afirmam que o monitoramento das populações em seus habitats são essenciais para o planejamento e efetivação de ações que visam minimizar os impactos provocados por qualquer empreendimento. Neste sentido, o monitoramento biológico constitui um instrumento de grande importância no processo de mitigação de impactos ambientais provocados por empreendimentos potencialmente impactantes (Yoccoz et al. 2001). A Usina Hidrelétrica (UHE) São Domingos está instalada no rio Verde no limite dos municípios de Água Clara e Ribas do Rio Pardo, inserida nos domínios do bioma do Cerrado. Estudos atribuem ao Cerrado o título de maior, mais diversificada e mais ameaçada savana tropical do mundo (Silva & Bates, 2002). Este bioma, conhecido como um conjunto de fisionomias campestres, florestais e savânicas presentes no Brasil Central, é o segundo maior bioma brasileiro, ocupando 21% do território nacional, sendo superado em tamanho apenas pela Amazônia (Klink & Machado, 2005). A biodiversidade do Cerrado apresenta números impressionantes. No que diz respeito à herpetofauna, sabe-se que a fauna de anfíbios e répteis constituem um dos grupos menos estudados dentro do bioma, ainda assim, a riqueza de espécies conhecida para seus domínios corresponde a um número expressivo dentre os biomas brasileiros (Klink & Machado, 2005). Nas últimas décadas os anfíbios e répteis vêm ganhando destaque mundial devido a sua alta sensibilidade a alterações ambientais (Feder & Burggren, 1992) e por possuírem importante posição em cadeias alimentares (e.g. Marques et al. 1998, Machado & Bernarde, 2006), são considerados indicadores em potencial de alteração ambiental (e.g. Vitt et al. 1990, Heyer et al. 1994, Marques et al. 1998, Bastos et al. 2003, Uetanabaro et al. 2008), desta forma, informações sobre esses grupos podem fornecer respostas eficientes sobre a situação de determinado ambiente (Vitt et al. 1990, Tocher et al. 1997). 6 Quanto ao grupo das aves, a riqueza de espécies conhecida para o Cerrado chega a 856 espécies distribuídas em 64 famílias, sendo que 777 destas espécies (90,7%) são residentes e se reproduzem no domínio (Silva & Santos, 2005). Segundo Silva (1995c), a alta diversidade de aves do Cerrado se deve a forte influência e às interações bióticas históricas com domínios fitogeográficos adjacentes, especialmente a Floresta Amazônica e a Mata Atlântica. A instalação e operação de Usinas Hidrelétricas (UHE’s) têm um impacto direto sob a avifauna das regiões afetadas, seja pela perda e fragmentação de habitats naturais ribeirinhos, tanto florestais quanto abertos, seja pelo aumento na abundância de algumas espécies em áreas vizinhas não alagadas, já que estas podem receber um contingente populacional de aves vindas das áreas alagadas. Em relação à mastofauna, o Brasil é o país com a maior diversidade de mamíferos do mundo, contendo um valor aproximado de 530 espécies descritas (Costa et al., 2005). A maior parte das ordens de mamíferos existentes no Brasil é representada por espécies de médio e grande portes, normalmente com mais de 1kg de massa corporal. Entretanto, mais de 50% das espécies de mamíferos brasileiros possuem pequeno tamanho corpóreo, sendo representados especialmente por roedores, marsupiais e morcegos (Eisenberg & Redford 1999). Pequenos mamíferos não voadores, constituído por pequenos roedores e marsupiais, representam um dos mais ricos e diversificados grupos de mamíferos em quaisquer ecossistemas. Embora a fauna de pequenos mamíferos não voadores do Brasil seja relativamente bem conhecida quando comparada a outros grupos taxonômicos, poucas áreas têm sido amostradas adequadamente e listas locais de espécies normalmente encontram-se incompletas (Voss & Emmons 1996), embora tais informações sejam de suma importância para o manejo e conservação da fauna local. O estado de Mato Grosso do Sul, por exemplo, se constitui em uma lacuna de conhecimento sobre a presença e distribuição das espécies de pequenos mamíferos não voadores (Vieira & Palma 2005). Até o momento, no estado em questão, são conhecidos ao menos 34 espécies de pequenos mamíferos não voadores, sendo 12 marsupiais e 22 pequenos roedores (Alho et al. 2000; Mauro & Campos 2000; Rodrigues et al. 2002; Cáceres et al. 2007; Cáceres et al. 2008a). 7 Estudos de monitoramento da fauna, segundo Alho (2003), tem por função determinar a composição da comunidade, determinar as abundâncias relativas e identificar as possíveis alterações de densidade, constituindo assim de uma importante ferramenta para gerar subsídios para o conhecimento da dinâmica biológica natural das espécies monitoradas e para o esclarecimento das relações que se estabelecem entre os impactos advindos do empreendimento e as populações animais existentes em sua área de influência. 3. OBJETIVOS O objetivo deste estudo é dar prosseguimento ao levantamento e monitoramento da fauna silvestre presente nas áreas de influência da UHE São Domingos como parte integrante dos estudos que visam avaliar e monitorar os potenciais impactos ambientais das atividades da referida UHE sob a fauna da região. Dentre os objetivos específicos, destacam-se Inventariar a fauna de anfíbios, répteis, aves e mamíferos não voadores na área de influência do empreendimento; Complementar dados acerca da distribuição das espécies de vertebrados registradas; Registrar os dados de ocorrência, abundância, riqueza e diversidade das espécies de vertebrados diagnosticadas na área de estudo; Ressaltar o status de conservação, endemismo, habitat preferencial, estrutura trófica e interesse econômico das espécies de vertebrados registradas; Analisar os padrões de diversidade e abundância das espécies para cada ambiente amostrado, relacionando a ocorrência das mesmas com seus papéis ecológicos; Definir espécies de vertebrados bioindicadoras que permitam detectar modificações ambientais nos diferentes habitats estudados; Discutir ações de manejo que visem minimizar e mitigar os impactos ambientais das atividades da UHE sob a fauna da região, garantindo assim sua conservação no longo prazo. 8 4. METODOLOGIA 4.1 Área de estudo A UHE São Domingos está instalada no rio Verde, na divisa das cidades de Ribas do Rio Pardo e Água Clara, Mato Grosso do Sul. O rio Verde está sob influencia da Bacia do Rio Paraná e a área onde está instalada a UHE São Domingos está localizada em uma região naturalmente dominada pelo bioma Cerrado. Atualmente, em grande parte da paisagem da região predominam atividades agropecuárias e plantações de Eucalyptus, sendo que os remanescentes de vegetação natural encontram-se fragmentados e isolados. Deve-se destacar que o Cerrado é considerado um dos hotspots, que são áreas de grande relevância ecológica em função da grande diversidade de espécies, alta proporção de espécies endêmicas e alto grau de ameaça, devendo ser estudados e conservados em relação a toda a sua diversidade biológica (Myers et al., 2000). Na área de influência da UHE São Domingos podem ser observadas diversas fitofisionomias tais como mata ciliar, mata aluvial, mata estacional semidecidual, veredas, cerradão e cerrado stricto sensu, além de formações antrópicas como pastagens e açudes. As fitofisionomias estão em diversos níveis de regeneração e conservação, cuja maioria encontra-se comprometida pela ação antrópica e de animais domésticos como bovinos, eqüinos e outros. 4.2 Procedimentos Metodológicos O monitoramento da fauna silvestre da fase pós-enchimento da UHE São Domingos é realizado em campanhas de cinco dias de campo, com periodicidade trimestral, de forma a contemplar as estações seca e chuvosa. Todos os grupos da fauna alvo do monitoramento (herpetofauna, avifauna e mastofauna) tiveram suas campanhas de campo realizadas concomitantemente. O período de realização das campanhas de monitoramento pósenchimento já realizadas é apresentado no Quadro 01. 9 Quadro 01 - Período e respectiva estação sazonal das campanhas de campo já realizadas referentes ao Programa de Monitoramento e Conservação da Fauna Silvestre da UHE São Domingos (fase pósenchimento), municípios de Água Clara e Ribas do Rio Pardo, MS. Ano de Monitoramento 1º Ano 2º Ano Amostragem Período Estação 1ª campanha 20 a 25 de fevereiro de 2013 Chuvosa 2ª campanha 5 a 9 de maio de 2013 Seca 3ª campanha 22 a 26 de julho de 2013 Seca 4ª campanha 14 a 18 de outubro de 2013 Chuvosa 5ª campanha 20 a 24 de janeiro de 2014 Chuvosa 6° campanha 07 a 11 de abril de 2014 Seca 7° campanha 21 a 25 de julho de 2014 Seca Os pontos e os métodos de amostragem empregados foram os mesmos nas sete campanhas de monitoramento. A descrição detalhada dos procedimentos metodológicos é apresentada a seguir para cada grupo da fauna. Todas as atividades de captura, manipulação, coleta e transporte de animais silvestres descritas nesse documento foram licenciadas por meio da Autorização Ambiental para Captura, Coleta e Transporte de Fauna Silvestre emitida pelo Instituto de Meio Ambiente de Mato Grosso do Sul (IMASUL) N°. 002/2012 (Processo nº 23/105014/2012, válida até 24/10/2014). 4.2.1 Herpetofauna Os pontos de amostragem da herpetofauna foram escolhidos no intuito de se contemplar as principais fitofisionomias presentes na área de influência do empreendimento. Foram selecionados nove pontos, os mesmos amostrados durante a fase de pré-enchimento. De forma geral os ambientes presentes na área de influência da UHE São Domingos apresentam-se descaracterizados, sendo a maioria convertidos em pastagem, não estando conservadas as matas ciliares. A maioria dos corpos d’água amostrados é utilizada para dessedentação do gado, sendo esta a principal causa de assoreamentos, descaracterização da vegetação marginal e formação de pequenos barramentos (Fotos 1 a 9). As coordenadas 10 dos pontos amostrados no monitoramento da Herpetofauna são apresentadas no Quadro 02. Quadro 02 - Pontos de amostragem do monitoramento da herpetofauna (fase de pós-enchimento) nas áreas de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Legenda: BALT – Busca Ativa Limitava por tempo; AQ – Armadilha de queda. Ponto de amostragem Coordenadas Geográficas (UTM – 22K) DATUM - SAD 69 Altitude (m) Descrição do Ambiente Metodologias Aplicadas BALT Procura Ativa 1 0271803/ 7784476 350 Área alagada na margem direita, formando um pequeno brejo Procura Ativa 2 0271763/ 7781639 339 Mosaico de ambientes: Mata aluvial, Mata ciliar, brejo BALT 348 Área alagada na margem direita, formando um pequeno brejo BALT 377 Represa em um córrego com vegetação herbácea e arbustiva bem estratificada BALT BALT Procura Ativa 3 Procura Ativa 4 0271847/ 7784303 0273635/ 7783997 Procura Ativa 5 0271759/ 7784701 351 Represa de nascente com vegetação herbácea e arbustiva bem estratificada Procura Ativa 6 0273792/ 7781898 355 Campo úmido BALT Pitfall 01 0267786/ 7781037 371 Remanescente de Cerradão AQ Pitfall 02 0273861/ 7783765 388 Remanescente de Cerradão AQ Pitfall 03 0274162/ 7781689 380 Remanescente de Cerradão AQ 11 Foto 1 – Procura Ativa 1 Foto 2 – Procura Ativa 2 Foto 3 – Procura Ativa 3 Foto 4 – Procura Ativa 4 Foto 5 – Procura Ativa 5 Foto 6 – Procura Ativa 6 12 Foto 7 – Pitfall 01 Foto 8 – Pitfall 02 Foto 9 – Pitfall 03 Em geral os estudos da herpetofauna que visam inventariar a comunidade utilizam-se de diversos métodos de captura conjugados, devido à grande diversidade de formas, tamanho, hábitos, hábitats e horários de atividade das espécies de répteis e anfíbios (Heyer et al. 1994). Neste estudo foram conjugados três métodos de amostragens: armadilhas de interceptação e queda (Cechin & Martins, 2000), busca ativa limitada por tempo (Heyer et al. 1994) e zoofonia (Scott Jr. & Woodwarr, 1994), cada um deles apresentando maior eficiência para determinados grupos, visando assim uma melhor caracterização da comunidade herpetofaunística. Complementarmente a estas metodologias, também foram registradas espécies por encontros oportunísticos. Segue a descrição de cada método. Armadilhas de queda com cerca-guia (Pitfall traps com drift-fences, Cecchin & Martins, 2000): Em cada um dos pontos de amostragem denominados Pitfall 01, 02 e 03 (Quadro 02) foi instalado uma linha de armadilhas (Fotos 10 e 11) composta por cinco baldes 13 (capacidade de 60 litros) enterrados com a abertura ao nível do solo, arranjados em formato linear e interligados por cerca de direcionamento de lona plástica de 30m (5m entre os baldes e 5m antes do primeiro e depois do último balde) de comprimento e 80cm de altura, com a extremidade inferior enterrada no solo, cerca de 10cm, para evitar que os animais pudessem passar por baixo do anteparo (Figura 01; Fotos 10 e 11). Este método é muito utilizado para amostragem de espécies terrestres, fossoriais e semifossoriais de pequeno e médio porte, sendo importante na amostragem de lagartos e no complemento das amostragens de serpentes. No caso de anfíbios, as armadilhas de interceptação e queda possibilitam o registro de espécies que raramente são encontradas quando outros métodos empregados são utilizados (Campbell & Christman, 1982). O conjunto de armadilhas ficou acionado por intervalo de tempo de cinco dias em cada campanha de campo, sendo realizadas vistorias, para observações e registros a cada 12 horas. O esforço amostral por campanha foi de 120 horas, totalizando 840 horas para as sete campanhas (24 horas x 5 dias x 7 campanhas). Foto 10 – Armadilha de queda instalada no ponto Pitfall 02. Foto 11 – Armadilha de queda instalada no ponto Pitfall 03. Figura 01 - Disposição dos baldes e desenho esquemático da armadilha de interceptação e queda. 14 Busca ativa limitada por tempo (Heyer et al., 1994): Busca ativa ou procura visual limitada por tempo é um método bastante generalista e amplamente utilizado em levantamento para amostragem de vertebrados. Esta metodologia permite o registro de espécies que se deslocam pouco, espécies arborícolas, que raramente descem ao chão e o registro de espécies que raramente são amostradas em armadilhas de queda. No estudo da herpetofauna da UHE São Domingos a busca ativa limitada por tempo foi empregada nos pontos 1 a 6 (Quadro 02). As buscas foram realizadas durante o período diurno e noturno, através de caminhadas assistemáticas, vasculhando os ambientes onde os animais habitualmente se abrigam (em cavidades de árvores, entre frestas de rochas, sob rochas e troncos, no solo, na serapilheira, nas moitas de bromélias e ao longo de vegetação marginal dos cursos d’água). As coletas noturnas tiveram início pouco antes do ocaso e término entre 22:00h e 23:00h. A primeira metade da noite constitui o período de pico das atividades reprodutivas da maioria das espécies de anuros (Cardoso & Martins, 1987; Prado & Pombal Jr, 2005). A duração da coleta em cada ponto foi de 50 minutos a fim de padronizar o esforço amostral, além disso, eram feitos censos de carro no trajeto entre os pontos de coleta, buscando identificar eventuais espécimes observados nas estradas e suas imediações, para complementação do trabalho. Durante o dia, as áreas de amostragem eram visitadas a fim de se registrar qualquer ocorrência de répteis por encontro visual (Heyer et al., 1994). Zoofonia (Scott Jr. & Woodwarr, 1994): Este método consiste na identificação das espécies de anuros através das vocalizações emitidas pelos machos, realizadas em períodos de atividade reprodutiva. A identificação de todas as espécies foi realizada em campo. A zoofonia foi realizada nos pontos de procura ativa, sítios propícios para a reprodução, com presença de água em abundância. Este método permite o registro de espécies de anuros de tamanhos diminutos, que são dificilmente registrados por busca ativa e também permite inferir a época reprodutiva das espécies. Encontros oportunísticos (Sawaya, 2003): Esse tipo de registro de espécies é amplamente utilizado em trabalhos herpetofaunísticos, pois contribui consideravelmente com a listagem de espécies de uma dada área (Sawaya, 2003). Essa metodologia registra os espécimes vivos ou mortos que são encontrados durante a realização de outra atividade que não as outras metodologias supracitadas (por exemplo, durante o deslocamento pelas 15 estradas que ligam os pontos) e os animais encontrados por pesquisadores de outras equipes, quando a descrição pelos mesmos permite a identificação dos espécimes. Quando estes encontros eram realizados nos pontos de monitoramento, o registro era dado a este ponto. Porém quando era realizada fora dos pontos de coleta, mas dentro influência da usina registrava-se somente o dado de presença (sem localização). Os espécimes registrados através das metodologias supracitadas foram catalogados em cadernetas de campo, onde foram anotados os seguintes dados: data do registro, identificação da espécie, ponto de amostragem, descrição do habitat e microhabitat e metodologia de registro. Quando possível, os espécimes encontrados também foram fotografados. Para o auxílio na identificação taxonômica dos anfíbios foi utilizado o “Guia de Campo dos Anuros do Pantanal Sul e Planaltos de Entorno” (Uetanabaro et al. 2008) e “Amphibian Species of the World” (Frost, 2012). Para a determinação taxonômica das espécies de répteis foi utilizado “Serpentes do Pantanal” (Marques et al. 2005), o catálogo eletrônico para lagartos do cerrado de G. Colli & L. O. Oliveira (http://www.unb.br/ib/zoo/grcolli/guia/guia.html) e Giraudo (2001). A nomenclatura utilizada para a classificação das espécies segue aquela proposta por Segalla et al. (2012) e Bérnils & Costa (2012). As espécies de anfíbios e répteis foram enquadradas nas categorias de ameaça em nível nacional (MMA, 2008) e global (IUCN, 2014). Para as análises de diversidade foram utilizados os dados de composição, riqueza e abundância dos anfíbios e répteis registrados em cada ponto de coleta. Dessa maneira, foram calculados: A) Índice de Shannon-Wiener (H', logaritmo base e), estima a diversidade de variáveis categóricas em uma dada população, avaliando os aspectos da riqueza e equitabilidade, os quais dizem respeito ao número de categorias da variável em questão e as proporções de cada umas destas, respectivamente. É calculado através da seguinte fórmula: 16 Onde: pe= Abundância relativa da espécie e (pe=ne/N) ne= Número de indivíduos da espécie e N= Número total de indivíduos S= Número Total de espécies B) Índice de equitabilidade de Pielou (J), expressa a maneira pela qual o número de indivíduos está distribuído entre as diferentes espécies, isto é, indica se as diferentes espécies possuem abundâncias semelhantes ou divergentes. J=H’/lnS Onde: H’= Índice de diversidade de Shannon S= Número Total de espécies Para determinar a “suficiência amostral” foi utilizada a curva de acumulação de espécies, também designada por “curva do coletor”, para as comunidades de anfíbios e répteis. 4.2.2 Avifauna No estudo da avifauna procurou-se manter as áreas de amostragem utilizadas durante o monitoramento da fase de pré-enchimento da UHE São Domingos, dando continuidade ao monitoramento destas áreas durante a fase de operação do empreendimento. Desta forma, foram mantidas oito áreas de amostragem distribuídas em diferentes fisionomias vegetais presentes no entorno da UHE. Porém, em função de dificuldades de acesso causadas pela formação do reservatório, não foi possível acessar duas destas áreas, a área A3 e o ponto P4 (Quadro 03). Foram amostradas diferentes fisionomias vegetais naturais e antrópicas como forma de aumentar a probabilidade de encontro do maior número possível de espécies de aves presentes na região. Na área onde foi instalada a UHE ocorrem florestas ripárias na forma de matas de galeria, matas aluviais e veredas de Buriti (Mauritia flexuosa), brejos e campos úmidos adjacentes, manchas de cerradão (savana florestada), cerrado stricto sensu (savana 17 arborizada) e pastagens ativas e abandonadas em diferentes estágios de regeneração (Fotos 12 a 15). No Quadro 03 são apresentadas as coordenadas e principais fisionomias vegetais presentes nas áreas de amostragem utilizadas para o monitoramento da avifauna da UHE São Domingos. Quadro 03 - Pontos de amostragem do monitoramento da avifauna (fase de pós-enchimento) nas áreas de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Coordenadas Pontos de Geográficas (UTM) – 22K Altitude Amostragem (m) DATUM - SAD 69 Descrição do Ambiente Metodologias Aplicadas A1 22 K 0275050 / 7783550 413 Cerrado s.s., cerradão, mata aluvial e brejos Transectos A2 22 K 0273792 / 7781879 360 Cerrado s.s., mata aluvial e brejos Transectos A3 22 K 0268873 / 7786349 366 _ _ A4 22 K 0274161 / 7781705 382 Cerradão, cerrado s.s. e pastagens Transectos P1 22 K 0271908 / 7784380 362 Cerrado s.s., cerradão, mata aluvial e brejos Pontos de escuta P2 22 K 0273636 / 7784064 376 Cerrado s.s., cerradão, mata aluvial e brejos Pontos de escuta P3 22 K 0273710 / 7778352 327 Mata ciliar, cerradão, brejos e pastagens Transectos P4 22 K 0271164 / 7787019 351 _ _ Foto 12 – Ponto A1, com extensas áreas de cerradão, cerrado s.s., além de brejos e veredas. Foto 13 – Ponto A2, com brejos, matas aluviais e cerrado s.s. 18 Foto 14 – Ponto P3, com mata ciliar, cerradão e brejos. Foto 15 – Ponto A4, com pequeno fragmento de cerrado s.s. e cerradão. O esforço amostral para avifauna em cada campanha da fase pós-enchimento foi de pelo menos 24 horas, totalizando 168 horas de amostragem considerando as sete campanhas. As amostragens foram realizadas no início das manhãs, das 05:30h – 09:30h, e no fim das tardes, das 16:00h – 18:00h, já que nestes períodos a maioria das espécies de aves está ativa, o que facilita o maior número de registros. As aves foram registradas por visualização e vocalização, com auxílio de binóculos Nikon Monarch 10 x 42 mm, câmera fotográfica Canon EOS 7D com lente Canon 100-400 mm, gravador digital Olympus LS10 e microfone direcional Sennheiser ME66. A identificação das espécies foi feita com o auxílio de guias de campo (Souza, 2002; Sigrist, 2007; Van Perlo, 2009). A amostragem qualitativa e quantitativa das espécies de aves foi realizada através da aplicação de dois métodos conjugados: o censo por observação direta (transectos), empregado pelas manhãs nas áreas de amostragem A1, A2, P3 e A4, e pontos de escuta conduzidos no fim das tardes, nos pontos P1 e P2. Censo por observação direta: este método, também chamado de transecção, consiste em caminhar ao longo de áreas de amostragem pré-determinadas anotando todas as espécies observadas ou ouvidas, além do número de indivíduos registrados, evitando contar um mesmo indivíduo duas vezes (Develey, 2004; Rodrigues et al., 2005). Pontos de escuta: este método é aplicado com o observador parado em um ponto prédeterminado, quando ele então anota todas as espécies de aves observadas ou ouvidas, 19 além do número de indivíduos registrados, em um raio de 50 m em torno do ponto durante 20 minutos consecutivos (Develey et al., 2004). Nos dois métodos adotados, para as espécies que vivem em grandes bandos, como andorinhas e algumas espécies de psitacídeos, o número mínimo de indivíduos observados foi anotado. Através destes métodos também foram anotados dados de riqueza observada e abundância das espécies em cada área de amostragem, bem como para toda a área sob influência da UHE São Domingos. A ordenação taxonômica e nomenclatura científica seguem o Comitê Brasileiro de Registros Ornitológicos (CBRO, 2011). Foram apontadas as espécies de aves ameaçadas de extinção no Brasil (Silveira & Straube, 2008 in MMA, 2008) e em nível global (Birdlife International, 2009; IUCN, 2014). O reconhecimento de espécies endêmicas do Cerrado segue Silva (1995b, 1997) e de espécies endêmicas da Mata Atlântica segue Goerck (1997) e Brooks et al. (1999). Adicionalmente, foram apontadas espécies de aves características da Floresta Amazônica (Silva, 1996) e do Chaco (Straube et al., 2006b) que expandem sua distribuição geográfica até a Bacia do Alto Rio Paraná. A classificação das espécies quanto ao comportamento migratório segue o CBRO (2011) para as que realizam migrações intercontinentais. As espécies de aves foram classificadas quanto às categorias tróficas de acordo com o principal item alimentar consumido, adaptado de Karr et al. (1990) (Quadro 04) e também classificadas em três categorias quanto à sensibilidade às perturbações ambientais (Stotz et al., 1996), considerando-se como A as de alta sensibilidade, M as de média sensibilidade e B as de baixa sensibilidade. Também foram classificadas em três categorias quanto à dependência de ambientes florestados, de acordo com SILVA (1995a) (Quadro 05). 20 Quadro 04 – Categorias utilizadas para classificar as espécies de aves quanto ao hábito alimentar. Categorias de Hábito Alimentar Definição/Características Insetívora (I) Predomínio de insetos e outros artrópodes. Onívora(O) Consumem diversos tipos de alimentos (Insetos/artrópodes e/ou pequenos vertebrados e/ou frutos e/ou sementes). Frugívora (F) Predomínio de frutos. Granívora (G) Predomínio de sementes de gramíneas. Nectarívora (NT) Predomínio de néctar Carnívora (C) Predomínio de vertebrados capturados vivos na dieta Necrófagos (N) Consomem animais mortos Piscívoros (P) Alimentam-se de peixes; Malacófagos (M) Alimentam-se de moluscos. Quadro 05 – Categorias utilizadas para classificar as espécies de aves quanto à dependência florestal. Grau de Dependência Características Independente Espécies que ocupam, alimentam-se e reproduzem preferencialmente na vegetação aberta como fisionomias naturais de Cerrado (campo limpo, campo rupestre) ou áreas antropizadas como pastagens. Semi-Dependente Espécies que ocupam, alimentam-se e reproduzem tanto em ambientes abertos como em ambientes florestais. Dependente Espécies que ocupam, alimentam-se e reproduzem principalmente em ambientes florestais (matas de galeria, cerradão e matas secas). 4.2.3 Mastofauna A rede de amostragem para mastofauna não voadora foi composta ao longo da área diretamente afetada e indiretamente afetada pela UHE São Domingos, abrangendo estações de monitoramento previamente identificadas como de interesse para a fauna terrestre (Quadro 06, Fotos de 16 a 20). Também foram obtidos registros de forma oportunista no entorno destas estações em diferentes momentos de deslocamento pela área de estudo. A Área 4 foi contemplada com a metodologia de censos e procura por rastros e vestígios e os resultados foram analisados separadamente, uma vez que a área em questão foi utilizada para obtenção de dados complementares. 21 Quadro 06 - Coordenadas geográficas e fitofisionomia das estações amostrais utilizadas para o monitoramento da Mastofauna nas áreas de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Área Área 1 Área 2 Denominação dos Pontos / Metodologia utilizada Coordenadas Geográficas (UTM) – 22K DATUM - SAD 69 Ponto 01 (Cerrado s.s.) 0267786 / 7781037 Estrada entre margem esquerda do Rio Verde Live trap 1 0267786 / 7781037 Cerrado Strictu Senso Pitfall 1 0267780 / 7781037 Fragmento de Cerrado em regeneração Ponto 02 (Cerradão) 0273643 / 7783942 Estrada entre Cerradão e área alagada Live trap 2 0273643 / 7783765 Cerradão em estagio de recuperação, com áreas de pastagens próxima Pitfall 2 0273861 / 7783765 Cerradão em estagio de recuperação, com áreas de pastagens próxima Camera trap 2 0271864 / 7784349 Mata ciliar em córrego afluente ao Rio Verde Ponto 3 (Campo sujo - cerradão) 0274109 / 7781640 Áreas abertas entre cerradão, alagados e campos sujos 0273673 / 7781635 Cerrado 0274109 / 7781640 Cerradão 0274224 / 7781765 Borda de Cerradão 267022 / 7796529 Cerradão Área 3 Live trap 3 Pitfall 3 Camera trap 1 Área 4 Ponto 4 (Cerradão) Foto 16 – Área 1: Cerrado “Strictu Senso”. Descrição do Ambiente Foto 17 – Área 2: Cerradão em estágio avançado de recuperação. 22 Foto 18 – Área 3: Cerradão. Foto 19 – Cerrado “campo sujo” próximo à base da Polícia Militar Ambiental. PEQUENOS MAMÍFEROS NÃO VOADORES A amostragem de pequenos mamíferos não voadores foi realizada através do método de captura com armadilhas (Live trap) do tipo chapa de metal fechado (Sherman). Em cada campanha foram utilizadas 20 armadilhas em cada uma das três estações amostrais, pelo período de cinco dias. As armadilhas foram dispostas em duas transecções por estação de amostragem e cada transecção com cinco postos de captura equidistantes entre si aproximadamente 15 metros. Cada estação contou com duas armadilhas: uma no solo e outra no sub-bosque (altura em média de 1,5 a 2 m) (Fotos 20 e 21). As armadilhas foram iscadas com uma mistura de banana, bacon e óleo de fígado de bacalhau (emulsão Scotti®). O esforço de amostragem é calculado a partir do número de armadilhas X número de dias em que as mesmas permaneceram acionadas. Dessa maneira, em cada campanha foi empregado um esforço de 100 armadilhas-dia por estação (20 armadilhas x 5 dias). Considerando todas as estações de amostragem e somando as sete campanhas tem-se um esforço amostral de 2100 armadilhas-dia (100 armadilhas-dia x 3 estações x 7 campanhas). Para complementação do trabalho foi considerada a amostragem com armadilhas de interceptação e queda (Pitfall traps), instaladas nas estações para amostragem da herpetofauna (ver metodologia 4.2.1 Herpetofauna). Essas armadilhas permaneceram ativas pelos cinco dias consecutivos da campanha em cada estação amostral, totalizando 35 dias para as sete campanhas. 23 Foto 20 – Armadilha de metal disposta no solo. Foto 21 – Armadilha de metal no sub-bosque. Os indivíduos de pequenos mamíferos não voadores foram identificados quanto à espécie, classe etária, sexo e condição reprodutiva. Foram tomadas suas medidas biométricas padrão e massa corporal (obtida com o uso de dinamômetros - Pesola®). Cada espécime capturado foi marcado com um brinco numerado (National Band and Tag Company®). Após o anilhamento os indivíduos capturados foram soltos no próprio local de captura. A marcação realizada permite a posterior individualização dos espécimes capturados. Os dados coletados durante a captura dos exemplares foram anotados em fichas individuais e, posteriormente, informatizados em planilha de dados. MAMÍFEROS DE MÉDIO E GRANDE PORTE O monitoramento das espécies de mamíferos de médio e grande porte foi realizado através de procura ativa de registros diretos, como visualizações, vocalizações e carcaças, e indiretos, através de pegadas, tocas e fezes. Os animais avistados foram identificados e quando possível, fotografados. As carcaças, pegadas, tocas e fezes encontradas foram fotografadas e identificadas ao menor nível taxonômico possível. Os rastros e outros vestígios foram identificados segundo Lima Borges & Tomás (2004) e Mamede & Alho (2008). A classificação taxonômica adotada neste trabalho segue Reis et al. 2011. Adicionalmente, foram utilizadas duas armadilhas fotográficas (camera-traps) que são equipamentos compostos por uma câmera fotográfica digital e um sensor passivo para detecção de calor e movimento (passive motion detection), que quando acionado, dispara a 24 câmera. As armadilhas fotográficas foram instaladas em duas estações de amostragem (Quadro 06, Foto 22) e programadas para funcionamento durante 24 horas por dia, sem interrupções, durante os cinco dias de cada campanha. O esforço de amostragem para esse método foi calculado considerando o número de câmeras instaladas multiplicado pelo número de dias e horas em que estas permaneceram acionadas. Em cada estação de amostragem foi empregado um esforço de 5 cameras-dias, totalizando 10 cameras-dia por campanha e 60 cameras-dia considerando as sete campanhas. O esforço total para as sete campanhas foi de 1680 horas (2 cameras x 24 horas x 5 dias x 7 campanhas). Foto 22 – Camera trap instalada para registro de mamíferos de médio e grande porte. A abundância das espécies de mamíferos foi expressa a partir do número de indivíduos registrados nas armadilhas fotográficas ou identificados através de vestígios em uma dada estação de amostragem. Deve-se ressaltar que o esforço amostral empregado na procura de vestígios foi padronizado para todas as estações amostrais em termos de tempo de procura e área percorrida. Usou-se o índice de diversidade de Shannon para cálculo da diversidade nas áreas (diversidade local). Este índice, comumente utilizados em estudos de fauna, é determinado pela seguinte fórmula: Onde: pi = proporção de indivíduos na espécie i. 25 pi = ni/N, número de indivíduos pertencentes à espécie i em relação ao total de indivíduos registrados, fornecendo a proporção da espécie i no local. Com o objetivo de determinar o quão representativa foi a amostragem em relação à comunidade de mamíferos não voadores presente na área de estudo, foi construída a curva do coletor baseada no número cumulativo de espécies encontradas em função do esforço amostral empregado (dias de amostragem). A riqueza de espécies também foi estimada pela média do estimador Jackknife 1, calculado por meio do software EstimateS Versão 8.2 (Colwell, 2011). 26 5. RESULTADOS E DISCUSSÃO 5.1 Herpetofauna Durante a sétima campanha de monitoramento da Herpetofauna da UHE São Domingos foram registradas sete espécies, sendo seis de anfíbios e apenas uma de réptil (Quadro 07). Este resultado se deu pela ocorrência de baixas temperaturas registradas na área do empreendimento nos dias de amostragens (14°C durante a madrugada). Anfíbios e répteis são ectotérmicos (a temperatura do corpo varia de acordo com a temperatura do meio), portanto, quanto menor for a temperatura do ambiente, menores serão as atividades destes animais (busca de alimento e principalmente reprodução). Estes animais são mais facilmente encontrados no verão, período em que as temperaturas e umidade se encontram altas, aumentando assim o tempo de busca e a oferta de alimento. O grande número de espécies de anfíbios em comparação aos répteis pode ser resultado de características intrínsecas destes grupos. Anfíbios, de modo geral, são mais fáceis de serem observados, pois se encontram em grande número na época reprodutiva, momento em que os machos vocalizam (coaxam) para a atração de fêmeas para o acasalamento (Bastos et al., 2003), tornando-se mais visíveis e ocasionando a identificação, já que a vocalização é específica. Já em relação aos répteis, a grande mobilidade de lagartos e serpentes e a diversidade de substratos que utilizam para suas atividades podem ter influenciado no baixo número de registros obtidos durante as amostragens, pois são fatores que dificultam o encontro dos mesmos. Soma-se a isso o fato de não haver métodos de atração e/ou captura que sejam completamente eficientes e por não possuírem hábitos ligados diretamente à água (com exceção de quelônios e jacarés) (Strüssmann et al., 2000). Nenhuma das espécies registradas durante a sétima campanha se encontra inserida na lista das espécies ameaçadas de extinção em nível Nacional (MMA,2008) e/ou Internacional (IUCN, 2014). 27 Quadro 07 - Espécies registradas durante as sete campanhas do Monitoramento da Herpetofauna realizadas nas áreas de influência da UHE São Domingos, municípios de Água Clara e Ribas do rio Pardo, MS. Legenda: PA: Procura Ativa; Categoria de Ameaça segundo: Nacional (MMA, 2003), Mundial (IUCN, 2014 e CITES 2013): LC – Pouco preocupante, C1 – Listada no apêndice I da CITES, C2 – Listada no apêndice II da CITES, EN – Endêmico do bioma Cerrado, Hábitat: BR - Brejo, RP – Represamento, CM – Campo úmido, CD – Cerradão. Microhabitat: VA – Vegetação Arbustiva, VAB – Vegetação Arbórea, NS – Nível do Solo, NA – Nível d’água. TAXA NOME POPULAR PONTO DE AMOSTRAGEM CAMPANHA CATEGORIA DE AMEAÇA HÁBITAT MICROHÁBITAT Amphibia – Anura Família Hylidae (10) Dendropsophus elianae (Napoli & Caramaschi, 2000) Perereca PA3, PA5 1ª, 5ª LC RP, BR NA Dendropsophus minutus (Peters, 1872) Perereca PA4, PA5, PA6 4ª, 5ª, 7ª LC RP, BR NA Dendropsophus nanus (Boulenger, 1889) Perereca PA1, PA2, PA3, PA4, PA5, PA6 1ª, 4ª, 5ª, 6ª LC RP, BR NA, VA Dendropsophus rubicundulus (Reinhardt & Lütken, 1862″1861″) Perereca PA3, PA5 1ª LC RP, BR VA, NS Dendropsophus sanborni (Schmidt, 1944) Perereca PA4, PA6 1ª, 4ª, 5ª, 6ª LC RP, BR VA, NS Hypsiboas albopunctatus (Spix, 1824) Perereca PA1, PA2, PA3, PA4, PA5, PA6 1ª, 2ª, 4ª, 5ª, 6ª, 7ª LC RP, BR, CM VAB, VA Hypsiboas punctatus (Schneider, 1799) Pererecaverde PA3, PA4, PA5, PA6 1ª, 5ª LC RP, BR VAB, VA Hypsiboas raniceps Cope, 1862 Pererecaamarela PA1, PA2, PA3, PA4, PA5, PA6 1ª, 4ª, 5ª, 6ª LC RP, BR VAB, NS PA2 5ª LC BR VA Perereca PA1, PA2, PA3, PA4, PA5, PA6 1ª, 4ª, 5ª, 7ª LC RP, BR VAB, NS Rã-do-cerrado PA1, PA2, PA3, PA5 5ª LC RP, BR, CM NS, NA Phyllomedusa azurea Cope, 1862 Scinax fuscomarginatus (A. Lutz, 1925) Família Leiuperidae (5) Eupemphix nattereri Steindachner, 1863 28 NOME POPULAR PONTO DE AMOSTRAGEM CAMPANHA CATEGORIA DE AMEAÇA HÁBITAT MICROHÁBITAT Rã PA1, PA3, PA5 1ª, 4ª, 5ª, 7ª LC RP, BR NS, NA Rã-cachoro PA1, PA2, PA3, PA4, PA5, PA6, Pitfall 3 1ª, 4ª, 5ª LC RP, BR NS, NA Pseudopaludicola mystacalis (Cope, 1887) Rãzinha PA1, PA2, PA3, PA4, PA5, PA6 1ª, 4ª, 5ª LC RP, BR NS, NA Pseudopaludicola saltica (Cope, 1887) Rãzinha PA3 4ª LC BR NS Rã-manteiga PA1, PA2, PA3, PA4, PA5 1ª, 4ª, 5ª, 6ª, 7ª LC RP NS, NA Rãzinha PA3, PA4, PA5, PA6 1ª, 4ª, 5ª, 7ª LC BR NS, NA Leptodactylus fuscus (Schneider, 1799) Rã-bicuda PA1, PA2, PA3, PA4, PA5, PA6 1ª, 4ª, 5ª LC RP, BR NS, NA Leptodactylus labyrinthicus (Spix, 1824) Rã-pimenta PA3, PA4 1ª, 4ª LC BR NS, NA Leptodactylus mystacinus (Burmeister, 1861) Rã-tijolo PA3, PA4, PA6 4ª, 5ª LC BR NS, NA Leptodactylus podicipinus (Cope, 1862) Rã-gota PA1, PA2, PA3, PA5 1ª, 4ª, 5ª LC BR NS, NA Rãzinha PA2, PA4, PA5 1ª, 4ª, 5ª LC BR NS TAXA Physalaemus centralis Bokermann, 1962 Physalaemus cuvieri Fitzinger, 1826 Família Leptodactylidae (6) Leptodactylus chaquensis (Cei, 1950) Leptodactylus diptyx Boettger, 1885 Família Microhylidae (1) Elachistocleis cesarii (Miranda Ribeiro, 1920) Reptilia – Squamata Família Gymnophthalmidae (1) Micrablepharus maximiliani (Reinhardt & Luetken, 1862) Lagartinho-dorabo-azul Pitfall 2 1ª LC CD NS Lagartixaescorpião Pitfall 3 6ª EN CD NS Família Sphaerodactylidae (1) Coleodactylus brachystoma (Amaral, 1935) Família Teiidae (1) 29 TAXA Ameiva ameiva (Linnaeus, 1758) NOME POPULAR PONTO DE AMOSTRAGEM CAMPANHA CATEGORIA DE AMEAÇA HÁBITAT MICROHÁBITAT Calango Pitfall 2 5ª LC CD NS Jacaré-dopapo-amarelo PA5 2ª, 4ª, 7ª C1 RP NA Sucuri-preta PA4 2ª C2 RP NA Reptilia – Crocodylia Família Alligatoridae (1) Caiman latirostris (Daudin, 1802) Reptilia – Squamata Família Boidae (1) Eunectes murinus (Linnaeus, 1758) 30 Considerando os dados das sete campanhas, tem-se o registro de 27 espécies da herpetofauna, sendo 22 de anfíbios e cinco de répteis (Quadro 07), distribuídas em nove famílias. Hylidae foi a família que apresentou o maior número de espécies, 10 no total, o que representa 37% dos registros, seguida de Leptodactylidae com seis espécies (22,2%) e Leiuperidae com cinco espécies (18,5%). As demais famílias apresentaram apenas uma espécie (Figura 02). A maior representatividade específica destas famílias é um padrão para assembleias de anuros da região Neotropical (Duellman, 1999). Resultados semelhantes foram encontrados em trabalhos realizados nos Biomas da América do Sul, que também registraram a predominância desta família, p. ex. na Caatinga (Rodrigues, 2003), Cerrado (Strüssmann, 2000; Brandão & Peres-Júnior, 2001; Bastos et al., 2003; Uetanabaro et al., 2006; 2007; Vaz-Silva et al.; 2007), no Pantanal Mato-grossense (Strüssmann et al. 2000, Uetanabaro et al. 2008) e Chaco (Bucher, 1980; Brusquetti & Lavilla, 2006). Figura 02 – Contribuição relativa de cada família na comunidade de anfíbios e répteis registrada na área de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Hylidae desponta como a maior família de anuros brasileira com 355 espécies, seguida por Leptodactylidae com 75 e Leuperidae com 58 espécies, em um total de 20 famílias em todo Brasil (Segalla et al., 2012). A dominância dos hilídeos pode estar ligada ao fato dos 31 mesmos possuírem adaptações evolutivas, discos ou lamelas adesivas, que lhes permitem ocupar com sucesso um maior número de microhabitas disponíveis no ambiente (Cardoso et al., 1989), como por exemplo gramíneas e árvores presentes na margem dos corpos d’água encontradas na área de influência da usina. Em contrapartida, a maioria das espécies da família Leptodactylidae e Leiuperidae possui maior resistência a alterações ambientais produzidas pelo homem e os girinos parecem suportar um grau de poluição não aceitável por outras espécies de anuros (Izecksohn & Carvalho-e-Silva 2001, Maneyro et al. 2004). A quinta campanha foi a que apresentou a maior riqueza (20 espécies), seguida da primeira e quarta campanhas, ambas com 18 espécies. Já a segunda e terceira foram as que apresentaram as menores riquezas (Figura 03). As campanhas que registraram o maior número de espécies foram realizadas no período chuvoso. Este resultado é um padrão comum para a anurofauna Tropical, uma vez que em regiões com sazonalidade bem marcada (característica da área de estudo) a ocorrência da maioria das espécies é registrada na estação chuvosa (e.g. Bertoluci & Rodrigues 2002, Prado et al. 2005). Resultados semelhantes foram encontrados em outras regiões do país tais como na região Sul (e.g. Bernardes 2007, Conte & Machado 2005, Conte & RossaFeres, 2006), Sudeste (e.g. Bertoluci & Rodrigues 2002, Grandinetti & Jacobi 2005) e no Nordeste (Arzabe 1999), demonstrando que a ocorrência dos anfíbios anuros (grupo de maior número de espécies para o monitoramento) é fortemente afetada por fatores abióticos. Segundo Duellman & Trueb (1986) a influência do clima na ocorrência de comunidades de anuros de regiões tropicais é determinada principalmente pela distribuição e pelo volume de chuvas. Já Pombal (1997) afirma que não há um único fator influenciando a ocorrência das espécies, mas sim um conjunto de fatores climáticos. Já as campanhas menos ricas foram realizadas em períodos de estiagem. Durante este período a ocorrência de baixas temperaturas e baixa umidade relativa do ar pode causar o desidratação e morte de muitos indivíduos. Como adaptação, algumas espécies podem entrar em estivação enterrando-se o suficiente na lama de modo a evitar o congelamento, outras podem se arrastar para dentro de troncos em decomposição ou para debaixo de 32 folhas, sendo ambas as estratégias capazes de providenciar calor suficiente para evitar as condições adversas. No entanto esses comportamentos dificultam o registro das espécies. Figura 03 – Riqueza (número de espécies) registrada em cada uma das sete campanhas do monitoramento da herpetofauna (pós-enchimento) na área de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Reunindo os dados das sete campanhas, observa-se que as maiores riquezas foram registradas nos pontos PA3, PA5 e PA4, respectivamente. Já no ponto Pitfall 01 não foi registrada nenhuma espécie (Figura 04, Tabela 01). Os pontos com maiores abundâncias foram o PA5, com 351 indivíduos, e PA4, com 266 indivíduos (Tabela 01). O ponto PA5 se destaca em relação aos demais, pelos maiores valores de riqueza e abundância e o ponto PA3 pela alta diversidade. Estes pontos possuem em comum a diversidade de microhabitats. Todos estão inseridos em um mosaico de ambientes, tais como ambientes úmidos (brejo), formações de mata, pastagens, represamento, com presença de poáceas em sua margem (local propício a reprodução dos anuros). De acordo com Silvano & Pimenta (2003), a diversidade de microhabitats é um fator importante para determinar o número de espécies ocorrentes em um determinado ambiente. 33 Cabe ressaltar a alta equabilidade registrada nos pontos PA2 e PA6, indicando menor dominância de espécies nesses locais, o que contribuiu para os bons resultados do parâmetro de diversidade, juntamente com a riqueza de espécies. Figura 04 – Número de espécies registradas em cada ponto de amostragem considerando os dados das sete campanhas do monitoramento de anfíbios e répteis na área de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Tabela 01 - Parâmetros de diversidade calculados a partir dos dados das sete campanhas de monitoramento da herpetofauna (fase pós-enchimento) nas áreas de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Legenda: PA: Pontos de Procura ativa, PIT: Pontos de instalação de Pitfalls. Em negrito os maiores mais significativos. Parâmetros Analisados PA1 PA2 PA3 PA4 PA5 PA6 Riqueza de Espécies 11 13 19 15 19 12 0 2 3 Número de indivíduos 114 108 212 274 366 106 0 2 3 Diversidade de Shannon (H') Equabilidade (E') PIT1 PIT2 2,102 2,387 2,66 2,153 2,651 2,269 0 0,877 0,931 0,904 0,795 0 0,9 0,913 PIT3 0,693 1,099 1 1 34 A curva do coletor (Figura 05), construída com os dados coletados durante as sete campanhas do monitoramento da Herpetofauna da UHE São Domingos, voltou a se estabilizar, agora com 27 espécies. Quando a curva estabiliza, ou seja, espécies novas não são adicionadas a cada campanha, significa que a amostragem é representativa. Em todo caso, a estabilização total da curva é bastante difícil, pois muitas espécies raras costumam ser adicionadas após muitas amostragens, sobretudo em regiões tropicais. O mais comum encontrado nos estudos de curto prazo é uma curva em ascensão, mas com tendência à estabilização, o que indica que embora existam outras espécies na área, a amostra é representativa. Figura 05 – Curva do coletor construída com os dados das sete campanhas de monitoramento da herpetofauna (fase pós-enchimento) realizadas na área de influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. Durante as sete campanhas de monitoramento da herpetofauna da UHE São Domingos registrou-se apenas uma espécie endêmica para o bioma Cerrado (Colli et al., 2002): a lagartixa-escorpião (Coleodactylus brachystoma). Nenhuma das espécies registradas está ameaçada de extinção em nível Nacional (MMA, 2008) e/ou Internacional (IUCN, 2014). Cabe ressaltar que Phyllomedusa azurea, registrada na 5ª campanha, consta como Deficiente em Dados na IUCN (2014). Essa espécie de anfíbio possui distribuição no Brasil Central na região correspondente aos biomas do Pantanal e Cerrado, ocorrendo nos 35 estados de Mato Grosso, Mato Grosso do Sul, Tocantins, Goiás, Minas Gerais e São Paulo, se estendendo até o leste da Bolívia, Paraguai e norte da Argentina (Frost, 2012). Os estudos acerca da espécie ainda são escassos, destacando a publicação de Freitas e Colaboradores de 2008. Duas espécies estão inseridas nos apêndices da Convention on International Trade in Endangered Species of Wild Flora and Fauna – CITES (2012). No apêndice I está a espécie Caiman latirostris. Esta categoria inclui espécies que estão em um maior grau de perigo e cujo comércio é proibido, exceto quando a importação é para fins não comerciais, por exemplo, para a pesquisa científica. No apêndice II está a espécie Eunectes murinus. Esta categoria inclui todas as espécies que embora não estejam ameaçadas de extinção no momento, podem vir a ficar, se o comércio de tais espécies não for regulamentado. 5.2 Avifauna Nas sete campanhas realizadas até o momento nas áreas de influência da UHE São Domingos (pós-enchimento) foram obtidos 3369 registros de 195 espécies de aves, pertencentes a 25 ordens e 52 famílias. Destes valores, foram obtidos 440 registros de 124 espécies na primeira campanha, 481 registros de 102 espécies na segunda campanha, 385 registros de 95 espécies na terceira campanha, 553 registros de 130 espécies na quarta campanha, 492 registros de 112 espécies na quinta campanha, 411 registros de 101 espécies na sexta campanha e 516 registros de 97 espécies na sétima campanha. Os menores valores de abundância e riqueza de espécies obtidos na terceira campanha se explicam pelo frio intenso durante a realização deste campo, prejudicando a amostragem de aves já que várias espécies reduziram sua atividade durante este período. As famílias com maior riqueza de espécies foram Tyrannidae (27 espécies) e Thraupidae (20 espécies), e as mais abundantes Thraupidae, Tyrannidae e Psittacidae (Quadro 08). A curva de rarefação apresentou ascensão com tendência à estabilização (Figura 06). No entanto, a riqueza observada nestas sete campanhas não se aproxima da riqueza estimada pelo estimador Jacknife 1 (Tabela 02; Figura 07). Estes resultados indicam que a riqueza de espécies de aves da região é grande, o que reflete na dificuldade em se obter amostras representativas, mesmo com 7 campanhas. 36 Quadro 08 - Composição, distribuição e abundância das espécies de aves registradas durante as sete campanhas do monitoramento pós enchimento nas áreas sob influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. Legenda: RO (Registros oportunistas); AT (Abundância Total); * (Espécies ameaçadas de extinção), nível nacional e/ou global . Endemismo: CE (endêmicas do Cerrado), MA (endêmicas da Mata Atlântica); CT (Categorias Tróficas): I (insetívoro), O (onívoro), F (frugívoro), G (granívoro), NT (nectarívoro), C (carnívoro), P (piscívoro), N (necrófago), M (malacófago); SP (Sensibilidade às perturbações ambientais): B (baixa), M (média), A (alta); DAF (Dependência de ambientes florestados): 1 (independente), 2 (semidependente), 3 (dependente). NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS CT SP DF A1 ema O B 1 Crypturellus undulatus jaó F B 3 2 Crypturellus parvirostris inhambu-chororó O B 1 2 Rhynchotus rufescens perdiz O B 1 Nothura maculosa codorna-amarela O B 1 Cairina moschata pato-do-mato O M 1 Amazonetta brasiliensis ananaí O B 1 Dendrocygna viduata irerê O B 1 2 jacupemba F M 3 3 A2 P3 A4 RO 2 1 10 4 1 2 3 2 AT RHEIFORMES Rheidae Rhea americana* 13 TINAMIFORMES Tinamidae 1 7 1 1 9 1 2 3 3 ANSERIFORMES Anatidae 2 2 1 3 3 22 26 3 GALLIFORMES Cracidae Penelope superciliares 3 37 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS SP DF A1 A2 mutum-de-penacho F A 3 8 4 tuiuiú P M 1 2 2 biguá P B 1 8 8 biguatinga P M 1 1 3 Tigrisoma lineatum socó-boi P M 1 Butorides striata socozinho P B Bubulcus ibis garça-vaqueira I Ardea cocoi garça-moura Ardea alba Crax fasciolata P3 A4 RO AT CT 2 14 CICONIIFORMES Ciconiidae Jabiru mycteria SULIFORMES Phalacrocoracidae Phalacrocorax brasilianus Anhingidae Anhinga anhinga 1 1 1 2 3 1 1 1 B 1 3 145 P B 1 garça-branca-grande P B 1 2 1 3 Egretta thula garça-branca-pequena P B 1 1 1 2 Syrigma sibilatrix maria-faceira I M 1 Mesembrinibis cayennensis coró-coró I M 2 Theristicus caudatus curicaca I B 1 urubu-de-cabeça-vermelha N B 1 PELECANIFORMES Ardeidae 6 2 82 3 2 230 3 6 10 4 4 26 9 6 2 4 21 4 20 5 12 4 45 1 5 6 1 5 18 Threskiornithidae CATHARTIFORMES Cathartidae Catharters aura 38 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO CT SP DF PONTOS AMOSTRAIS A1 A2 P3 2 4 A4 RO AT Cathartes burrovianus urubu-de-cabeça-amarela N M 1 Coragyps atratus urubu-de-cabeça-preta N B 1 Sarcoramphus papa urubu-rei N M 2 águia-pescadora P M 1 Leptodon cayanensis gavião-de-cabeça-cinza C M 3 Elanus leucurus gavião-peneira C B 1 Accipiter striatus gavião-miudo C M 2 2 Ictinia plumbea sovi I M 2 1 Geranospiza caerulescens gavião-pernilongo C M 2 Heterospizias meridionalis gavião-caboclo C B 1 Urubitinga coronata* águia-cinzenta C A 1 Rupornis magnirostris gavião-carijó C B 1 6 2 5 4 17 Geranoaetus albicaudatus gavião-de-rabo-branco C M 1 1 6 2 6 15 Aramides cajanea saracura-três-potes I A 2 2 2 4 Porzana albicollis sanã-carijó I M 1 7 8 18 Laterallus melanophaius sanã-parda I B 2 2 2 Pardirallus nigricans saracura-sanã I M 2 1 1 2 1 1 7 3 1 1 ACCIPITRIFORMES Pandionidae Pandion haliaetus VN 1 1 Accipitridae 2 2 1 1 2 2 1 4 1 1 1 1 2 4 2 2 GRUIFORMES Rallidae 3 CHARADRIIFORMES Charadriidae 39 NOME CIENTÍFICO Vanellus chilensis NOME POPULAR CLASSIFICAÇÃO CT SP DF quero-quero I B 1 pernilongo-de-costas-branca I B 1 PONTOS AMOSTRAIS A1 AT A2 P3 A4 RO 8 14 5 8 35 3 3 Recurvirostridae Himantopus melanurus COLUMBIFORMES Columbidae Columbina talpacoti rolinha-caldo-de-feijão G B 1 7 3 16 7 33 Columbina squammata fogo-apagou G B 1 26 27 27 10 90 Claravis pretiosa pararu-azul F M 2 3 Patagioenas picazuro asa-branca F M 2 18 6 9 14 47 Patagioenas cayennensis pomba-galega F M 3 2 2 2 1 7 Zenaida auriculata pomba-de-bando G B 1 2 1 Leptotila verreauxi juriti-pupu F B 2 5 2 4 11 Piaya cayana alma-de-gato I B 2 2 1 3 6 Coccyzus melacoryphus papa-lagarta-acanelado I B 2 1 1 Crotophaga ani anu-preto I B 1 24 36 53 Guira guira anu-branco I B 1 6 6 34 Tapera naevia saci I B 1 Glaucidium brasilianum caburé C B 2 Athene cunicularia coruja-buraqueira I M 1 3 3 6 CUCULIFORMES Cuculidae 2 29 142 17 1 63 1 STRIGIFORMES Strigidae 1 1 2 2 1 7 8 7 15 CAPRIMULGIFORMES 40 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS A2 P3 A4 RO AT CT SP DF A1 mãe-da-lua I B 2 1 1 Chordeiles nacunda corucão I B 1 1 1 Hydropsalis albicollis bacurau I B 2 4 Hydropsalis torquata bacurau-tesoura I M 2 1 andorinhão-do-temporal I B 1 4 Phaethornis pretrei rabo-branco-acanelado NT B 2 Eupetomena macroura beija-flor-tesoura NT B 1 Antracothorax nigricollis beija-flor-de-veste-preta NT B Chrysolampis mosquitus beija-flor-vermelho NT Chlorostilbon lucidus besourinho-de-bico-vermelho Thalurania furcata Nyctibiidae Nyctibius griseus Caprimulgidae 3 7 1 APODIFORMES Apodidae Tachornis squamata 1 6 11 3 1 4 4 1 4 2 3 1 1 B 1 2 NT B 2 2 beija-flor-tesoura-verde NT M 2 Hylocharis chrysura beija-flor-dourado NT B 2 Amazilia fimbriata beija-flor-de-gargante-verde NT B 2 Trogon surrucura MA surucuá-variado O M 3 1 1 Trogon curucui surucuá-de-barriga-vermelha O M 3 1 1 Trochilidae 12 2 11 5 2 2 2 1 2 7 6 1 6 3 6 31 1 TROGONIFORMES Trogonidae CORACIIFORMES Alcedinidae 41 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS SP DF A1 A2 P3 1 2 1 5 1 1 3 Megaceryle torquata martim-pescador-grande P B 1 1 Chloroceryle americana martim-pescador-pequeno P B 2 1 Chloroceryle amazona martim-pescador-verde P B 2 udu-de-coroa-azul O M 3 ariramba-de-cauda-ruiva I B Nystalus striatipectus rapazinho-do-chaco I Nystalus chacuru joão-bobo Monasa nigrifrons 4 1 3 1 8 2 5 2 3 M 2 2 2 I M 1 3 4 chora-chuva-preto I M 3 4 Ramphastos toco tucano-toco O M 2 18 Pteroglossus castanotis araçari-castanho O A 3 Picumnus albosquamatus pica-pau-anão-escamado I B 2 Melanerpes candidus bilro I B 2 Veniliornis passerinus picapauzinho-anão I B 2 Colaptes melanochloros pica-pau-verde-barrado I B 2 Colaptes campestris pica-pau-do-campo I B 1 Dryocopus lineatus pica-pau-de-banda-branca I B Campephilus melanoleucus pica-pau-de-topete-vermelho I M A4 RO AT CT 5 Momotidae Momotus momota 2 14 GALBULIFORMES Galbulidae Galbula ruficauda 10 Bucconidae 4 6 3 16 4 PICIFORMES Ramphastidae 12 13 13 56 4 6 10 3 3 8 13 4 9 2 3 4 5 5 2 8 9 2 2 23 2 2 4 1 1 2 10 3 6 4 5 Picidae 2 8 2 28 17 10 15 42 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS RO AT CT SP DF A1 A2 P3 A4 seriema O M 1 13 8 14 10 Caracara plancus carcará O B 1 6 3 9 6 Milvago chimachima carrapateiro I B 1 5 7 5 2 Herpetotheres cachinnans acauã C B 2 2 Falco sparverius quiriquiri I B 1 1 Falco femoralis falcão-de-coleira C B 1 Ara ararauna arara-canindé F M 2 Diopsittaca nobilis maracanã-pequena F M 2 15 Psittacara leucophthalmus periquitão-maracanã F B 2 5 8 Eupsittula aurea jandaia-estrela F M 1 35 18 7 84 Brotogeris chiriri periquito-de-encontro-amarelo F M 2 10 14 2 26 Alipiopitta xanthops* CE papagaio-galego F M 1 9 59 4 4 76 Amazona aestiva papagaio-verdadeiro F M 3 20 20 12 14 66 Thamnophilus doliatus choca-barrada I B 2 6 9 6 4 25 Thamnophlius pelzeni choca-do-planalto I B 3 33 15 2 18 68 Taraba major choró-boi I B 2 2 3 CARIAMIFORMES Cariamidae Cariama cristata 45 FALCONIFORMES Falconidae 4 19 2 1 28 4 2 5 9 4 4 2 56 PSITTACIFORMES Psittacidae 11 24 16 21 6 15 13 PASSERIFORMES Thamnophilidae 1 43 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS CT SP DF A1 A2 P3 A4 4 4 Formicivora rufa papa-formiga-vermelho I B 1 2 Dysithamnus mentalis choquinha-lisa I M 3 1 Herpsilochmus longirostris CE chorozinho-de-bico-comprido I M 3 10 11 17 Sittasomus griseicapillus arapaçu-verde I M 3 3 5 3 Lepidocolaptes angustirostris arapaçu-do-cerrado I M 1 10 5 5 Dendrocolaptes platyrostris arapaçu-grande I M 3 2 1 Furnarius rufus joão-de-barro I B 1 Phacellodomus rufifrons joão-de-pau I M 2 Synnalaxis albescens ui-pí I B 1 Synnalaxis frontalis petrim I B 3 Antilophia galeata CE soldadinho O M 3 Neopelma pallescens fruxu-do-cerradão O M 3 2 Tityra cayana anambé-branco-de-rabo-preto O M 3 2 2 Pachyramphus polychopterus caneleiro-preto O B 2 3 3 Pachyramphus validus caneleiro-de-chapéu-preto O M 3 1 Leptopogon amaurocephalus cabeçudo I M 3 Tolmomyias sulphurescens bico-chato-de-orelha-preta I M 3 Todirostrum cinereum ferreirinho-relógio I B 2 Hemitriccus margaritaceiventer sebinho-olho-de-ouro I M 2 RO AT 10 1 4 42 Dendrocolaptidae 11 3 23 3 Furnariidae 2 2 2 2 1 2 4 1 2 3 7 1 1 14 2 16 1 3 Pipridae Tityridae 4 2 8 1 Rhynchocyclidae 1 1 1 4 1 1 14 10 6 1 7 6 37 44 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS RO AT CT SP DF A1 A2 P3 A4 6 6 9 4 5 2 7 4 4 Tyrannidae Camptostoma obsoletum risadinha I B 1 Elaenia flavogaster guaracava-de-barriga-amarela I B 2 Suiriri suiriri suiriri-cinzento I M 1 Myiopagis gaimardii maria-pechim I M 3 1 Myiopagis caniceps guaracava-cinzenta I M 3 3 Myiopagis viridicata guaracava-de-crista-alaranjada I M 3 1 1 Phaeomyias murina bagageiro I B 1 3 4 Legatus leucophaius bem-te-vi-pirata I B 2 1 Myiarchus swainsoni irré O B 2 Myiarchus ferox maria-cavaleira I B 2 6 5 2 Myiarchus tyrannulus maria-cavaleira-de-rabo-enferrujado I B 2 15 11 7 20 53 Casiornis rufus caneleiro I M 3 23 15 5 19 62 Pitangus sulphuratus bem-te-vi O B 1 14 13 17 7 51 Machetornis rixosa suiriri-cavaleiro I B 1 1 1 Myiodynastes maculatus bem-te-vi-rajado O B 3 2 2 Megarynchus pitangua neinei O B 2 5 7 Myiozetetes cayanensis bentevizinho-de-asa-ferrugínea I B 3 13 8 Tyrannus albogularis suiriri-de-garganta-branca I B 1 3 6 Tyrannus savana tesourinha I B 1 1 7 Empidonomus varius peitica I B 2 1 1 Myiophobus fasciatus filipe I B 1 1 1 2 5 Pyrocephalus rubinus verão I B 1 4 4 1 9 Gubernetes yetapa tesoura-do-brejo I B 1 11 18 2 36 25 1 1 4 2 1 8 1 4 1 5 4 13 3 5 4 8 3 23 4 25 9 3 9 20 2 45 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS CT SP DF A1 A2 12 5 P3 A4 RO AT Cnemotriccus fuscatus guaracavuçu I B 3 Knipolegus lophotes maria-preta-de-penacho I B 1 3 Xolmis cinereus primavera I B 1 1 1 1 3 Xolmis velatus maria-branca I M 1 1 2 1 7 1 12 Cyclarhis gujanensis pitiguari I B 2 7 8 4 4 Vireo olivaceus juruviara I B 3 gralha-do-campo O M 1 13 Progne tapera andorinha-do-campo I B 1 2 Pygochelidon cyanoleuca andorinha-pequena-de-casa I B 1 Stelgidopteryx ruficollis andorinha-serradora I B 1 Tachycineta leucorrhoa andorinha-de-sobre-branco I B 1 1 corruíra I B 1 1 balança-rabo-de-máscara I B 2 Turdus rufiventris sabiá-laranjeira O B 1 Turdus leucomelas sabiá-barranco O B 2 sabiá-do-campo I B 1 3 20 3 Vireonidae 23 2 2 Corvidae Cyanocorax cristatellus CE 10 7 19 20 2 4 53 Hirundinidae 1 11 3 23 2 24 2 3 8 47 5 6 Troglodytidae Troglodytes musculus 1 Polioptilidae Polioptila dumicola 16 6 22 Turdidae 3 7 1 11 13 10 9 7 39 3 11 15 13 Mimidae Mimus saturninus 4 46 Motacillidae 46 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS SP DF A1 caminheiro-zumbidor I B 1 1 Saltator similis trinca-ferro F B 2 6 Saltatricula atricollis CE bico-de-pimenta G M 1 2 8 Nemosia pileata saíra-de-chapéu-preto F B 3 6 2 Cypsnagra hirundinacea bandoleta F A 1 Lanio cucullatus tico-tico-rei G B 2 20 Lanio penicillatus pipira-da-taoca F M 3 1 Tangara sayaca sanhaçu-cinzento F B 2 8 7 9 4 28 Tangara palmarum sanhaçu-do-coqueiro F B 2 1 4 4 1 10 Tangara cayana saíra-amarela F M 1 8 14 2 4 28 Neothraupis fasciata* cigarra-do-campo F M 1 Dacnis cayana saí-azul F B 2 Cyanerpes cyaneus saíra-beija-flor F B 3 Hemithraupis guira saíra-de-papo-preto F B 3 19 6 Sicalis flaveola canário-da-terra-verdadeiro G M 1 4 9 Emberizoides herbicola canário-do-campo G B 1 Volatinia jacarina tiziu G B 1 Sporophila plumbea patativa G M 1 Sporophila caerulescens coleirinha G M 1 Sporophila leucoptera chorão G B 1 1 1 Sporophila angolensis curió G B 1 4 4 tico-tico-do-campo G M 1 Anthus lutescens A2 P3 A4 RO AT CT 1 Thraupidae 1 14 14 7 2 8 2 8 10 2 21 59 1 2 13 6 2 2 1 1 1 40 22 1 4 29 26 3 42 5 1 6 12 20 30 26 77 2 6 1 8 4 5 Passerellidae Ammodramus humeralis 1 9 15 10 35 47 NOME CIENTÍFICO NOME POPULAR CLASSIFICAÇÃO PONTOS AMOSTRAIS SP DF tico-tico-de-bico-amarelo G M 3 Geothlypis aequinoctialis pia-cobra I B 1 1 Basileuterus culicivorus pula-pula I B 3 8 Myiothlypis flaveolus canário-do-mato I M 3 32 8 Myiothlypis leucophrys CE pula-pula-de-sobrancelha I M 3 2 8 Icterus pyrrhopterus encontro O M 2 4 2 5 Gnorimopsar chopi pássaro-preto O B 1 9 12 15 6 4 46 Pseudoleistes guirahuro chopim-do-brejo O M 1 15 15 2 2 34 Molothrus rufoaxillaris vira-bosta-picumã O B 1 3 Sturnella superciliaris polícia-inglesa-do-sul O B 1 4 vivi F B 2 9 6 1 2 Abundância - - - 750 985 850 515 269 3369 Riqueza - - - 122 132 132 92 50 195 Diversidade H' - - - 1.87 1.81 1.89 1.78 1.32 1.99 Arremon flavirostris A1 A2 P3 A4 RO AT CT 2 2 Parulidae 4 12 1 6 2 22 5 45 10 Icteridae 11 3 2 6 Fringillidae Euphonia chlorotica 18 48 Figura 06 - Curva de rarefação representando o número cumulativo de espécies de aves amostradas x esforço amostral (em número de indivíduos registrados) para as sete campanhas de amostragem do monitoramento da avifauna (pós-enchimento) da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. Figura 07 - Riqueza estimada de espécies em função do esforço amostral (n° de áreas amostrais x n° de amostragens/por área) utilizando o estimador Jacknife 1, para as sete campanhas do monitoramento da avifauna (pós-enchimento) da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. 49 Tabela 02 - Número de campanhas de campo, riqueza observada e estimada pelo estimador Jacknife 1 para as áreas sob influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. Riqueza estimada de espécies Parâmetros Monitoramento Pré-enchimento (2010) Monitoramento Pós-enchimento (2013) N° de Campanhas 4 7 Riqueza Observada 157 195 Jacknife 1 Indisponível 230.94 Abaixo são apresentados os dados de abundância e riqueza observada de espécies em cada área amostral (Quadro 09, Figura 08). Deve-se destacar que os dados coletados em P1 e P2 foram agrupados aos dados coletados em A1, já que estas áreas são muito próximas fazendo com que os dados coletados não possam ser tratados de forma independente. Desta forma, as áreas A2 e P3 apresentaram maior abundância e riqueza de espécies, com A1 apresentando valores intermediários e A4 baixos valores de riqueza e abundância. As áreas A2 e P3 apresentam grande diversidade de habitats, com áreas de cerrado stricto sensu, matas aluviais e brejos, permitindo a ocorrência de muitas espécies típicas de florestas e áreas abertas, tanto secas quanto úmidas. A diversidade de habitats, bem como a grande extensão de áreas naturais preservadas, também explicam a grande diversidade de aves na área A1. Finalmente, a área A4 apresentou baixa diversidade de aves por se tratar de um fragmento pequeno, relativamente isolado e com baixa diversidade de habitats, sendo composto basicamente por cerradão e cerrado stricto sensu mais fechado. 50 Abundância Riqueza 1200 140 122 132 132 120 100 800 92 80 600 60 400 Riqueza Abundância 1000 40 200 20 0 0 A1/P1/P2 A2 P3 A4 Figura 08 - Abundância (n° de registros) e riqueza observada de espécies em cada área amostral, considerando as sete campanhas do monitoramento da avifauna (pós-enchimento) da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. ESPÉCIES AMEAÇADAS E ENDÊMICAS Quatro espécies registradas na área são consideradas ameaçadas ou quase ameaçadas de extinção: a ema (Rhea americana), o papagaio-galego (Alipiopsitta xanthops) e a cigarra-docampo (Neothraupis fasciata), que constam na categoria “quase ameaçados” em nível global (Birdlife International, 2009; IUCN, 2012), enquanto a águia-cinzenta (Urubitinga coronata) é considerada “ameaçada” em nível global (Birdlife International, 2009; IUCN, 2012) e “Vulnerável” no Brasil (Silveira & Straube, 2008) (Quadro 08). Estas quatro espécies são habitantes de ambientes savânicos, como campos e cerrados abertos, sendo a ema e o papagaio-galego abundantes na porção sul-mato-grossense da Bacia do Alto Rio Paraná, enquanto a cigarra-do-campo e a águia-cinzenta parecem ser regionalmente raras (Godoi et al., 2012; Godoi et al., 2013). A perda de habitats savânicos, em especial campestres, pode ser apontada como o principal fator de ameaça para estas espécies no Cerrado, aliado a coleta de ovos e filhotes, nos casos da ema e papagaio-galego, e abate por populações rurais em função da predação de animais de criação de pequeno porte, no caso da águiacinzenta. A instalação da UHE São Domingos pode ter provocado impacto sob as populações locais destas espécies, já que a formação do reservatório acarretou grande alagamento de habitats naturais na região. 51 Foram registradas seis espécies endêmicas do Cerrado (Silva, 1995b,c, 1997): papagaiogalego (A. xanthops) (Foto 23), chorozinho-de-bico-comprido (Herpsilochmus longirostris), soldadinho (Antilophia galeata), gralha-do-campo (Cyanocorax cristatellus), bico-de-pimenta (Saltatricula atricollis) e pula-pula-de-sobrancelha (Myiothlypis leucophrys). Uma espécie é considerada endêmica da Mata Atlântica (Goerck, 1997; Brooks et al., 1999): o surucuávariado (Trogon surrucura). A presença das espécies endêmicas do Cerrado aponta a prevalência deste domínio fitogeográfico na região, sendo todas estas espécies endêmicas relativamente comuns na área de estudo, assim como em outras regiões de Cerrado no Mato Grosso do Sul (Godoi et al., 2013). A presença de uma espécie endêmica da Mata Atlântica evidencia a influência deste domínio sob a biogeografia do Cerrado, em especial sob as florestas estacionais e ripárias do Brasil central. Foto 23 - Papagaio-galego (Alipiopsitta xanthops), espécie endêmica do Cerrado e quase ameaçada em escala global. Foto: Mauricio Neves Godoi. ESPÉCIES CINEGÉTICAS E XERIMBABOS Atenção especial deve ser dada à ocorrência de espécies cinegéticas (utilizadas como alimento), como o jaó (Crypturellus undulatus), inhambu-chororó (Crypturellus parvirostris), perdiz (Rhynchotus rufescens), codorna-amarela (Nothura maculosa), pato-do-mato (Cairina moschata), jacupemba (Penelope superciliares), mutum-de-penacho (Crax fasciolata), ou como animais de estimação provenientes do tráfico de animais silvestres (xerimbabos), como a arara-canindé (Ara ararauna), maracanã-pequena (Diopsittaca nobilis), papagaiogalego (A. xanthops), papagaio-verdadeiro (Amazona aestiva), tucano-toco (Ramphastos toco) (Foto 24), sabiá-laranjeira (Turdus rufiventris), canário-da-terra-verdadeiro (Sicalis 52 flaveola) (Foto 25) e curió (Sporophila angolensis) (RENCTAS, 2012). A maioria destas espécies tem sofrido uma nítida redução populacional em praticamente toda a sua área de distribuição em função de perda de habitat, mas também devido ao excesso de caça e coleta. Foto 24 – Tucano-toco (Ramphastos toco), espécie comumente capturada e vendida no tráfico de animais silvestres: Foto: Mauricio Neves Godoi. Foto 25 – Canário-da-terra (Sicalis flaveola), espécie comumente capturada e vendida no tráfico de animais silvestres: Foto: Mauricio Neves Godoi. CATEGORIAS TRÓFICAS Neste estudo foram obtidos registros de 89 espécies de aves insetívoras, 31 onívoras e 26 frugívoras. As categorias tróficas menos ricas, mas não menos importantes, são os granívoros (14 espécies), carnívoros (11 espécies), piscívoros (12 espécies), nectarívoros (oito espécies) e necrófagos (quatro espécies) (Quadro 08; Figura 09, Fotos 26, 27 e 28). O grupo das aves insetívoras normalmente é o mais rico e abundante dentre os diferentes grupos tróficos de aves do Cerrado e de ambientes florestais fragmentados e degradados (Motta Júnior, 1990; Marini, 2001). Mesmo em grandes maciços florestais, as aves insetívoras são as mais abundantes e o grupo mais rico em espécies, como na Floresta Amazônica (Terborgh et al., 1990) e na Mata Atlântica (Willis, 1979). Na área deste estudo, a alta abundância e riqueza de aves insetívoras ocorrem tanto em função da presença de espécies de áreas abertas quanto pela presença de aves insetívoras que vivem no subbosque de ambientes florestais, sendo estas muito sensíveis às perturbações ambientais, 53 tornando-se menos abundantes e diversas em fragmentos florestais e áreas degradadas Riqueza de espécies (Stouffer & Bierregaard, 1995; Canaday, 1997). 100 90 80 70 60 50 40 30 20 10 0 Figura 09 - Riqueza de espécies de aves em cada categoria trófica, UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. As aves onívoras utilizam diferentes itens alimentares, desde frutos, invertebrados e até mesmo pequenos vertebrados (Sick, 1997). Desta forma, podem utilizar diferentes tipos de ambientes para forragear, inclusive aqueles antrópicos e perturbados onde muitas outras espécies de aves tornam-se pouco abundantes (Motta-Júnior, 1990; Johns, 1991; Borges & Stouffer, 1999). As aves frugívoras normalmente são mais susceptíveis à degradação ambiental, principalmente por serem mais dependentes de ambientes bem arborizados, onde a riqueza e abundância de árvores frutíferas são maiores (Bersier & Meyer, 1994; Sick, 1997). As aves frugívoras destacam-se como importantes agentes no processo de dispersão de sementes de diversas espécies de plantas, auxiliando na regeneração dos ambientes naturais. Entretanto, vale ressaltar que as aves da família Psittacidae são frugívoras predadoras de sementes, atuando no controle populacional de muitas espécies de plantas (Sick, 1997). As aves granívoras estão representadas principalmente pelas famílias Columbidae, Thraupidae e Passerellidae. Estas aves alimentam-se principalmente de sementes e grãos, com algumas espécies podendo tornar-se pragas em campos agrícolas e pastagens (Sick, 54 1997; Marini, 2001). As aves de hábitos carnívoros (gaviões, falcões e corujas) são naturalmente raras em comparação com outros grupos de aves, já que predadores tendem a ocupar grandes territórios e serem menos abundantes que suas presas, enquanto necrófagos são normalmente abundantes, mas representados por poucas espécies (Sick, 1997). As aves piscívoras, malacófagas e nectarívoras são normalmente representadas por poucas espécies, dado o alto grau de especialização em suas dietas, aliado a natureza concentrada da distribuição dos recursos alimentares utilizados por elas. Foto 26 – Chopim-do-brejo (Pseudoleistes guirahuro), espécie onívora. Foto: Mauricio Neves Godoi. Foto 27 – Periquitão (Psittacara leucophthalmus), espécie frugívora. Foto: Mauricio Neves Godoi. Foto 28 – Pica-pau-de-banda-branca (Dryocopus lineatus), espécie insetívora. Foto: Mauricio Neves Godoi. 55 SENSIBILIDADE ÀS PERTURBAÇÕES AMBIENTAIS Até o momento foram obtidos registros de 121 espécies de baixa sensibilidade, 69 espécies de média sensibilidade e cinco espécies de alta sensibilidade às perturbações ambientais (Quadro 08; Figura 10; Fotos 29 e 30). Desta forma, a maioria das espécies de aves registradas é comum em ambientes alterados, apresentando baixa sensibilidade às perturbações ambientais. Entre estas, ocorrem muitas espécies que podem ser consideradas comuns e generalistas, habitando especialmente áreas abertas, bordas de matas e áreas perturbadas. Destaca-se a ocorrência de um grande número de espécies na região que apresentam média sensibilidade às perturbações ambientais, muitas das quais associadas a formações florestais estando sujeitas aos efeitos da perda de habitat e fragmentação florestal. Também ocorrem na região muitas espécies associadas a campos úmidos e brejos, ambientes ameaçados pela construção de hidrelétricas por serem frequentemente alagados com a formação de reservatórios. Por fim, ocorrem na área cinco espécies com alta sensibilidade às perturbações ambientais, o mutum-de-penacho (Crax fasciolata), águia-cinzenta (U. coronata), saracura-três-potes (Aramides cajanea), araçaricastanho (Pteroglossus castanotis) e bandoleta (Cypsnagra hirundinacea). Figura 10 - Riqueza de espécies de aves de baixa, média e alta sensibilidade às perturbações ambientais, UHE São Domingos, municípios de Água Clara e Ribas do rio Pardo, Mato Grosso do Sul. 56 Foto 29 – Tico-tico-de-bico-amarelo (Arremon flavirostris), espécie com média sensibilidade às perturbações ambientais: Foto: Mauricio Neves Godoi. Foto 30 – Araçari-castanho (Pteroglossus castanotis), espécie com alta sensibilidade às perturbações ambientais. Foto: Mauricio Neves Godoi. DEPENDÊNCIA DE AMBIENTES FLORESTADOS Considerando todas as espécies registradas durante as sete campanhas de monitoramento foram obtidos registros de 94 espécies independentes de ambientes florestados, 61 espécies semidependentes e 40 espécies dependentes destes ambientes (Silva, 1995a) (Quadro 08; Figura 11; Fotos 31 e 32). Segundo Silva (1995a; 1997) a maioria das espécies de aves encontrada no Cerrado ocorre em ambientes florestais, sendo ao menos semidependentes de florestas. Entre as espécies de aves independentes de florestas, ocorrem na área principalmente aquelas comumente observadas em pastagens e áreas agrícolas, e diversas espécies associadas à ambientes úmidos, como brejos. Entre as aves semidependentes de florestas encontram-se muitas espécies que utilizam tanto áreas abertas quanto às bordas de florestas e cerrados fechados. As espécies dependentes de ambientes normalmente são mais sensíveis às perturbações ambientais, pois não ocorrem com frequência fora de florestas e dificilmente atravessam longas distâncias em áreas abertas para se deslocar entre fragmentos florestais. Em função de sua dependência de habitat, se faz necessária a conservação e re-conexão das manchas remanescentes de matas estacionais, de cerradão, cerrado s.s. e veredas de buriti da região, sendo esta a única forma de evitar a extinção local destas espécies. 57 Figura 11 - Riqueza de espécies de aves independentes, semidependentes e dependentes de ambientes florestados, UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, Mato Grosso do Sul. Foto 31 – Pitiguari (Cyclarhis gujanensis), espécie semidependente de ambientes florestados. Foto: Mauricio Neves Godoi. Foto 32 – Fruxu-do-cerradão (Neopelma pallescens), espécie dependente de ambientes florestados. Foto: Mauricio Neves Godoi. 58 5.3 Mastofauna Na sétima campanha de monitoramento (fase pós-enchimento) foram obtidos 25 registros de 12 espécies de mamíferos não voadores nas áreas sob influência da UHE São Domingos, pertencentes a 10 famílias e 6 ordens, sendo todas as espécies de médio e grande porte (Quadro 09). A ordem mais rica em espécies foi Carnivora (n = 6), seguido por Pilosa (n = 2), Rodentia, Artiodactyla, Perissodactyla e Cingulata (n = 1) (Quadro 09). Dentre as doze espécies registradas nesta campanha, apenas Dasyprocta azarae não tinha sido registrada nas campanhas anteriores. Considerando as sete campanhas de monitoramento da fase pós-enchimento, foram registradas 24 espécies (140 registros) de mamíferos não voadores nas áreas sob influência da UHE São Domingos, pertencentes a 13 famílias e sete ordens, sendo três espécies de pequenos mamíferos e 21 espécies de médio e grande porte (Quadro 09). As ordens mais ricas em espécies foram Carnivora (10 espécies), Artiodactyla (4 espécies), Rodentia (3 espécies, Didelphimorphia, Cingulata e Pilosa (2 espécies), seguido por Perissodactyla (1 espécie) (Figura 12; Quadro 09). Quadro 09 - Composição, distribuição, riqueza (n° observado de espécies), abundância (n° de registros) e diversidade de mamíferos não voadores registrados nas sete campanhas do monitoramento pós-enchimento na UHE São Domingos, Água Clara e Ribas do rio Pardo, MS. Legenda: *Espécies ameaçadas de extinção segundo MMA (2008) e/ou IUCN (2014). C (Campanhas). Área 1, 2, 3 e 4 (Estações Amostrais). Métodos de amostragem: S (armadilhas tipo Sherman), V (registros visuais), P (pegadas), C (carcaças), F (fezes), T (tocas), VO (vocalização), PI (armadilhas de interceptação e queda), CT (câmera traps). TÁXON NOME POPULAR C ÁREA 1 ÁREA 2 2 2 ÁREA 3 ÁREA 4 MÉTODOS DIDELPHIMORPHIA Didelphidae Gracilinanus agilis cuíca 1,2,3 Micoureus constantiae catita 3 PI,Y 1 Y CINGULATA Dasypodidae Euphractus sexcinctus tatu-peba Priodontes maximus* tatu-canastra 1,2,7 4 2 1 2 1 1 3 P, T, C,V CT, V CARNIVORA Felidae 59 TÁXON NOME POPULAR Leopardus pardalis * jaguatirica Leopardus tigrinus* gato-domatopequeno Puma concolor * onça-parda C ÁREA 1 ÁREA 2 1,5 1 1 1 ÁREA 3 ÁREA 4 MÉTODOS P 1 P 6,7 1 1 P 5 6 7 6 P, V, CT 2 5 1 P, V Canidae Cerdocyon thous lobinho 1,2,3, 4,5,6, 7 Chrysocyon brachyurus * logo-guará 1,2,4, 5,6,7 Lycalopex vetulus raposinhado-campo 6,7 Procyon cancrivorus mão-pelada 2,3,5, 7 Nasua nasua quati 3,4 Lontra longicaudis lontra 3 2 V Eira barbara irara 5,7 2 V anta 1,2,3, 4,5,6, 7 5 6 7 6 P,V Mazama gouazoubira veadocatingueiro 1,2,3, 4,5,6, 7 1 5 4 P Mazama americana veadomateiro 2 P 2 P 3 3 P 2 1 P Procyonidae Mustelidae PERISSODACTYLA Tapiridae Tapirus terrestris * ARTIODACTYLA Cervidae 1,4 Tayassuidae Tayassu pecari queixada Tayassu tajacu cateto 2,3,4, 5,6,7 1 4 5 1 P capivara 1,2,3, 4,5 1 3 1 2 F, P,V,CT 4 1 1 1 P RODENTIA Caviidae Hydrochoerus hydrochaeris Cricetidae Oligoryzomys fornesi camundongo -do-mato Y Dasyproctidae 60 TÁXON Dasyprocta azarae NOME POPULAR cutia C ÁREA 1 7 ÁREA 2 ÁREA 3 ÁREA 4 1 MÉTODOS V PILOSA Myrmecophagidae Myrmecophaga tridactyla* tamanduábandeira 1,2,4, 5,6,7 1 3 5 Tamandua tetradactyla tamanduámirim 5,6,7 2 3 1 1 V, P,CT P Riqueza - - 12 17 16 9 - Abundancia - - 23 45 48 24 - Equitabilidade - - 0,9 0,9 0,9 0,8 - Diversidade de espécies H' - - 2,2 2,6 3 1,9 - Figura 12 - Riqueza de espécies por ordens de mamíferos não voadores registrados nas sete campanhas de monitoramento pós-enchimento nas áreas sob influência da UHE São Domingos, municípios de Água Clara e Ribas do rio Pardo, MS. As 24 espécies amostradas nas áreas sob influência da UHE São Domingos representam 27,8% da riqueza de mamíferos não voadores listada para todo o Mato Grosso do Sul. As 21 espécies de médios e grandes mamíferos aqui registradas representam 47,6% da riqueza deste grupo conhecida no Estado, enquanto que as três espécies de pequenos mamíferos registradas nas campanhas constitui cerca de 4,8% da riqueza de marsupiais e pequenos roedores de Mato Grosso do Sul (Cáceres et al., 2008b). 61 A curva cumulativa de espécies referente às sete campanhas do ciclo de monitoramento pós-enchimento apresenta ascensão, com leve tendência a estabilização (Figura 13), porém a riqueza estimada pelo Jackknife 1 ficou acima da riqueza observada (Jack 1 = 33,5 ± 1,8). Esse resultado demonstra que com o aumento do esforço amostral outras espécies de mamíferos podem ser adicionadas à lista local. Figura 13 – Curva do coletor: número cumulativo de espécies x esforço amostral em dias de campo referente às sete campanhas de monitoramento (pós-enchimento) de mamíferos não voadores nas áreas sob influência da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo, MS. As pegadas, visualização direta e outros vestígios contribuíram para o registro de 21 espécies (87,5%), já as armadilhas live trap contribuíram com a captura de apenas três espécies de pequenos mamíferos (12,5%). As armadilhas fotográficas registraram cinco espécies (Cerdocyon thous, Hydrochoerus hydrochaeris, Myrmecophaga tridactyla, Tapirus terrestris e Priodontes maximus), que também foram registradas através das buscas ativas (Quadro 09; Fotos 33 a 36). 62 Foto 33 – Pegada de onça-parda (Puma concolor) registrada durante busca-ativa. Foto 34 – Pegada de tamanduá-mirim (Tamandua tetradactyla). Foto 35 – Pegada de mão-pelada (Procyon cancrivorus). Foto 36 – Cutia (Dasyprocta azarae) registrada Durante busca-ativa. Dentre as espécies registradas, sete encontram-se ameaçadas de extinção segundo MMA (2008) e IUCN (2014): a “jaguatirica” (Leopardus pardalis), o “gato-do-mato-pequeno” (Leopardus tigrinus), o “tamanduá-bandeira” (Myrmecophaga tridactyla), a “anta” (Tapirus terrestris), o “lobo-guará” (Chrysocyon brachyurus), o tatu-canastra (Priodontes maximus) e a onça-parda (Puma concolor) (Quadro 09). O tamanduá-bandeira (Myrmecophaga tridactyla) é listado como "vulnerável" pela IUCN (2014) e MMA (2008) e, apesar de ser encontrado em inúmeras unidades de conservação, foi extinto em algumas partes de sua distribuição geográfica. As principais ameaças à sobrevivência da espécie são a caça, destruição de hábitat e os atropelamentos. A anta (Tapirus terrestris) é considerada vulnerável pela lista de espécies ameaçadas da IUCN (2014) e não consta na lista nacional, porém, sua população está declinando ao 63 longo de sua área de distribuição geográfica. Não existem dados sobre as populações dessa espécie, entretanto, como a destruição de seu habitat ainda continua, elas estão em declínio, mas é notável que em algumas regiões ela ainda possa ser comum, principalmente em matas próximas a rios e lagos (Naveda et al., 2008). A caça, particularmente em pequenos fragmentos de floresta, é capaz de extinguir a espécie localmente, visto que a mesma possui uma baixa taxa de reprodução. A conservação de florestas úmidas, a inibição da caça e ações mitigadoras para diminuir os atropelamentos desse animal em rodovias que passam perto de áreas florestadas, são medidas para se evitar a extinção dessa espécie. O logo-guará (Chrysocyon brachyurus) é considerado raro para a porção sul do estado do Mato Grosso do Sul (Cáceres et al., 2008b) e corre risco de extinção na natureza em função do declínio populacional e da extrema fragmentação da área de ocupação (Rodden, 2008). No Brasil, de acordo com o ICMBio, o lobo-guará é considerado espécie ameaçada de extinção, na categoria vulnerável, sendo ainda objeto de um plano de ação nacional cujo objetivo é a sua conservação. As principais ameaças ao lobo-guará vêm da conversão de terras para agricultura, do fato de ser susceptível a doenças de cães domésticos que competem com eles por alimento, e de acidentes, como atropelamentos em estradas (Cheida et al., 2011). A jaguatirica (Leopardus pardalis) sofre com a perda e fragmentação de habitat e consequente diminuição da abundância de presas, o que afeta diretamente as suas populações, já que a redução de alimento disponível diminui a densidade das populações existentes. Portanto, a principal ameaça a esta espécie é o desmatamento e a consequente fragmentação das áreas florestadas, assim como a destruição/alteração da cobertura original. Medidas para a conservação das populações devem envolver a proteção de habitats, procurando manter sempre a conectividade entre as áreas preservadas. O monitoramento das populações naturais também deveria ser uma prioridade, assim como a recuperação de habitats, já que esse felino ocorre nos biomas mais seriamente impactados do país (MMA, 2008). As maiores ameaças à sobrevivência do gato-do-mato-pequeno (Leopardus tigrinus) são a perda, a fragmentação e a conversão dos habitats. A captura de exemplares para animal de criação, tanto em escala local quanto para o tráfico, também constitui ameaça a este pequeno felino. Medidas conservacionistas devem incluir a proteção e fiscalização tanto das Unidades de Conservação quanto dos ecossistemas naturais. Como os conhecimentos 64 acerca da sua biologia/ecologia são extremamente limitados, pesquisas científicas nessa área tornam-se essenciais para melhor conhecer a espécie e, dessa forma, traçar estratégias de ação mais eficazes. O monitoramento das populações naturais também é importante (MMA, 2008). O tatu-canastra (Priodontes maximus), também conhecido como tatuaçu, é uma espécie de tatu de grandes dimensões, encontrado na maior parte da América do Sul. Chegam a medir mais de 1 metro de comprimento. Têm o corpo coberto por poucos pelos e patas anteriores dotadas de garras enormes, que auxiliam na escavação de buracos. Estão vulneráveis à extinção devido à caça para obtenção de carne e pelo desmatamento do seu habitat. Hoje é raríssimo nas diversas regiões brasileiras onde ocorria. A caça, bem como as alterações de seus habitats, com consequente redução da disponibilidade de presas são as principais ameaças a sobrevivência desta espécie (Medri et al., 2011). Segundo Nowak (1999), esta espécie declinou 50% na última década devido à caça e desmatamento do seu habitat. P. maximus está listado no Apêndice I da CITES e há necessidade de diminuir a pressão de caça e manter habitats preservados onde populações viáveis podem ocorrer. A onça-parda (Puma concolor) é o felídeo de maior distribuição no continente americano, ocorrendo desde o oeste do Canadá ao extremo sul do continente sul-americano. Possui adaptação a diversos tipos de ambientes, de desertos quentes até altiplanos alpinos, e florestas tropicais e temperadas. No Brasil, está presente em todos os biomas, ocorrendo em todos os estados brasileiros, com exceção do sul do Rio Grande do Sul. A caça e alterações de seus habitats, com consequente redução da disponibilidade de presas, são as principais ameaças a sobrevivência desse felino (Cheida et al., 2011). Os valores de riqueza e abundância de espécies variaram em algumas estações amostrais, sendo que a Área 2 apresentou maior valor para riqueza (N=17) e a Área 3 para abundância (N=48) (Quadro 09, Figura 14). Em relação à riqueza de espécies nos diferentes ambientes amostrados deve-se destacar a importância das manchas de cerrado s.s. como detentoras da maior parte da diversidade local de mamíferos não voadores. O cerrado s.s. é o ambiente natural historicamente dominante na paisagem e as manchas remanescentes desta fisionomia se constituem como os maiores refúgios para a fauna nesta região. Desta forma, espera-se uma alta riqueza nestas áreas tanto pela presença de espécies típicas de cerrado s.s. como pela presença de 65 espécies que encontraram refúgio neste ambiente, uma vez que atualmente a paisagem da região é dominada por atividades pecuárias e plantações de Eucalyptus. Figura 14 - Abundância (n° de registros) e riqueza (n° observado de espécies) de mamíferos nãovoadores registrados nas estações amostrais de monitoramento da mastofauna considerando as sete campanhas da fase pós-enchimento da UHE São Domingos, municípios de Água Clara e Ribas do Rio Pardo,MS. 66 A diversidade de espécies, por estação amostral, foi maior na Área 3 (3), seguido da Aréa 2 (2,6). Segundo Magurran (1988), o índice de diversidade de Shannon-Wiener varia de 1,5 a 3,5, podendo raramente ultrapassar o valor de 4,5. Vielliard e Silva (1990) dizem que valores de diversidade entre um e dois caracterizam a mastofauna não voadora das florestas temperadas e valores em torno de três são obtidos em ambientes tropicais. De maneira geral, pode-se considerar que as espécies apresentaram distribuição equilibrada, sem dominância, pois os índices de equitabilidade de Pielou ficaram próximos e acima de 80%. 67 6. CONSIDERAÇÕES FINAIS As baixas temperaturas características do período de seca contribuem para diminuição do número de registros, uma vez que a maioria dos animais tem sua atividade reduzida, dificultando a detecção. Os resultados da sétima campanha de monitoramento da fase pósenchimento da UHE São Domingos corroboraram com os resultados obtidos durante as campanhas anteriores realizadas na estação seca (2°, 3° e 6° campanhas), quando os valores de abundância e riqueza de espécies foram menores em comparação com as campanhas realizadas na estação chuvosa. As diferenças verificadas nos resultados das sete campanhas de monitoramento de fauna no período pós-enchimento (número de registros, número de espécies, diversidade e equabilidade) podem ser decorrentes da variação natural das populações e distribuição das espécies, influenciadas principalmente pela sazonalidade. Flutuações populacionais naturais durante o ano dificultam a detecção de interferências sobre a fauna, incluindo aquelas decorrentes de alterações ambientais por ação antrópica. Por este motivo, monitoramentos trimestrais e com no mínimo dois anos de duração, como no caso da UHE São Domingos, fornecem dados mais robustos para se tentar avaliar a dimensão dos impactos decorrentes de atividades humanas sobre as comunidades faunísticas. Dos resultados parciais, cabe destacar que a curva do coletor referente ao monitoramento da herpetofauna voltou a apresentar estabilização, visto que não houve registro de novas espécies durante a sétima campanha. Em todo caso, ressalta-se que a estabilização total da curva é bastante difícil, pois muitas espécies raras costumam ser adicionadas após muitas amostragens, sobretudo em regiões tropicais. Já para mastofauna e avifauna, houve registro de uma e duas novas espécies respectivamente, o que contribuiu para a não estabilização das curvas dos coletores. Este fato é comum em estudos faunísticos realizados na região Neotropical, devido à grande diversidade de espécies presentes em seus inúmeros ecossistemas. Em relação ao status de conservação, destaca-se que não há registro de espécies de anfíbios e répteis ameaçadas de extinção até o momento. No entanto, é importante ressaltar a presença de uma espécie de réptil endêmica do Cerrado na área (largatixa-escorpião Coleodactylus brachystoma), devido à sua pequena abrangência geográfica. Em relação às aves, reitera-se a ocorrência de espécies endêmicas e ameaçadas de extinção, além de espécies dependentes de ambientes florestados e sensíveis a alterações ambientais. Já no 68 monitoramento da mastofauna, foram registrados até o momento sete mamíferos ameaçados. Ressalta-se que muitas das ameaças relacionadas a essas espécies são decorrentes principalmente da perda e fragmentação de habitat, caça e atropelamentos. Desde a formação do reservatório da UHE São Domingos as comunidades da fauna presentes na região estão se reestabelecendo nos habitats remanescentes. O sucesso no reestabelecimento das comunidades, bem como a conservação da biodiversidade local pode ser subsidiada pela recuperação e conservação do mosaico de florestas aluviais, matas de galeria, áreas de várzea e Cerradão presentes nas áreas sob influência da hidrelétrica. Neste contexto, os Programas Ambientais das fases de licenciamento do empreendimento representam importantes medidas mitigadoras dos impactos sobre a fauna e flora da área de influência da UHE. O estabelecimento dos Programas que incluem reflorestamento, como PRAD (Programa de Recuperação de Áreas Degradadas) e PTRF (Projeto Técnico de Reconstituição da Flora) auxiliam na aceleração e no direcionamento da formação de corredores ecológicos ligando as manchas de florestas, principalmente matas ripárias, e savanas remanescentes no entorno do reservatório. 69 7. REFERÊNCIAS BIBLIOGRÁFICAS ALHO, C. 2003. Conservação da biodiversidade da Bacia do Alto Paraguai. Campo Grande: UNIDERP. 449p. ALHO, C. J. R., STRÜSSMANN, C. & L. A. S. VASCONCELLOS. 2000. Indicadores da magnitude da diversidade e abundância de vertebrados silvestres do Pantanal num mosaico de habitats sazonais. III Simpósio sobre Recursos Naturais e Sócio-econômicos do Pantanal – Os desafios do Novo Milênio. Corumbá – MS. ARZABE, C. 1999. Reproductive activity patterns of anurans in two different altitudinal sites within the Brazilian Caatinga. Revista Brasileira de Zoologia BEEBEE, T.J.C. 1996. Ecology and conservation of amphibians. Chapman & Hall, Londres, P. 1-214. BERNARDE, P.S. 2007.Ambientes e temporada de vocalização da anurofauna no Município de espigão do Oeste, Rondônia, Sudoeste da Amazônia – Brasil (Amphibia: Anura).Biota Neotropica 7:87-92. BÉRNILS, R. S. & COSTA, H. C. (org.). 2012. Brazilian reptiles – List of species. Accessible at http://www.sbherpetologia.org.br/. Sociedade Brasileira de Herpetologia. Capturedon 15/05/2013. BERSIER, L.F. & MEYER, D. 1994. Bird assemblages in mosaic forest: the relative importance of vegetaton structure and floristic composition along the successional gradient. Acta Oecologica 15: 561-576. BERTOLUCI, J. & RODRIGUES, M.T. 2000. Seasonal patterns of breeding activity of Atlantic Rainforest anurans at Boracéia, southeastern Brazil.Amphibia-Reptilia 23: 161-167. BIRDLIFE INTERNATIONAL. 2009. The BirdLife checklist of the birds of the world, with conservation status and taxonomic sources. Versão 2. Disponível em http://www.birdlife.org/datazone/speciessearchresults. php. Acesso em: 15/10/2012. BONVICINO, C. R., LINDBERGH, S. M. & L. S. MAROJA. 2002. Small non-flying mammals from conserved and altered areas of Atlantic forest and Cerrado: comments on their potential use for monitoring environment. Brazilian Journal of Biology. 62(4B): 765-774. 70 BORGES, S.H. & STOUFFER, P.C. 1999. Bird communities in two types of anthropogenic successional vegetation in central Amazonia. Condor 101: 529-536. BRAWN. J.D., ROBINSON, S.K. & THOMPSON, F.R. 2001. The role of disturbance in the ecology and conservation of birds. Annual Review of Ecology and Systematics 32: 251-276. BROOKS, T., TOBIAS, J. & BALFORD, A. 1999. Deforestation and Bird Extinction in the Atlantic Forest. Animal Conservation 2: 211-222. BRYCE, S.A., HUGHES, R.M. & KAUFMANN, P.R. 2002. Development of a bird integrity index: using bird assemblages as indicators of riparian condition. Environmental Management 30: 294-310. CÁCERES, N. C., BORNSCHEIN, M. R. & W. H. LOPES. 2008a. Uso do hábitat e a conservação de mamíferos no sul do bioma Cerrado. In: REIS, N. R., PERACCHI, A. L. & SANTOS, G. A. S. D. Ecologia de mamíferos. Londrina: Technical Books Editora. p.123-132. CÁCERES, N. C., BORNSCHEIN, M. R., HANNIBAL, W. & A. R. PERCEQUILLO. 2007. Mammal of the Bodoquena Mountains, southeastern Brazil – An ecological and conservation analysis. Revista Brasileira de Zoologia, 24(2) – 426-435. CÁCERES, N. C.; CARMIGNOTTO, A. C.; FISCHER, E. & C. F. SANTOS. 2008b. Mammals from Mato Grosso do Sul, Brazil. Check List 4 (3): 321-335. CAMPBELL, H.W. &CHRISTMAN, S.P. 1982.Field techniques for herpetofaunal community analysis. In: N. J. Scott Jr. (ed.), Herpetological Communities, p.93-200. Wildl.Res. Rept.13, US.Fish and Widl.Serv. Washington, DC. CANADAY, C. 1997. Loss of insectivorous birds along a gradient of human impact in Amazonia. Biological Conservation 77: 63-77. CARDOSO, A.J. & MARTINS, J.E. 1987. Diversidade de anuros durante o turno de vocalizações em comunidade neotropical. Papéis Avulsos de Zoologia, 36(23): 279-285. CBRO – COMITÊ BRASILEIRO DE REGISTROS ORNITOLÓGICOS. 2009. Listas das aves do Brasil. 8a Edição – 09/08/2009. http://www.cbro.org.br/CBRO/pdf/avesbrasil_ago2009.pdf. (último acesso em 15/10/2012). CBRO – COMITÊ BRASILEIRO DE REGISTROS ORNITOLÓGICOS. 2011. Listas das aves do Brasil. 10a Edição – 25/01/2011. http://www.cbro.org.br/CBRO/pdf/avesbrasil_jan2011.pdf. (último acesso em 15/10/2012). 71 CECHIN, S. Z. & MARTINS, M. 2000. Eficiência de armadilhas de queda (pitfalltraps) em amostragens de anfíbios e répteis no Brasil. Revista Brasileira de Zoologia 17: 729-740. CHEIDA, C. C.; NAKANO-OLIVEIRA, E.; FUSCO-COSTA, R. ROCHA-MENDES, F. & QUADROS, J. 2011. Ordem Carnivora. Pp. 235-288. In: REIS, N. R.; PERACCHI, A. L.; PEDRO, W. A. & LIMA, I. P. (Eds.). Mamíferos do Brasil. Londrina: Nélio R. dos Reis. 439 p. CITES. 2012. Convention on International Trade in Endangered Species of Wild Fauna and Flora. Disponível em: http://www.cites.org/; acessado em 03/02/2009. COLLI, G.R., BASTOS, R.P. & ARAÚJO, A.F.B. 2002. The character and dynamics of the Cerrado herpetofauna. In The Cerrados of Brazil: Ecology and Natural History of a Neotropical Savanna. (P.S. Oliveira & R.J. Marquis, eds.). Columbia University Press, New York, p. 223-241. COLWELL, R &CODDINGTON, J. 1994.Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of Royal Society of London, Series B, v.345, p.101118, 1994. COLWELL, R. K. 2011. EstimateS, Version 8.2: Statistical Estimation of Species Richness and Shared Species from Samples (Software and User's Guide). CONTE, C.E. & MACHADO R.A. 2005. Riqueza de espécies e distribuição espacial em comunidade de anuros (Amphibia, Anura) em uma localidade de Tijucas do Sul, Paraná, Brasil. Revista Brasileira de Zoologia 22: 940–948. CONTE, C.E. &ROSSA-FERES, D.C. 2006. Diversidade e ocorrência temporal da anurofauna (Amphibia, Anura) em São José dos Pinhais, Paraná, Brasil. Revista Brasileira de Zoologia 23(1): 162-175. COSTA, L. P.; LEITE, Y. L. R.; MENDES, S. L. & A. D. DITCHFIELD. 2005. Mammal Conservation in Brazil. Conservation Biology, vol. 19, n. 3, págs. 672-679. CRACRAFT, J. 1985. Historical biogeography and patterns of differentiation within the South American avifauna: Areas of endemism. Ornithological Monographs 36: 49-84. D´HORTA, F.M., SILVA, J.M.C. & RIBAS, C.C. 2008. Species limits and hybridization zones in Icterus cayanensis–chrysocephalus group (Aves: Icteridae). Biological Journal of Linnean Society 95:583-597. 72 DEVELEY, P.F. 2004. Métodos para estudos com aves. Pp. 153-168. In: Cullen, L. et al . (Eds.). Métodos de Estudos em Biologia da Conservação e Manejo da Vida Silvestre. Editora Universidade Federal do Paraná (UFPR), Curitiba, Paraná. DUELLMAN, W.E. &TRUEB, L. 1986.Biology of Amphibians. McGraw-Hill Publ. Co., New York. 670p. EISENBERG, J. F. & K. H. REDFORD, 1999. Mammals of the Neotropics – The Central Neotropics. vol. 3. The University of Chicago Press. 609 p. FROST, D.R. 2012. Amphibian Species of the World: an Online Reference. Electronic Database accessible at 04/03/2013 http://research.amnh.org/herpetology/amphibia/index.php. American Museum of Natural History, New York, USA). GIRAUDO, A. 2001. Serpientes de la Selva Paranaense y Del Chaco Húmedo. Buenos Aires, L.O. L. A. 328 p. GODOI, M.N., MORANTE-FILHO, J.C., FAXINA, C., MÓDENA, E.S., PIVATTO, M.A.C., MANÇO, D.D.G., BOCCHESE, R., TERIBELE, R., ROSA, A.L.M. & STAVIS, V.K. 2012. Aves da rapina raras no estado de Mato Grosso do Sul, Brasil. Atualidades Ornitológicas 170: 41-47. GOERCK, J.M. 1997. Patterns of rarity in the Birds of the Altantic Forests of Brazil. Conservation Biology 11:112-118. GOTELLI, N; COLWELL, R. 2001.Quantifying biodiversity: procedures and pitfalls in the measurement and comparison of species richness. Ecology Letters, v.4, p.379-391. GRANDINETTI, L. & JACOBI, C.M. 2005. Distribuição estacional de uma taxocenose de anuros (Amphibia) em uma área antropizada em Rio Acima, MG. Lundiana 6(1) 21-28. HASS, A. 2003 Avaliação da avifauna do Parque Nacional das Emas. Plano de Manejo do Parque Nacional das Emas. IBAMA/MMA, Brasília, DF. HEYER, W.R., DONNELLY, M.A., MCDIARMID, R.W., HAYEK, L.C. & FOSTER, M.S. 1994. Measuring and monitoring biological diversity. Standard methods for Amphibians. Smithsonian Institution Press, Washington. IUCN 2014. IUCN Red List of Threatened Species. Version 2013.1. <www.iucnredlist.org>. 73 JOHNS, A.D. 1991. Responses of Amazonian rain forest birds to habitat modification. Journal of Tropical Ecology 7: 417-437. KARR, J.R., ROBINSON, S.K., BLAKE, J.G. & BIERREGAARD, R.O. 1990. Bird of four Neotropical rainforests. In: Gentry, A.H. (Ed). Four Neotropical Rainforests. 237-268. Yale University Press, New Haven. LANGONE, J.A. 1994. Ranas Y sapos deluruguay (Reconocimiento y aspectos biológicos). MuseoDámasoAntonioLarrañaga. Serie De Divulgación5: 1-123. LIMA BORGES, P. A. & W. M. TOMÁS. 2004. Guia de rastros e outros vestígios de mamíferos do Pantanal. Corumbá Embrapa Pantanal. LIPS, K. R., BURROWES, P. A., MENDELSON, J. R. & PARRA-OLEA, G. 2005. Amphibianpopulation declines in LatinAmerica: a synthesis. Biotropica 37:222–226. MACHADO, A.B.M., MARTINS, C.S. & DRUMMOND, G.M. (eds.). 2005. Lista da fauna brasileira ameaçada de extinção. Fundação Biodiversitas, Belo Horizonte. MAMEDE, S. B. & C. J. R. ALHO. 2008. Impressões do Cerrado & Pantanal – subsídios para a observação de mamíferos silvestres não-voadores. 2ª Ed. Editora Uniderp. 192 pag. MARINI, M.A. 2001. Effects of forest fragmentation on birds of the cerrado region, Brazil. Bird Conservation International 11: 13-25. MARQUES, O.A.V., A.S. ABE & M. MARTINS. 1998. Estudo diagnóstico da diversidade de répteis do estado de São Paulo. In: Biodiversidade do estado de São Paulo: síntese do conhecimento ao final do século XX. Editora FAPESP, São Paulo. MARQUES, O.A.V., ETEROVIC, A., STRÜSSMANN, C. E &SAZIMA, A. 2005. "Serpentes Do Pantanal: Guia Ilustrado" 184pp. MARSH, D.M. &TRENHAM, P.C. 2001. Metapopulation dynamics and Amphibian conservation.Conserv. Biol. 15(1): 40-49. MAURO, R.A. & Z. CAMPOS. 2000. Fauna. In: Zoneamento Ambiental – Borda oeste do Pantanal: Maciço do Urucum e Adjacências. J.S.V. da SILVA (Ed.). Embrapa Pantanal. Corumbá. 74 MEDRI, I. M.; MOURÃO, G. M. & F. H. G. RODRIGUES. 2011. Ordem Cingulata. In: Nelio R. dos Reis; Adriano L. Peracchi; Wagner A. Pedro; Isaac P. de Lima. (Org.). Mamíferos do Brasil. 2ed.Londrina: p. 75-90. MINISTÉRIO DO MEIO AMBIENTE (MMA). 2002. Biodiversidade Brasileira: Avaliação E Identificação De Áreas E Ações Prioritárias Para Conservação, Utilização Sustentável E Repartição Dos Benefícios Da Biodiversidade Nos Biomas Brasileiros. 404 Pg. MMA. 2003. Instrução Normativa n.3 do Ministério do Meio Ambiente, de 27 de maio de 2003. MMA. 2008. Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis. Lista das Espécies da Fauna Brasileira Ameaçadas de Extinção. Instrução Normativa n. 3 do Ministério do Meio Ambiente, de 27 de maio de 2003. Disponível em www.biodiversitas.org.br. MOTTA-JUNIOR, J.C. 1990. Estrutura trófica e composição das avifaunas de três hábitats terrestres na região central do estado de São Paulo. Ararajuba 1: 65-71. MYERS, N., MITTERMEIER, R. A., MITTERMEIER, C. G., FONSECA, G. A. B. & J. KENT. 2000. Biodiversity hotspots for conservation priorities. Nature 403: 853-858. NAVEDA, A., DE THOISY, B., RICHARD-HANSEN, C., TORRES, D.A., SALAS, L., WALLANCE, R., CHALUKIAN, S. & S. DE BUSTOS. 2008. Tapirus terrestris (em Inglês). IUCN 2014. Lista Vermelha de Espécies Ameaçadas da IUCN de 2013 Versão 1. PECHMANN, J.H.K., SCOTT D.E., SEMLITSCH R.D., CALDWELL J.P., VITTL.J. & GIBBONS W. 1991. Declining amphibians populations: the problem of separating human impacts from natural fluctuations. Science, Washington, 253: 825-940. POMBAL JR., J. P. 1997. Distribuição espacial e temporal de anuros (Amphibia) em uma poça permanente na Serra de Paranapiacaba, sudeste do Brasil. Revista Brasileira de Biologia 57: 583-594. POUGH, F.H., ANDREWS, R.M., CADLE, J.E., CRUMP, M.L., SAVITISKY, A.H.;,WELLS, K.D. 2001. Herpetology.Prentice Hall. PRADO, C.P.A.; UETANABARO, M. & HADDAD, C.F.B. 2005. Breeding activity patterns, reproductive modes, and habitat use by anurans (Amphibia) in a seasonal environment in the Pantanal, Brazil. Amphibia-Reptilia 26: 211-221. 75 PRADO, G. M. & POMBAL Jr, J. P. 2005. Distribuição espacial e temporal dos anuros em um brejo da Reserva Biológica de Duas Bocas, sudeste do Brasil. Arquivos do Museu Nacional, Rio de Janeiro, 63(4): 685-705. REIS, N. R., PERACCHI, A. L., PEDRO, W. A. & I. P. LIMA. 2011. Mamíferos do Brasil. Londrina – PR. 2. ed. 437 páginas. RENCTAS (Rede Nacional de Combate ao Tráfico de Animais Silvestres). 2012. Disponível em:< www.renctas.org.br> RIBON, R. 2010. Amostragem de aves pelo método das listas de Mackinnon. In: Sandro Von Matter; Fernando Straube; Iury Accordi; Vitor Piacentini; José Flávio Cândido Jr. (Org.). Ornitologia e Conservação: Ciência Aplicada, Técnicas de Pesquisa e Levantamento. Rio de Janeiro: Technical Books. 1-16pp. RODDEN, M., RODRIGUES , F. & BESTELMEYER, S. 2008. Chrysocyon brachyurus (em Inglês). IUCN . Lista Vermelha de Espécies Ameaçadas da IUCN de 2012 Versão 2. Página visitada em 03 de março de 2013. RODRIGUES, F. H. G., MEDRI, I. M., TOMAS, W. M. & G. M. MOURÃO. 2002. Revisão do conhecimento sobre ocorrência e distribuição de Mamíferos do Pantanal. Embrapa Pantanal. Documentos 38. Corumbá. RODRIGUES, M., CARRARA, L.A., FARIA, L.P. & GOMES, H.B. 2005. Aves do Parque Nacional da Serra do Cipó, Minas Gerais, Brasil. Revista Brasileira de Zoologia 22: 326-338. SAWAYAR.J. 2003. História natural e ecologia das serpentes do cerrado da região de Itirapina – SP. Tese de doutorado do Programa de Pós-graduação em Ecologia da Universidade Estadual de Campinas, UNICAMP, SP. SCOTT JR., N. J & WOODWARD, B. D. 1994.Survey at breeding sites. In: W. R. Heyer, M. A. Donnelly, R. W. Mcdiarmind, L. A. C. Hayec & M. S. Foster. (Eds). Measuring and monitoring biological diversity – standard methods for amphibias. Washigton, Smithsonian Institution Press, XIX+364p. SEGALLA, MAGNO V.; CARAMASCHI, ULISSES; CRUZ, CARLOS A. G.; GARCIA, PAULO C. A.; GRANT, TARAN; HADDAD, CÉLIO F. B &LANGONE, JOSÉ 2012. Brazilian amphibians – List of species. Accessible at http://www.sbherpetologia.org.br. Sociedade Brasileira de Herpetologia. Capturedon15/05/2013. 76 SICK, H. 1997. Ornitologia Brasileira. Editora Nova Fronteira S. A., Rio de Janeiro – RJ. SIGRIST, T. 2007. Guia de Campo: Aves do Brasil Oriental. 1° Edição, Vol. 1. São Paulo – SP. 448 pgs. SILVA, J.M.C. & BATES, J.M. 2002. Biogeographic Patterns and Conservation in the South American Cerrado: a Tropical Savanna Hotspot. BioScience 52 (3): 225-233 SILVA, J.M.C. & SANTOS, M.P.D. 2005. A importância relativa dos processos biogeográficos na formação da avifauna do Cerrado e de outros biomas brasileiros. In: Scariot, A., Souza-Silva, J.C. & Felfili J.M. (Org). Cerrado: Ecologia, Biodiversidade e Conservação. Brasília, DF. 439 pág. SILVA, J.M.C. 1995a. Avian inventory of the Cerrado Region, South America: Implications for biological conservation. Bird Conservation International 5: 15-28. SILVA, J.M.C. 1995b. Biogeographic analysis of the South American cerrado avifauna. Steenstrupia 21: 49-67. SILVA, J.M.C. 1995c. Birds of the Cerrado Region, South America. Steenstrupia 21: 69-92. SILVA, J.M.C. 1996. Distribution of Amazonian and Atlantic birds in gallery forests of the Cerrado region, South America. Ornitologia Neotropical. 7:1-18. SILVA, J.M.C. 1997. Endemic bird species and conservation in the Cerrado Region, South America. Biodiversity and Conservation 6: 435-450. SILVA, M.B., ZUCCA, C.F., SOUZA, C.R., MAMEDE, S., PINA, P.I. & OLIVEIRA, I.R. 2006. Inventário da Avifauna no Complexo Aporé - Sucuriú. In: Pagotto, T.C.S. & De Souza, P.R. (Org). Biodiversidade do Complexo Aporé – Sucuriú: Subsídios à conservação e manejo do Bioma Cerrado. Editora UFMS. 308 páginas. Campo Grande – MS. SILVANO, D. L. & PIMENTA, B. V. S. 2003. Diversidade de anfíbios na Mata Atlântica do Sul da Bahia. In Corredor de Biodiversidade na Mata Atlântica do Sul da Bahia (P. I. PRADO, E. C. LANDAU, R. T. MOURA, L. P. S. PINTO, G. A. B. FONSECA & K. ALGER, orgs.). CD-ROM, Ilhéus, IESB/CI/CABS/UFMG/UNICAMP. SILVANO, D.L. & SEGALLA, M.V. 2005. Conservação de anfíbios no Brasil. Megadiversidade1(1): 79-86. 77 SILVEIRA, L.F. & STRAUBE, F.C. 2008. Aves ameaçadas de extinção no Brasil. In: Machado, A.B.M., Drummond, G.M. & Paglia, A.P. (Eds.). P.379- 666. Livro Vermelho da Fauna Brasileira Ameaçada de Extinção. Ministério do Meio Ambiente/Fundação Biodiversitas, Brasília. SOUZA, D. 2002. All the Birds of Brazil: An Identification Guide. 1° edição. Editora Dall. Salvador – BA. 356 páginas. STOTZ, D.F., FITZPATRICK, J.W., PARKER, T.A. & MOSKOVITS, D.K. 1996. Neotropical Birds: Ecology and Conservation. The University of Chicago Press, Chicago. STOUFFER, P.C. & BIERREGAARD, R.O.Jr. 1995. Use of Amazonian forest fragmentens by understory insectivorous birds. Ecology 76: 2429-2445. STRAUBE, F.C., BORNSCHEIN, M.R. & SCHERER-NETO, P. 1996. Coletânea da avifauna da região noroeste do Estado do Paraná e áreas limítrofes (Brasil). Arquivos de Biologia e Tecnologia 39 (1): 193-214. STRAUBE, F.C., URBEN-FILHO A., ROCHA, M. C. V., NUNES, A.P. & TOMAS, W.M. 2006. Nova contribuição à Ornitologia do Chaco Brasileiro (Mato Grosso do Sul, Brasil). Atualidades Ornitológicas 134: 1-27. STRÜSSMANN, C., PRADO, C.P.A., UETANABARO, M. & FERREIRA, V. L. 2000. Levantamento de anfíbios e répteis de localidades selecionadas na porção sul da planície alagada do Pantanal e Cerrado do entorno, Mato Grosso do Sul, Brasil. In Uma avaliação ecológica dos ecossistemas aquáticos do Pantanal, Mato Grosso do Sul, Brasil (P.W. Willink, B. Chernoff, L.E. Alonso, J.R. Montambault & R. Lourival, eds.). Conservation International. Washington, DC, p. 219-223. STUART SN, CHANSON JS, COX NA, YOUNG BE, RODRIGUES ASL, FISCHMAN DL, WALLER RW. 2004. Status and trends of amphibian declines and extinctions wordwide. Science 306:1783–1786. TERBORGH, J. 1988. The big things that run the world – a sequel to E. O. Wilson. Conservation Biology. 2: 402-403. TERBORGH, J. 1992. Maintenance of diversity in tropical forests. Biotropica 24(2b): 283292. 78 TERBORGH, J., ROBINSON, S.K., PARKER lll, T. A., MUNN, C. A. & PIERPONT, N. 1990. Structure and organization of amazonian forest bird community. Ecological Monographs 60: 213-238. TIEPOLO, L. M. & TOMAS, W. M. 2011. Ordem Artiodactyla. In: Nélio R. dos Reis; Adriano L. Peracchi; Wagner A. Pedro; Isaac P. de Lima. (Org.). Mamíferos do Brasil. 2ed.Londrina: Cap.10, p. 293-313. TIEPOLO, L. M., TOMAS, W. M.; FERNANDEZ, F. A. S. & LIMA BORGES, P. A. 2004. conservação a população do cervo-do-pantanal Blastocerus dichotomus (Illiger, 1815) (Mammalia, Cervidae) no Parque Nacional de Ilha Grande e entorno (PR/MS).. Natureza & Conservação.2(1),56-66. TOCHER, M. D.; GASCON, C.; ZIMMERMAN, B. L. 1997. Fragmentation effects on a central Amazonian frog community: a ten-year study. In: LAURENCE, W.F.; BIERREGAARD, O. JR. Tropical Forest Remnants: Ecology, Management, and Conservation of Fragmented COMMUNITIES. THE UNIVERSITY OF CHICAGO PRESS, ILLINOIS, P. 124-137. UETANABARO, M; PRADO, C.P.A.; RODRIGUES, D.J.; GORDO, M. & CAMPOS. Z. 2008. Guia de Campo dos Anuros do Pantanal Sul e Planaltos de Entorno. VAN PERLO, B. 2009. A field guide to the Birds of Brazil. Oxford University Press. 465 páginas. VIEIRA, E. M. & A. R. T. PALMA. 2005. Pequenos mamíferos de Cerrado – distribuição dos gêneros e estrutura das comunidades nos diferentes habitats. In – SCARIOT, A., J. C. SOUZA-SILVA & J. M. FELFILI. Cerrado – Ecologia, Diversidade e Conservação. MMA. Brasília – DF. VITT, J.P., WILBUR, H.M. & SMITH, D.C. 1990.Amphibians as harbingers of decay.BioScience40:418. VOSS, R. & L. H. EMMONS. 1996. Mammalian diversity in neotropical lowland rainforest: a preliminary assessment. Bulletin of the American Museum of Natural History. 230: 1-115. WILLIS, E.O. 1979. The composition of avian communities in remanescent woodklots in southern Brazil. Papéis Avulsos de Zoologia 33: 1-25. YOCCOZ, N. G.; NICHOLS, J. D. &BOULINIER, T. 2001. Monitoring of biological diversity in space and time.Trends in ecology and evolution 16(8): 446-453. 79 ANEXOS 80 ANEXO I Documentação Fotográfica 81 Foto 1 - Pegada de onça-parda (Puma concolor) registrada – 6° campanha de monitoramento. Foto 2 - Cutia (Dasyprocta azarae) registrada – 7° campanha de monitoramento. Foto 3 – Lagartixa-escorpião (Coleodactylus brachystoma) registrado – 6° campanha de monitoramento. Foto 4 - Lobinho (Cerdocyon thous) registrado – 6° campanha de monitoramento. Foto 5 - Arapaçu-grande platyrostris) registrado – 6° monitoramento. Foto 6 – Anta (Tapirus terrestris) registrada – 6° campanha de monitoramento. (Dendrocolaptes campanha de 82 Foto 7 - Picapauzinho-anão (Veniliornis passerinus) registrado – 6° campanha de monitoramento. Foto 8 - Tucano-toco (Ramphastos toco) registrado – 6° campanha de monitoramento. Foto 9 - Lagarto (Ameiva ameiva) registrado – 5ª campanha de monitoramento. Foto 10 - Leptodactylus mystacinus registrado - 5ª campanha de monitoramento. Foto 11 - Trinca-ferro (Saltator similis) registrado – 5ª campanha de monitoramento. Foto 12 - Cigarra-do-campo (Neothraupis fasciata) registrada – 5ª campanha de monitoramento. 83 Foto 13 - Beija-flor-tesoura (Eupetomena macroura) registrado – 4ª campanha de monitoramento. Foto 14 - Soldadinho (Antilophia galeata) registrado – 4ª campanha de monitoramento. Foto 15 - Vistoria dos pitfalls durante a 4ª campanha de monitoramento. Foto 16 - Choca-do-planalto fêmea (Thamnophilus pelzeni) registrada – 3ª campanha de monitoramento. Foto 17 - Verão ou príncipe (Pyrocephalus rubinus) registrado – 3ª campanha de monitoramento. Foto 18 – Jandaia-estrela (Aratinga aurea) registrado – 3ª campanha de monitoramento. 84 Foto 19 - Pegada de Anta (Tapirus terrestris) – 3ª campanha de monitoramento. Foto 20 - Biólogo revisando as armadilhas. – 3ª campanha de monitoramento. Foto 21 - Cachorro-do-mato (Cerdocyon thous) registrado– 3ª campanha de monitoramento. Foto 22 - Catita (Micoureus constantiae) registrada – 3ª campanha de monitoramento. Foto 23 - Saíra-amarela (Tangara cayana) registrada – 2ª campanha de monitoramento. Foto 24 - Choca-do-planalto (Thamnophilus pelzeni) registrada – 2ª campanha de monitoramento. 85 Foto 25 - Pegada de lobinho (Cerdocyon thous) – 2ª campanha de monitoramento. Foto 26 - Pegada de veado catingueiro (Mazama gouazoubira) – 2ª campanha de monitoramento. Foto 27 - Pegadas de cateto (Pecari tajacu) – 2ª campanha de monitoramento. Foto 28 - Captura (Gracilinanus agilis) monitoramento. Foto 29 - Carcaça de tatu-peba (Euphractus sexcinctus) – 2ª campanha de monitoramento. Foto 30 - Biólogo realizando marcação do animal capturado – 2ª campanha de monitoramento. e – marcação de cuíca 2ª campanha de 86 Foto 31 - Hypsiboas raniceps registrada – 1ª campanha de monitoramento. Foto 32 - Scinax fuscomarginatus registrada – 1ª campanha de monitoramento. Foto 33 - Physalaemus centralis registrada – 1ª campanha de monitoramento. Foto 34 - Leptodactylus fuscus registrada – 1ª campanha de monitoramento. Foto 35 - Leptodactylus labyrinthicus registrada – 1ª campanha de monitoramento. Foto 36 - Elachistocleis cesarii registrada – 1ª campanha de monitoramento. 87 Foto 37 - Anta (Tapirus terrestris) registrada – 1ª campanha de monitoramento. Foto 38 - Tamanduá-bandeira (Myrmecophaga tridactyla) registrado – 1ª campanha de monitoramento. Foto 39 - Pegadas de lobinho (Cerdocyon thous). – 1ª campanha de monitoramento. Foto 40 - Tatu-peba (Euphractus sexcinctus) registrado – 1ª campanha de monitoramento. Foto 41 - Pegadas de veado-catinguero (Mazama gouazoubira) – 1ª campanha de monitoramento. Foto 42 - Fezes de veado-mateiro (Mazama americana) – 1ª campanha de monitoramento. 88 Foto 43 - Auxiliar de campo realizando os procedimentos de instalação de armadilha de queda (pitfall traps) – 1ª campanha de monitoramento. Foto 44 - Biólogo no procedimento de instalação de armadilha de queda (pitfall traps) – 1ª campanha de monitoramento. Foto 45 - Armadilhas de queda instaladas (pit falls trap) – 1ª campanha de monitoramento. Foto 46 - Biólogo realizando o procedimento de pesagem do animal capturado – 1ª campanha de monitoramento. Foto 47 - Biólogo realizando marcação do animal capturado – 1ª campanha de monitoramento. Foto 48 - Cuíca (Gracilinanus agilis) com marcação (brinco) – 1ª campanha de monitoramento. 89 Foto 49 - Canário-da-terra-verdadeiro (Sicalis flaveola) registrado – 1ª campanha de monitoramento. Foto 50 - Saíra-de-papo-preto (Hemithraupis guira) registrada – 1ª campanha de monitoramento. Foto 51 - Socó-boi (Tigrisoma lineatum) registrado – 1ª campanha de monitoramento. 90 ANEXO II Dados brutos dos registros (Herpetofauna e Mastofauna) 91 Quadro 01 - Dados brutos das espécies de anfíbios e répteis registradas nas áreas de influência da UHE São Domingos, município de Água Clara, MS, durante as sete campanhas de monitoramento da herpetofauna na fase pós-enchimento. Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Dendropsophus elianae (Napoli & Caramaschi, 2000) Procura ativa 5 5 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 5 16 Busca ativa limitada por tempo 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus rubicundulus (Reinhardt & Lütken, 1862″1861″) Procura ativa 5 8 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 5 5 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 5 7 Busca ativa limitada por tempo 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 5 24 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 5 2 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 5 16 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 5 3 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 5 6 Busca ativa limitada por tempo 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 5 2 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus podicipinus (Cope, 1862) Procura ativa 5 8 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Elachistocleis cesarii (Miranda Ribeiro, 1920) Procura ativa 5 3 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 1 12 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Espécie 92 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Physalaemus centralis Bokermann, 1962 Procura ativa 1 6 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 1 10 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 1 13 Busca ativa limitada por tempo 21/02/2013 1ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 1 4 zoofonia 21/02/2013 1ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Dendropsophus elianae (Napoli & Caramaschi, 2000) Procura ativa 3 1 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 3 7 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Dendropsophus rubicundulus (Reinhardt & Lütken, 1862″1861″) Procura ativa 3 3 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 3 15 Busca ativa limitada por tempo 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 3 13 Busca ativa limitada por tempo 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 3 15 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 3 7 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 3 4 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 3 4 Busca ativa limitada por tempo 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 3 2 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 3 6 zoofonia 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Espécie 93 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Leptodactylus podicipinus (Cope, 1862) Procura ativa 3 8 Busca ativa limitada por tempo 22/02/2013 1ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Dendropsophus sanborni (Schmidt, 1944) Procura ativa 4 2 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 4 7 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas punctatus (Schneider, 1799) Procura ativa 4 2 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 4 5 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 4 16 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 4 3 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 4 1 Busca ativa limitada por tempo 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus labyrinthicus (Spix, 1824) Procura ativa 4 1 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Dendropsophus sanborni (Schmidt, 1944) Procura ativa 6 7 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 6 2 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 6 9 zoofonia 23/02/2013 1ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 6 2 Busca ativa limitada por tempo 23/02/2013 1ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Micrablepharus maximiliani (Reinhardt & Luetken, 1862) Pitfall02 1 Busca ativa limitada por tempo 23/02/2013 1ª de Operação Chuvosa 0273861/ 7783765 Não Não Não Procura ativa 2 3 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Espécie Hypsiboas albopunctatus (Spix, 1824) 94 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Hypsiboas raniceps Cope, 1862 Procura ativa 2 11 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 2 17 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 2 4 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 2 9 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 2 7 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Elachistocleis cesarii (Miranda Ribeiro, 1920) 22 Procura ativa 3 2 zoofonia 24/02/2013 1ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 1 2 zoofonia 05/05/2013 2ª de Operação Seca 0271803/ 7784476 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 5 2 zoofonia 06/05/2013 2ª de Operação Seca 0271759/ 7784701 Não Não Não Caiman latirostris (Daudin, 1802) Procura ativa 5 2 Busca ativa limitada por tempo 06/05/2013 2ª de Operação Seca 0271759/ 7784701 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 4 4 zoofonia 07/05/2013 2ª de Operação Seca 0273635/ 7783997 Não Não Não Eunectes murinus (Linnaeus, 1758) Procura ativa 4 1 Busca ativa limitada por tempo 07/05/2013 2ª de Operação Seca 0273635/ 7783997 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 2 3 zoofonia 08/05/2013 2ª de Operação Seca 0271763/ 7781639 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 3 15 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Pseudopaludicola saltica (Cope, 1887) Procura ativa 3 9 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 3 6 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus labyrinthicus (Spix, 1824) Procura ativa 3 2 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Espécie 95 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Dendropsophus nanus (Boulenger, 1889) Procura ativa 3 5 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Physalaemus centralis Bokermann, 1962 Procura ativa 3 3 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 3 7 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 3 4 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus mystacinus (Burmeister, 1861) Procura ativa 3 2 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 3 2 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Elachistocleis cesarii (Miranda Ribeiro, 1920) Procura ativa 3 2 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 1 8 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 1 3 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Leptodactylus podicipinus (Cope, 1862) Procura ativa 1 1 Busca ativa limitada por tempo 14/10/2013 4ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Caiman latirostris (Daudin, 1802) Procura ativa 5 1 Busca ativa limitada por tempo 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 5 14 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 5 8 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Physalaemus centralis Bokermann, 1962 Procura ativa 5 3 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 5 7 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 5 6 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Espécie 96 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 5 9 zoofonia 14/10/2013 4ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 4 1 Busca ativa limitada por tempo 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Dendropsophus sanborni (Schmidt, 1944) Procura ativa 4 30 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 4 28 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 4 15 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Dendropsophus minutus (Peters, 1872) Procura ativa 4 2 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 4 16 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 4 6 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 4 4 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 4 5 zoofonia 15/10/2013 4ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 6 4 zoofonia 16/10/2013 4ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 6 7 zoofonia 16/10/2013 4ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 6 3 zoofonia 16/10/2013 4ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 6 7 zoofonia 16/10/2013 4ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 6 6 zoofonia 16/10/2013 4ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Leptodactylus mystacinus (Burmeister, 1861) Procura ativa 6 2 zoofonia 16/10/2013 4ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Pitfall03 1 Armadilha de queda 16/10/2013 4ª de Operação Chuvosa 0274162/ 7781689 Não Sim Não Espécie Physalaemus cuvieri Fitzinger, 1826 97 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Eupemphix nattereri Steindachner, 1863 Procura ativa 1 4 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Eupemphix nattereri Steindachner, 1863 Procura ativa 2 8 zoofonia 23/01/2014 5ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Eupemphix nattereri Steindachner, 1863 Procura ativa 3 6 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Eupemphix nattereri Steindachner, 1863 Procura ativa 5 3 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 1 1 Busca ativa limitada por tempo 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 3 2 Busca ativa limitada por tempo 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 4 1 Busca ativa limitada por tempo 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 5 4 Busca ativa limitada por tempo 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 3 3 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 4 5 Busca ativa limitada por tempo 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 5 1 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 6 8 Busca ativa limitada por tempo 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Leptodactylus podicipinus (Cope, 1862) Procura ativa 2 9 zoofonia 23/01/2014 5ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Leptodactylus podicipinus (Cope, 1862) Procura ativa 3 15 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus podicipinus (Cope, 1862) Procura ativa 5 22 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Espécie 98 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Leptodactylus fuscus (Schneider, 1799) Procura ativa 1 7 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 2 6 zoofonia 23/01/2014 5ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 3 4 Busca ativa limitada por tempo 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Leptodactylus fuscus (Schneider, 1799) Procura ativa 5 13 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Leptodactylus mystacinus (Burmeister, 1861) Procura ativa 4 3 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Leptodactylus mystacinus (Burmeister, 1861) Procura ativa 6 2 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Physalaemus centralis Bokermann, 1962 Procura ativa 1 6 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Physalaemus centralis Bokermann, 1962 Procura ativa 5 13 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 2 6 zoofonia 23/01/2014 5ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 3 9 Busca ativa limitada por tempo 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 4 4 Busca ativa limitada por tempo 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 5 14 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Physalaemus cuvieri Fitzinger, 1826 Procura ativa 6 5 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 1 5 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 4 9 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Pseudopaludicola mystacalis (Cope, 1887) Procura ativa 6 5 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Espécie 99 Espécie Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Elachistocleis cesarii (Miranda Ribeiro, 1920) Procura ativa 2 3 zoofonia 23/01/2014 5ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Elachistocleis cesarii (Miranda Ribeiro, 1920) Procura ativa 5 7 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus elianae (Napoli & Caramaschi, 2000) Procura ativa 5 13 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus minutus (Peters, 1872) Procura ativa 4 8 Busca ativa limitada por tempo 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Dendropsophus minutus (Peters, 1872) Procura ativa 5 17 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 1 14 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 4 16 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 5 24 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 6 6 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Dendropsophus sanborni (Schmidt, 1944) Procura ativa 4 7 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Dendropsophus sanborni (Schmidt, 1944) Procura ativa 6 9 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 4 1 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 5 3 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 6 5 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Hypsiboas punctatus (Schneider, 1799) Procura ativa 3 8 Busca ativa limitada por tempo 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Hypsiboas punctatus (Schneider, 1799) Procura ativa 5 11 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não 100 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Hypsiboas punctatus (Schneider, 1799) Procura ativa 6 5 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 1 3 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271803/ 7784476 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 4 2 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 3 15 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271847/ 7784303 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 4 17 zoofonia 22/01/2014 5ª de Operação Chuvosa 0273635/ 7783997 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 5 26 zoofonia 21/01/2014 5ª de Operação Chuvosa 0271759/ 7784701 Não Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 6 9 zoofonia 23/01/2014 5ª de Operação Chuvosa 0273792/ 7781898 Não Não Não Phyllomedusa azurea Cope, 1862 Procura ativa 2 8 zoofonia 23/01/2014 5ª de Operação Chuvosa 0271763/ 7781639 Não Não Não Ameiva ameiva (Linnaeus, 1758) Pitfall 2 1 Encontro oportunístico 22/01/2014 5ª de Operação Chuvosa 0273861/ 7783765 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 2 2 Busca ativa limitada por tempo 08/04/2014 6ª de Operação Seca 0271763/ 7781639 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 3 1 Busca ativa limitada por tempo 09/04/2014 6ª de Operação Seca 0271847/ 7784303 Não Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 4 1 Busca ativa limitada por tempo 10/04/2014 6ª de Operação Seca 0273635/ 7783997 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 1 3 zoofonia 09/04/2014 6ª de Operação Seca 0271803/ 7784476 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 2 1 zoofonia 10/04/2014 6ª de Operação Seca 0271763/ 7781639 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 5 8 zoofonia 09/04/2014 6ª de Operação Seca 0271759/ 7784701 Não Não Não Dendropsophus nanus (Boulenger, 1889) Procura ativa 6 1 zoofonia 10/04/2014 6ª de Operação Seca 0273792/ 7781898 Não Não Não Espécie 101 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Coletado Marcação Depósito em Coleção Dendropsophus sanborni (Schmidt, 1944) Procura ativa 4 15 zoofonia 10/04/2014 6ª de Operação Seca 0273635/ 7783997 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 1 1 zoofonia 09/04/2014 6ª de Operação Seca 0271803/ 7784476 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 2 4 zoofonia 08/04/2014 6ª de Operação Seca 0271763/ 7781639 Não Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 6 3 zoofonia 10/04/2014 6ª de Operação Seca 0273792/ 7781898 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 1 2 zoofonia 09/04/2014 6ª de Operação Seca 0271803/ 7784476 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 4 26 zoofonia 10/04/2014 6ª de Operação Seca 0273635/ 7783997 Não Não Não Hypsiboas raniceps Cope, 1862 Procura ativa 5 5 zoofonia 09/04/2014 6ª de Operação Seca 0271759/ 7784701 Não Não Não Pitfall03 1 Armadilha de queda 11/04/2014 6ª de Operação Seca 0274162/ 7781689 Não Não Sim Hypsiboas albopunctatus (Spix, 1824) Procura ativa 5 4 zoofonia 21/07/2014 7ª de Operação Seca 0271759/ 7784701 Não Não Caiman latirostris (Daudin, 1802) Procura ativa 5 1 Busca ativa limitada por tempo 21/07/2014 7ª de Operação Seca 0271759/ 7784701 Não Não Physalaemus centralis Bokermann, 1962 Procura ativa 5 3 zoofonia 21/07/2014 7ª de Operação Seca 0271759/ 7784701 Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 5 7 zoofonia 21/07/2014 7ª de Operação Seca 0271759/ 7784701 Não Não Leptodactylus chaquensis (Cei, 1950) Procura ativa 3 3 Busca ativa limitada por tempo 21/07/2014 7ª de Operação Seca 0271847/ 7784303 Não Não Leptodactylus diptyx Boettger, 1885 Procura ativa 3 4 zoofonia 21/07/2014 7ª de Operação Seca 0271847/ 7784303 Não Não Hypsiboas albopunctatus (Spix, 1824) Procura ativa 1 2 zoofonia 22/07/2014 7ª de Operação Seca 0271803/ 7784476 Não Não Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 1 3 zoofonia 22/07/2014 7ª de Operação Seca 0271803/ 7784476 Não Não Espécie Coleodactylus brachystoma (Amaral, 1935) Não Não Não Não Não Não Não Não 102 Ponto Abundância Método de registro Data Campanha Estação Coordenadas (UTM – 22K) Physalaemus centralis Bokermann, 1962 Procura ativa 1 4 zoofonia 22/07/2014 7ª de Operação Seca 0271803/ 7784476 Hypsiboas albopunctatus (Spix, 1824) Procura ativa 4 5 zoofonia 23/07/2014 7ª de Operação Seca 0273635/ 7783997 Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 4 3 zoofonia 23/07/2014 7ª de Operação Seca 0273635/ 7783997 Dendropsophus minutus (Peters, 1872) Procura ativa 6 2 zoofonia 24/07/2014 7ª de Operação Seca 0273792/ 7781898 Scinax fuscomarginatus (A. Lutz, 1925) Procura ativa 6 4 zoofonia 24/07/2014 7ª de Operação Seca 0273792/ 7781898 Hypsiboas albopunctatus (Spix, 1824) Procura ativa 2 3 zoofonia 24/07/2014 7ª de Operação Seca 0271763/ 7781639 Pitfall03 1 Armadilha de queda 24/07/2014 7ª de Operação Seca 0274162/ 7781689 Espécie Leptodactylus diptyx Boettger, 1885 Coletado Não Não Não Não Não Não Não Marcação Depósito em Coleção Não Não Não Não Não Não Não Não Não Não Não Não Não Não 103 Quadro 02 - Dados brutos das espécies de mamíferos de médio e grande porte registradas nas áreas de influência da UHE São Domingos, município de Água Clara, MS, durante as sete campanhas da fase de pós-enchimento. Ponto Data Longitude Latitude Ordem Família Espécie Método 1 20/2/13 7781037 267786 CARNIVORA Felidae Leopardus pardalis pegada 1 20/2/13 7781037 267786 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 1 20/2/13 7781037 267786 RODENTIA Caviidae Hydrochoerus hydrochaeris pegada, visual, fezes 2 22/2/13 7783942 273643 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 2 22/2/13 7783942 273643 ARTIODACTYLA Tayassuidae Tayassu pecari pegada 3 23/2/13 7781640 274109 CINGULATA Dasypodidae Euphractus sexcinctus pegada, toca 3 23/2/13 7781640 274109 CARNIVORA Felidae Leopardus tigrinus pegada 3 23/2/13 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 3 23/2/13 7781640 274109 CARNIVORA Canidae Chrysocyon brachyurus pegada 3 23/2/13 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 3 23/2/13 7781640 274109 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 3 23/2/13 7781640 274109 ARTIODACTYLA Cervidae Mazama americana pegada 3 23/2/13 7781640 274109 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual 1 8/5/13 7781037 267786 CINGULATA Dasypodidae Euphractus sexcinctus toca, visual 3 6/5/13 7781640 274109 CARNIVORA Procyonidae Procyon cancrivorus pegada 3 6/5/13 7781640 274109 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 3 7/5/13 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 3 7/5/13 7781640 274109 CINGULATA Dasypodidae Euphractus sexcinctus pegada, toca, carcaça 3 7/5/13 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 3 8/5/13 7781640 274109 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual 3 8/5/13 7781640 274109 CARNIVORA Canidae Chrysocyon brachyurus pegada 2 6/5/13 7783942 273643 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 104 Ponto Data Longitude Latitude Ordem Família Espécie Método 2 8/5/13 7783942 273643 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 9/5/13 7783942 273643 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 2 9/5/13 7783942 273643 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 2 9/5/13 7783942 273643 RODENTIA Caviidae Hydrochoerus hydrochaeris pegada, visual, fezes 2 9/5/13 7783942 273643 CARNIVORA Canidae Chrysocyon brachyurus pegada 1 22/7/13 7781037 267786 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 1 22/7/13 7781037 267786 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 23/7/13 7783942 273643 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 2 23/7/13 7783942 273643 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 2 23/7/13 7783942 273643 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 2 23/7/13 7783942 273643 RODENTIA Caviidae Hydrochoerus hydrochaeris pegada, visual, fezes, armadilha fotográfica 2 24/7/13 7783942 273643 CARNIVORA Canidae Cerdocyon thous pegada, visual, armadilha fotográfica 2 24/7/13 7783942 273643 CARNIVORA Procyonidae Nasua nasua pegada 2 25/7/13 7783942 273643 CARNIVORA Procyonidae Procyon cancrivorus pegada 3 25/7/13 7781640 274109 CARNIVORA Procyonidae Procyon cancrivorus pegada 3 25/7/13 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 3 25/7/13 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 3 26/7/13 7781640 274109 CARNIVORA Procyonidae Nasua nasua pegada 3 26/7/13 7781640 274109 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 4 26/7/13 7796529 267022 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 4 26/7/13 7796529 267022 CARNIVORA Canidae Cerdocyon thous pegada, visual 4 26/7/13 7796529 267022 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 4 26/7/13 7796529 267022 CARNIVORA Mustelidae Lontra longicaudis visual 1 15/10/13 7781037 267786 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 105 Ponto Data Longitude Latitude Ordem Família Espécie Método 1 15/10/13 7781037 267786 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 1 15/10/13 7781037 267786 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 16/10/13 7783942 273643 CARNIVORA Procyonidae Nasua nasua pegada 2 16/10/13 7783942 273643 CINGULATA Dasypodidae Priodontes maximus armadilha fotográfica 2 16/10/13 7783942 273643 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 2 16/10/13 7783942 273643 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 2 16/10/13 7783942 273643 RODENTIA Caviidae Hydrochoerus hydrochaeris pegada, visual, fezes 2 16/10/13 7783942 273643 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 16/10/13 7783942 273643 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 3 17/10/13 7781640 274109 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual 3 17/10/13 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 3 17/10/13 7781640 274109 CARNIVORA Canidae Chrysocyon brachyurus pegada, visual 3 17/10/13 7781640 274109 ARTIODACTYLA Cervidae Mazama americana pegada 3 17/10/13 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 4 18/10/13 7796529 267022 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual 4 18/10/13 7796529 267022 CARNIVORA Canidae Cerdocyon thous pegada, visual 4 18/10/13 7796529 267022 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 1 21/1/14 7781037 267786 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 1 21/1/14 7781037 267786 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 1 21/1/14 7781037 267786 PILOSA Myrmecophagidae Tamandua tetradactyla pegada 1 21/1/14 7781037 267786 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 22/1/14 7783942 273643 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 2 22/1/14 7783942 273643 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual, armadilha fotográfica 2 22/1/14 7783942 273643 CARNIVORA Canidae Cerdocyon thous pegada, visual 106 Ponto Data Longitude Latitude Ordem Família Espécie Método 2 22/1/14 7783942 273643 CARNIVORA Canidae Chrysocyon brachyurus pegada 2 22/1/14 7783942 273643 CARNIVORA Felidae Leopardus pardalis pegada 2 22/1/14 7783942 273643 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 2 22/1/14 7783942 273643 CARNIVORA Procyonidae Procyon cancrivorus pegada 3 23/1/14 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 3 23/1/14 7781640 274109 RODENTIA Caviidae Hydrochoerus hydrochaeris pegada, visual, fezes 3 23/1/14 7781640 274109 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 3 23/1/14 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 3 23/1/14 7781640 274109 CARNIVORA Procyonidae Procyon cancrivorus pegada 3 23/1/14 7781640 274109 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual, armadilha fotográfica 4 24/1/14 7796529 267022 CARNIVORA Mustelidae Eira barbara visual 4 24/1/14 7796529 267022 CARNIVORA Canidae Chrysocyon brachyurus pegada 1 8/4/2014 7781037 267786 PILOSA Myrmecophagidae Tamandua tetradactyla pegada 1 8/4/2014 7781037 267786 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 1 8/4/2014 7781037 267786 CARNIVORA Canidae Cerdocyon thous pegada, visual 1 8/4/2014 7781037 267786 CARNIVORA Felidae Puma concolor pegada 2 9/4/2014 7783942 273643 PILOSA Myrmecophagidae Tamandua tetradactyla pegada 2 9/4/2014 7783942 273643 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual, armadilha fotográfica 2 9/4/2014 7783942 273643 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 2 9/4/2014 7783942 273643 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 9/4/2014 7783942 273643 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 3 10/4/2014 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 3 10/4/2014 7781640 274109 CARNIVORA Canidae Chrysocyon brachyurus pegada 3 10/4/2014 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 107 Ponto Data Longitude Latitude Ordem Família Espécie Método 3 10/4/2014 7781640 274109 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 3 10/4/2014 7781640 274109 CARNIVORA Canidae Lycalopex vetulus pegada 3 10/4/2014 7781640 274109 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 4 11/4/2014 7796529 267022 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 4 11/4/2014 7796529 267022 CARNIVORA Canidae Cerdocyon thous pegada, visual 1 22/7/2014 7781037 267786 CARNIVORA Canidae Cerdocyon thous pegada, visual 1 22/7/2014 7781037 267786 CINGULATA Dasypodidae Euphractus sexcinctus pegada, toca 1 22/7/2014 7781037 267786 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 1 22/7/2014 7781037 267786 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual 2 23/7/2014 7783942 273643 CARNIVORA Felidae Puma concolor pegada 2 23/7/2014 7783942 273643 RODENTIA Caviidae Dasyprocta azarae pegada, visual 2 23/7/2014 7783942 273643 CARNIVORA Canidae Cerdocyon thous pegada, visual 2 23/7/2014 7783942 273643 CINGULATA Dasypodidae Euphractus sexcinctus pegada, toca 2 23/7/2014 7783942 273643 CARNIVORA Procyonidae Procyon cancrivorus pegada 2 23/7/2014 7783942 273643 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 2 23/7/2014 7783942 273643 PILOSA Myrmecophagidae Tamandua tetradactyla pegada 3 24/7/2014 7781640 274109 CARNIVORA Canidae Lycalopex vetulus pegada 3 24/7/2014 7781640 274109 PILOSA Myrmecophagidae Tamandua tetradactyla pegada 3 24/7/2014 7781640 274109 PILOSA Myrmecophagidae Myrmecophaga tridactyla pegada, visual 3 24/7/2014 7781640 274109 CARNIVORA Canidae Chrysocyon brachyurus pegada 3 24/7/2014 7781640 274109 ARTIODACTYLA Tayassuidae Tayassu tajacu pegada 3 24/7/2014 7781640 274109 ARTIODACTYLA Cervidae Mazama gouazoubira pegada 3 24/7/2014 7781640 274109 CARNIVORA Canidae Cerdocyon thous pegada, visual 3 24/7/2014 7781640 274109 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 108 Ponto Data Longitude Latitude Ordem Família Espécie Método 3 24/7/2014 7781640 274109 CINGULATA Dasypodidae Priodontes maximus visual 4 25/7/2014 7796529 267022 CINGULATA Dasypodidae Euphractus sexcinctus pegada, toca 4 25/7/2014 7796529 267022 CARNIVORA Canidae Cerdocyon thous pegada, visual 4 25/7/2014 7796529 267022 CARNIVORA Canidae Cerdocyon thous pegada, visual 4 25/7/2014 7796529 267022 CARNIVORA Mustelidae Eira barbara visual 4 25/7/2014 7796529 267022 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual 4 25/7/2014 7796529 267022 PERISSODACTYLA Tapiridae Tapirus terrestris pegada, visual Quadro 03 - Dados brutos das espécies de pequenos mamíferos não voadores registradas nas áreas de influência da UHE São Domingos, município de Água Clara, MS, durante as sete campanhas da fase de pós-enchimento. Campanha Data Ponto Espécie Marcação Sexo Peso (g) Cauda (mm) 1 (L.O.) 25/02/2013 2 Gracilinanus agilis 001 M 16 119 Comp. do corpo (mm) 92 Orelha (mm) Pé (mm) Faixa Etária 18 13 Jovem Condição reproduti va Jovem 2 (L.O.) 09/05/2013 1 Gracilinanus agilis 002 M 13 117 90 18 12 Jovem Jovem 3 (L.O.) 24/07/2013 1 Gracilinanus agilis 9 M 20 120 95 19 14 Adulto 3 (L.O.) 26/07/2013 2 Gracilinanus agilis 10 M 22 3 (L.O.) 26/07/2013 3 Micoureus constantiae 11 M 70 120 94 19 14 186 140 22 15 4 (L.O.) 18/10/2013 1 Olygoryzomys fornesi 12 F 17 117 90 18 14 Recaptura Coletado não não não não ativo não não Adulto ativo não não Adulto ativo não não Adulto _ não não 109 ANEXO III Cópia da Licença de Coleta Captura e Transporte de Animais Silvestres 110 111 112 113 ANEXO IV Cópia da Carta de Aceite de Depósito de Material Biológico 114 115 ANEXO V Anotações de Responsabilidade Técnica 116