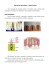A-Space PEEK, CeSpace PEEK, ProSpace PEEK, T
Transcrição
A-Space PEEK, CeSpace PEEK, ProSpace PEEK, T
Família de Implantes Não Absorvíveis para Coluna Nome técnico: Implante para coluna Nome Comercial: Família de Implantes Não Absorvíveis para Coluna Modelo: T-Space Peek ESTÉRIL – ESTERILIZADO POR RADIAÇÃO GAMA PRODUTO DE USO ÚNICO – PROIBIDO REPROCESSAR Descrição do Produto O T-Space foi desenhado para adequar-se às exigências de técnicas cirúrgicas minimamente Largura Comprimento invasiva utilizando a abordagem foraminal. Angulo Altura Família de Implantes Não Absorvíveis para Coluna O T-Space possui um ângulo de lordose de 5° e é oferecido em 3 comprimentos: 26mm, 30mm e 34mm. Ele abrange alturas de 7,46mm a 17,46mm, em peças de 2mm em 2mm. A estabilidade primária é obtida através da superfície dentada. Em combinação com uma fixação posterior como o Sistema Espinhal S, uma estabilidade imediata do segmento de movimentação é garantida. Seu formato garante uma maior área de contato entre a vértebra e o implante, e ainda sendo fino o suficiente para ser inserido no forâmen. Uma superfície dentada oferece uma estabilidade primária para evitar migrações em qualquer direção. Dimensões Modelos FJ687P FJ688P FJ689P FJ690P FJ691P FJ692P FJ693P FJ694P FJ695P FJ696P FJ697P FJ317P FJ318P FJ319P Comprimento [mm] 26 26 26 26 26 26 26 26 26 26 26 30 30 30 Largura [mm] Altura [mm] Ângulo [°] 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 11,5 7,46 8,46 9,46 10,46 11,46 12,46 13,46 14,46 15,46 16,46 17,46 7,46 8,46 9,46 5° 5° 5° 5° 5° 5° 5° 5° 5° 5° 5° 5° 5° 5° Família de Implantes Não Absorvíveis para Coluna FJ320P FJ321P FJ322P FJ323P FJ324P FJ325P FJ326P FJ327P FJ707P FJ708P FJ709P FJ720P FJ721P FJ722P FJ723P FJ724P FJ725P FJ726P FJ727P 30 11,5 10,46 5° 30 11,5 11,46 5° 30 11,5 12,46 5° 30 11,5 13,46 5° 30 11,5 14,46 5° 30 11,5 15,46 5° 30 11,5 16,46 5° 30 11,5 17,46 5° 34 11,5 7,46 5° 34 11,5 8,46 5° 34 11,5 9,46 5° 34 11,5 10,46 5° 34 11,5 11,46 5° 34 11,5 12,46 5° 34 11,5 13,46 5° 34 11,5 14,46 5° 34 11,5 15,46 5° 34 11,5 16,46 5° 34 11,5 17,46 5° * Todas as Dimensões estão relacionadas a tolerâncias diferentes. O material usado é o PEEK-OPTIMA biocompatível, que foi introduzido pela Invibio em 1999. PEEK significa PolyEtherEtherKetone. O PEEK-OPTIMA é fabricado sob condições rigorosas para pureza e aderência estrita as diretrizes de qualidade, e é certificado pelo FDA para uso como material de implante médico. O uso do PEEK-OPTIMA como um material de dispositivo ortopédico tem obtido uma popularidade crescente nos últimos anos devida à combinação de características única do material. Suas propriedades incluem radiolucência, alta força mecânica, biocompatibilidade e compatibilidade com métodos de esterilização padrões. A transparência radioscópica intrínseca do material proporciona sua permeabilidade nos raios-X e tomografias computadorizadas, sendo possível visualizar o crescimento do osso adjacente ao implante. Isto permite uma avaliação rápida e simples da estrutura do osso e um progresso em direção à fusão do osso. Investigações extensas na biocompatibilidade do PEEK-OPTIMA provaram que o material é adequado para uso como implante de longa-duração. Família de Implantes Não Absorvíveis para Coluna Indicações Os implantes colocados por via cirúrgica destinam-se a ajudar os processos normais de recuperação. Eles não se destinam a substituir estrutura normais do corpo nem, no caso de falta de recuperação, a suportar duradouramente os esforços que incidem sobre a parte afetada do corpo. Utilizar no caso de: Instabilidades degenerativas Espondilolisteses Síndrome de pós-discectomia Instabilidades pós-traumáticas Finalidades T-Space de Peek tem como finalidade, estabilizar a coluna lombar e torácica de forma monossegmental e multissegmental através de acesso transforaminal. Contra indicação Na presença das seguintes contra-indicações, deve prescindir-se de uma operação: Infecções agudas ou crônicas ou defeitos graves das estruturas ósseas das vértebras, como condição imprescindível para uma implantação estável dos implantes PEEK Tumores ósseos na zona da fixação do implante Doentes que não estão dispostos ou capazes de seguir as instruções relativas ao tratamento pós-operatório Estados clínicos ou cirúrgicos que possam impedir o êxito potencial dos implantes Gravidez Osteosporose ou outros tipos de perda de tecido ósseo Doenças sistêmicas ou metabólicas Abuso de drogas ou álcool Doente com estado de saúde geralmente debilitado Obesidade Problemas psico-sociais Falta de colaboração por parte do doente Os casos não mencionados nas indicações Família de Implantes Não Absorvíveis para Coluna Em caso de evento adverso, favor comunicar a Aesculap e seus representantes e a autoridade sanitária competente. No sítio da ANVISA na internet é possível notificar a ocorrência de evento adverso via Sistema Nacional de Notificações para a Vigilância Sanitária – NOTIVISA que pode ser acessado diretamente no seguinte endereço eletrônico: http://www.anvisa.gov.br/hotsite/notivisa/index.htm . Riscos Os potencias riscos associados a uma cirurgia são: Complicações neurológicas em conseqüência de distração excessiva ou traumatização das raízes nervosas ou da dura-máter Altura diminuída dos discos intervertebrais devido a ressecção de material ósseo saudável Complicações que possam ocorrer geralmente em associação com cirurgias intervertebrais: Pseudartrose Posicionamento errado do implante Deslize vertebral Afrouxamento de componentes, deslocação e migração Efeitos secundários e interações Desconhecidos. Indicações de segurança O cirurgião assume a responsabilidade pela execução correta da intervenção cirúrgica. Os riscos gerais associadas a um intervenção cirúrgica não estão descritos nestas instruções de utilização. O cirurgião deverá dominar, tanto na teoria como na prática, as técnicas reconhecidas de operação. O cirurgião tem de estar absolutamente familiarizado com a anatomia dos ossos, com o percurso dos nervos e dos vasos sanguíneos, assim como dos músculos e dos tendões. A Aesculap não se responsabiliza por complicações devidas a uma indicação errada, uma escolha de implante inadequado, por uma combinação errada dos componentes do implante com a técnica cirúrgica, por limites que possam vir a impor-se aos métodos de tratamento ou por ausência de assepsia. As instruções de utilização dos respectivos componentes do implante Aesculap terão que ser observadas. Só podem ser combinados entre si os componentes dos implantes modulares da Aesculap. Família de Implantes Não Absorvíveis para Coluna É proibido utilizar componentes de implante danificados ou removidos por via cirúrgica. Os implantes que já tenham sido utilizados uma vez não podem ser reutilizados. No caso de a recuperação se encontrar atrasada, pode ocorrer uma quebra do implante devido a fadiga do material. No relatório do doente deverão ser registrados os componentes utilizados no implante, indicando-se o respectivo número de artigo, a designação do implante, bem como os números de lote e, se necessário, de série. Na fase pós-operatória, para além do exercício de recuperação da força. muscular e da mobilidade, há que se prestar especial atenção à informação individual do doente. Antes da utilização da presente instrução de uso, observe a sua versão, e somente a utilize se estiver de acordo com o informado no rótulo do produto. A presente instrução de uso, em formato impresso, pode ser obtida, sem custo adicional, através de solicitação ao SAC dos Laboratórios B. Braun S.A. Instrução de uso elaborada em conformidade com a Instrução Normativa DC/ANVISA Nº 4 DE 15/06/2012. Necessário computador com aplicativo adequado à leitura de arquivos “.pdf” instalado. Esterilidade Os componentes do implante são embalados individualmente em embalagens protegidas e etiquetadas. Os componentes para implantes são esterilizados com radiação (dose mínima de 25 kGy). Guardar os componentes do implante na embalagem original e tirá-los da embalagem original ou da embalagem protetora apenas pouco antes de serem usados. Verificar a data de validade e a integridade da embalagem esterilizada. Não utilizar os componentes do implante depois de expirada a data de validade ou no caso de a embalagem estar danificada. É proibido re-esterilizar os implantes fornecidos esterilizados. Não contendo estas instruções quaisquer informações explícitas a reste respeito, o utilizador do produto assume a responsabilidade por uma re-esterilização. Perigo para o doente e afetação da função do implante no caso de re-esterilização! Nunca re-esterilizar nem reutilizar os implantes PEEK. Nunca re-esterilizar implantes usados, removidos por via cirúrgica ou danificados. Família de Implantes Não Absorvíveis para Coluna Esterilidade Todos os implantes são entregues esterilizados. Informação sobre a esterilização Gamma: Método: Companhia esterilizadora: Validade: Dosagem: Irradiação Gamma BBF Sterilizations service GmbH, Kernen De acordo com EN 552, ISO 11137 ≥ 25 kGy Descrição de empacotamento Os implantes de espinha dorsal T-SPACE de PEEK são embalados em condições estéreis. - A embalagem de armazenamento é uma caixa dobrada feita de papelão. Para cada empacotamento primário e secundário um blíster transparente feito de PETG será usada para lacrar que são selados por tampas de TYVEK. Para etiquetar rótulos individuais com dados do produto é usado em secundário e empacotamento de armazenamento. Este empacotamento é prático para irradiação de gama. Embalagem Todos os implantes são embalados separadamente. Se a embalagem estéril vier danificada, rasgada ou perfurada, o implante deve ser considerado não-estéril. Veja as especificações de embalagem e informações sobre os materiais das embalagens : Exemplo de Embalagem primária Exemplo de Embalagem secundária Família de Implantes Não Absorvíveis para Coluna Pacote primário: Blister termo formado Tampa de TYVEK PETG 84 x 59 x 28 milímetros Espessura 0.5 milímetros (1x) HD-PE 84 x 59 milímetros Espessura 0.25 milímetros (1x) Pacote secundário: Blister termo formado PETG 100 x 75 x 26 milímetros Espessura 0.5 milímetros (1x) Tampa de TYVEK HD-PE 100 x 75 milímetros Espessura 0.25 milímetros (1x) Pacote do armazenamento: Caixa dobrável Peças etiquetadas: Etiqueta do produto Etiquetas pacientes Rótulo do fechamento (pacote de armazenamento) Instruções para o uso papelão Adesivo de papel Adesivo de papel Filme PE adesivo papel 105 x 75 x 30 milímetros (1x) 92 x 62 milímetros 85 x 60 milímetros 60 x 20 milímetros 70 x 100 milímetros (2x) (1x) (1x) (1x) Método de Estocagem Os produtos esterilizados são armazenados na loja final do produto sob condições de estocagem definidas. Para evitar que os produtos esterilizados sejam misturados com produtos não-estéreis, as cores das caixas de estocagem são diferentes. Um livreto de logística especial existe onde procedimentos relevantes são fixos. Declaração de Expiração: O prazo de validade é impresso nos rótulos. Um dos pré-requisitos é que a embalagem não esteja danificada. Guardar os componentes do implante na embalagem original e tirá-los da embalagem original ou da embalagem protetora apenas pouco antes de serem usados. Família de Implantes Não Absorvíveis para Coluna Verificar a data de validade e a integridade da embalagem esterilizada. Não utilizar os componentes do implante depois de expirada a data de validade ou no caso de a embalagem estar danificada. Armazenamento e Transporte: O produto deve ser mantido em local seco e arejado. O produto é acondicionado em embalagem própria para transporte, oferecendo o máximo de segurança quanto a sua integridade. O produto deve ser conservado na sua embalagem original até o momento do uso. Não utilize se a embalagem estiver danificada, rasgada ou perfurada, pois o implante será considerado não estéril. Condições especiais de armazenamento Manejar e estocar os componentes dos implantes com cuidado. Quedas, cortes, dobras ou arranhões ou na superfície podem diminuir significativamente a força e a resistência dos implantes. Isto pode se manifestar em pequenas rachaduras e defeitos não visíveis que podem levar a uma fratura dos implantes. Os implantes e instrumentos estocados devem ser protegidos de ambientes corrosivos como ar salgado, umidade, etc. Inspeção e experimentação são recomendados previamente à cirurgia para verificar se os instrumentos e implantes foram danificados durante o armazenamento ou outros procedimentos anteriores. Descarte Os implantes que apresentarem defeitos, ou implantes que tenham sido utilizados devem ser descartados de acordo com as normas hospitalares de descarte, obedecendo ao critério de produtos potencialmente perigosos. Os implantes não podem ser reutilizados. Identificação e Rastreabilidade Família de Implantes Não Absorvíveis para Coluna Todos os produtos são devidamente identificados através de laser, onde receberão a identificação do tamanho e o número de série seqüencial que identifica o produto. Através deste número de série é possível conhecer todo histórico do produto, desde a procedência da matéria prima utilizada até sua distribuição. AESCULAP recomenda que o paciente seja depositário desta informação, recebendo um atestado com a fixação de uma das etiquetas adesivas. As informações sobre instruções e identificação do produto (empresa, código do modelo, número de lote, registro na ANVISA) devem ser escritas ou anexadas ao prontuário dos pacientes bem como entregues por escrito aos mesmos. É responsabilidade da equipe médica e do hospital (os depositários das informações e prontuários do paciente) a fixação da etiqueta na folha de descrição da cirurgia ou seção do prontuário médico, como tratado anteriormente. Modelo da etiqueta que acompanha os produtos, para ser fixada no prontuário do paciente, para o controle da rastreabilidade do mesmo. Família de Implantes Não Absorvíveis para Coluna Modo de usar O cirurgião elaborará um plano da operação no âmbito do qual determinará e documentará devidamente o seguinte: Escolha e dimensionamento dos componentes do implante Posicionamento dos componentes no osso Determinação dos pontos de orientação intra-operatórios Antes da utilização, há que se satisfazer os seguintes pressupostos: Todos os componentes necessários do implante estão disponíveis Presença de condições de operação altamente assépticas Os instrumentos de implantação, incluindo os instrumentos para sistemas de implantação especiais da Aesculap, estão completos e em boas condições para serem utilizados O cirurgião e a equipa operatória conhecem as informações necessárias à técnica de operação, ao jogo de implantes e instrumentos; estas informações estão completamente disponíveis no local As regras da arte médica, os últimos avanços da ciência e os conteúdos das respectivas publicações científicas, redigidas pelos autores médicos, são do conhecimento geral Foram solicitadas ao fabricante as informações necessárias ao esclarecimento de uma possível situação pré-operatória incerta ou no caso de existirem implantes na zona a tratar. O doente foi informado sobre a intervenção, tendo-se documentado o seu consentimento relativamente às seguintes informações: No caso de a fusão se encontrar atrasada ou não se realizar, os implantes podem quebrar e relaxar em virtude dos esforços altos que atuam sobre os implantes. A durabilidade do implante depende do peso do corpo. No caso de relaxamento do implante, pode tornar-se necessária uma operação de revisão. O doente, após a intervenção, terá que se submeter periodicamente a um controle médico dos componentes do implante. Elevado risco de migração no caso de preparação demasiado forte das placas terminais do corpo vertebral Quando da preparação da cama do implante, assegurar que as placas de base e de cobertura das vértebras adjacentes não são debilitadas. Escolher o tamanho adequado para o implante PEEK com base na indicação , no plano pré-operatório e segundo as condições ósseas que se apresentam durante a intervenção. Usar instrumentos próprios para a preparação da cama do implante rigorosas, curetas e cinzel, bem como os instrumentos de implantação corretamente. Introduzir o implante com cuidado. Família de Implantes Não Absorvíveis para Coluna Verificar a altura do angulo do implante com a ajuda dos implantes de ensaio. Danificação da rosca do implante. Ao introduzir o implante no instrumento introdutor, prestar atenção ao eixo rosqueado. Introduzir o implante até ao encosto, de forma a que as duas faces do instrumento assentem na ranhadura do implante. Seleção do Implante O implante deverá ser selecionado de acordo com a técnica utilizada e necessidade do paciente, onde é levado em consideração o tipo de patologia e local onde será implantado. Instruções de Uso O procedimento operatório deve ser realizado por um cirurgião médico especializado, com conhecimento detalhado de técnica cirúrgica da coluna vertebral. Antes da cirurgia é indispensável realizar Rx, CTs, etc., a fim de determinar com exatidão a posição correta do implante. Geralmente o tamanho do implante não pode ser determinado previamente, e sim durante a operação. Os implantes T-ESPACE PEEK somente devem ser implantados com a ajuda do Instrumental específico para tal. Material auxiliar sugerido: MODELOS DESCRIÇÃO RECOMENDADO FJ 646 R Alça T para distratores 1 FJ 647 R FJ 649 R FJ 651 R FJ 653 R FJ 655 R FJ 657 R FJ 051 R FJ 052 R Distrator 7 mm Distrator 9 mm Distrator 11 mm Distrator 13 mm Distrator 15 mm Distrator 17 mm T-Space retrator S T-Space retrator M 1 1 1 1 1 1 OPCIONAL 1 1 Família de Implantes Não Absorvíveis para Coluna FJ 053 R FJ 054 R FJ 658 R FJ 679 R FJ 680 R FJ 681 R FJ 682 R FJ 683 R FJ 685 R FJ 686 R FJ 666 R FJ 667 R FJ 669 R FJ 671 R FJ 673 R FJ 675 R FJ 677 R FJ 660 R FJ 661 R FJ 662 R FJ 663 R FJ 664 R FF 913 R T-Space retrator L T-Space retrator XL Straight osteotome 8 mm 1 Cureta de Angulo esquerdo para osso 1 Cureta de ângulo direito para osso 1 Caixa de cureta 1 Cureta de ângulo esquerdo 1 Cureta de ângulo direito 1 Raspador de osso de ângulo esquerdo 1 Raspador de osso de ângulo direito 1 Inserto para teste 1 T-Space para teste 7mm 1 T-Space para teste 9mm 1 T-Space para teste 11mm 1 T-Space para teste 13mm 1 T-Space para teste 15mm 1 T-Space para teste 17mm 1 T-Space instrumento de inserção 1 T-Space guia de inserção 1 T-Space impactador reto 1 T-Space impactador angulado 1 T-space PEEK bloco empacotado 1 Tampa 3mm 1 Bandeja para preparação de FJ 641 P 1 instrumental Bandeja para preparação de FJ 642 P 1 instrumental OBS: Os materiais de auxílio descrito na tabela acima são objeto de registro a parte. 1 1 Requisitos essenciais de segurança e eficácia de produtos médicos Os componentes do Implante T-space de PEEK para estabilizar a coluna são fabricados com material atóxico e não inflamável, perfeitamente biocompatível com os tecidos e fluidos corporais a que são expostos. Este produto completou com sucesso a série de testes requeridos pela norma ISO EN 13485:2003 para assegurar a biocompatibilidade de implantes médicos. Seu processo de fabricação utilizando técnicas assépticas assegura um produto livre de contaminação microbiana, e sua embalagem não reutilizável mantém o produto estéril até o Família de Implantes Não Absorvíveis para Coluna momento de sua abertura. O produto é fornecido estéril. Encontram-se na embalagem todas as informações necessárias para a perfeita identificação do produto, bem como a indicação da esterilidade do mesmo. Devido sua apresentação em vários tamanhos, evita-se o risco de implantação de um produto com dimensões não adequadas para a finalidade a que se dispõe. O Implante T-space de PEEK para estabilizar a coluna, enquadrado na Regra 8, Classe de Risco III, apresenta os seguintes Fatores de Risco aplicáveis a ele, cujos Requisitos Essenciais de Segurança e Eficácia correspondentes descritos na Resolução - RDC nº 56 de 06/04/2001, são atendidos conforme segue: Fator 1 - Toxidade - O material que o compõe não é tóxico, nem inflamável. Fator 3 - Incompatibilidade biológica - O material utilizado na fabricação dos componentes é perfeitamente compatível com os tecidos e fluidos corporais a que é exposto, e normalmente aceitável no corpo quando implantado, com um baixo índice de rejeição. Fator 4 - Contaminantes residuais - Este item não se aplica, pois nenhum componente do implante desprende qualquer tipo de resíduo, ou substância até o momento do implante. O desprendimento de fluídos corpóreos, que poderiam ser considerados substâncias contaminantes, devido a uma eventual retirada do implante é um evento raro, pois tal retirada somente ocorreria caso houvesse algum tipo de rejeição pelo organismo ou numa eventual cirurgia de revisão. As instruções de Uso informam os procedimentos pertinentes à um implante retirado do paciente. Fator 6 - Infecção e contaminação microbiana - O processo de fabricação dos componentes do Implante para fusão óssea prevê a minimização do risco de infecção e contaminação microbiana em todo seu processo, desde o recebimento da matéria-prima até a estocagem e transporte. As embalagens estéreis garantem a integridade do produto até o momento de sua abertura. Tais embalagens não são re-utilizáveis, e a empresa utiliza um método de esterilização validado; a esterilização por radiação de feixes radiológicos Gama, que está de acordo com normas e padrões internacionais de segurança (ISO 9001 revisão 2000, EN ISSO 13488, EN 552:1994 11137:1995(E)). A embalagem apresenta o rótulo que distingue a esterilidade do produto. Fator 8 - Instabilidade e limitações de características físicas e ergonômicas - Não há qualquer risco de lesão vinculado às características físicas dos componentes do sistema, nem para o médico, nem para o paciente, desde que utilizados conforme as Instruções do Fabricante. Técnica cirúrgica Posicionamento do paciente e marcação da incisão Família de Implantes Não Absorvíveis para Coluna Uma aproximação minimamente invasiva exige do paciente estar deitado em uma mesa radiolucente que permita visualizações AP das várias estruturas anatômicas. Utilize as imagens do braço em C para determinar a posição apropriada da incisão longitudinal (4-5cm de comprimento). A incisão na pele pretendida é marcada paralelamente à espinha dorsal na direita e respectivamente na esquerda. Incisão, exposição e dissecção dos músculos paralelos à espinha. Uma pequena incisão em linha arcada, a 1,5 cm da linha média, vista da perspectiva do cirurgião. Isto garante uma fixação firme do espéculo e do contra retrator, facilitando a exposição do segmento individual. Após a divisão da fáscia toracolumbar (?), uma dissecção dos músculos paralelos à espinha é feita com a ponta dos dedos. A profunda situação anatômica é palpada com o dedo. A orientação da posição, então, é obtida. De acordo com a descoberta através do toque, uma correção da incisão da pele é ainda possível, já que o retrator do músculo deve ser introduzido o mais verticalmente possível e na diração do espaço interlaminar. Ao mesmo tempo, a distância entre a superfície da pele e a borda superior do arco é determinada utilizando o dedo indicador e o polegar, para que um tamanho de retrator muscular adequado possa ser escolhido. O retrator de músculo apropriado é introduzido. Nota: Se a incisão fascial for muito longa, a firmeza do retrator e a exposição constante do local de operação não serão mais seguros. Como regra, a incisão na pele deve ser levemente maior que a incisão fascial para garantir uma firmeza do retrator e para evitar danos à pele devido à extraextensão. O retrator de músculo é introduzido com as lâminas fechadas, com o cabo colocado em posição longitudinal ao corpo. Então, é virado a 90° no sentido horário com o cabo em direção ao assistente e, após isso, expandido para que o local da operação fique visível. Uma representação esquemática do retrator de músculo introduzido em uma secção horizontal no nível do espaço intervertebral. A musculatura é Família de Implantes Não Absorvíveis para Coluna empurrada pela largura da lâmina retratora, em torno de 18 mm, com sua irrigação de nervos e veias ficando praticamente intocada. Remição da Junta da Face Na maioria dos casos, uma facetectomia unilateral completa deve ser considerada para a inserção de um implante. Para apressar o procedimento, resseccione o processo articular inferior da vértebra mais proximal do nível do pedículo. Então, resseccione o processo articular superior do nível mais inferior. Incisão do disco e remoção do material do disco.Usando um bisturi, corte uma pequena janela no anel. Remova o anel cortado usando um rongeur. Osteófitos posteriores são geralmente mais facilmente removidos usando um rongeur Kerrison. Distração Para alcançar a distração desejada, vários tamanhos de distratores T-Space estão disponíveis e devem ser usados com cuidado para evitar acidentes. Distraia o espaço do disco inserindo o distrator horizontalmente para medir a profundidade de colocação e então rotacionando 90 graus. Liberação do espaço invertebral e preparação da placa final. Família de Implantes Não Absorvíveis para Coluna Primeiramente utilize as curetas de osso oferecidas para completar a remoção do disco e da placa final cartilaginosa. As curetas retas e anguladas são oferecidas para acessar todo o espaço do disco por uma aproximação unilateral. Curetas adicionais podem ser usadas para dissectomias. Então use raspadores para resseccionar completamente as placas finais cartilaginosas e expor o osso. Muito cuidado deve ser exercido para preservar a placa final óssea. Determinando o tamanho do implante utilizando implantes de teste. Usando o martelo, insira o T-Space de teste no espaço do disco que é equivalente em tamanho ao nível da distração. Quando o tamanho é apropriado, o implante de teste exigirá uma impactação para alcançar o maior aspecto anterior do espaço invertebral onde o implante permanecerá. Inserção com ajuda do insertor Posicione o Guia de Inserção T-Space seguramente no espaço do disco para assegurar a colocação final correta do implante. Antes de inserir o implante PEEK ele deve estar cheio do osso obtido da ressecção da junta da face. Materiais biológicos alternativos, como Tricalciofosfato, podem ser usados (obs. não é objeto deste registro ). Insira parcialmente o implante T-Space no espaço do disco usando o insersor de implante. Posição final do implante com o impactador Impacte o implante usando um martelo padrão e o impactador até que uma rotação de 90° seja atingida. Família de Implantes Não Absorvíveis para Coluna Posicção final do implante então é verificada por raio X Coloque o enxerto de osso no implante T-Space! Aplicação da haste e do parafuso Insira as hastes nas tulipas dos parafusos seguidos pelos parafusos S4. Aplique compressão nos parafusos para minimizar os espaços entre o implante T-Space e o espaço de disco. Então aperte os parafusos S4 usando a técnica padrão como descrita na Tecnica Cirurgica S4. Finalmente, remova as abas dos parafusos S4. Agora, aplique o Sistema Espinhal S4 no lado contra-lateral. Fabricado por: AESCULAP AG Am Aesculap-Platz D – 78532 Tuttlingen / Germany Importado e Distribuído por: Laboratórios B. Braun S/A Av. Eugênio Borges, 1092 São Gonçalo – RJ Cep 24751-000 CNPJ: 31.673.254/0001-02 Resp. Téc.: Rosane Gonçalves Ramos da Costa CRF/RJ: nº 3213 Registro ANVISA nº 80136990550 CNPJ: 31.673.254/0001-02 Família de Implantes Não Absorvíveis para Coluna Indústria Brasileira SAC: 0800-0227286 4.008. 045 12.15