Artigo - Hestia
Transcrição
Artigo - Hestia
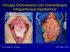
Vol. 1, No. 1, Outubro-Dezembro de 2011 ARTIGO ORIGINAL BIOCOMPATIBILIDADE IN VIVO DO BR3G: VITROCERÂMICO COM CRISTAIS DE ANORTITA (CaAl2Si2O8) Karla Regina Pereira¹, Etney Neves2,3, Carlos Alberto Fortulan4, João M. D. de A. Rollo4 1 Departamento Engenharia Mecânica, Universidade de São Paulo, Rua Dr. Emílio Ribas, 1121, Araraquara (SP), CEP 14806-055. 2 Professor Visitante do Departamento de Engenharia de Alimentos, UNEMAT.- Universidade do Estado de Mato Grosso, Campus Barra do Bugres - MT. 3 Pesquisador Associado a Associação Nacional Instituto Hestia de Ciência e Tecnologia, HESTIA.Brasil. 4 Departamento de Engenharia Mecânica, Universidade de São Paulo, Av. Trabalhador Sãocarlense, 400 São Carlos (SP), CEP 13560 -000. Resumo Este trabalho avaliou a toxicidade sistêmica dos extratos produzidos através do material em teste: vitrocerâmico (de base anortita). A análise pôde verificar o funcionamento biológico/sistêmico das cobaias, onde não foi observada toxicidade local ou sistêmica do material em teste. Os resultados obtidos indicam a possibilidade do material ser biocompatível, viabilizando a sua aplicação como um biomaterial. Palavras-chaves: toxicidade sistêmica, biocompatibilidade, vitrocerâmico. 1. Introdução O vitrocerâmico com cristais de anortita como fase principal foi a base experimental para produção e divulgação do artigo “Materiais Vitrocerâmicos Inteligentes”.1 Esse material foi obtido para testes e estudado anteriormente, através da cristalização controlada de um vidro.2,3,4 Os estudos de degradação desta nanoestrutura cerâmica revelou uma potencialidade do uso do material para fins biomédicos.5 Outras possibilidades tecnológicas vêm sendo também discutidas: revestimentos cerâmicos (pisos), placas para fabricação de pias e balcões, material para fabricação de componentes especiais para indústria têxtil entre outros e uma possível aplicação como uma base adequada para produção de lentes especiais. Muitas das aplicações citadas são alvos de testes iniciais, em outras palavras, esta cerâmica vem apresentando versatilidade e bons resultados em testes tecnológicos (industriais). Mas no que se refere e-mail: [email protected] Vol. 1, No. 1, outubro-dezembro 2011, Página 10 ao uso biomédico, foram realizados testes toxicológicos in vitro em amostra deste vitrocerâmico, a conclusão dessa avaliação foi uma “reatividade citotóxica não detectada” possibilitando a o material cerâmico ser considerado biocompatível.6 Os estudos iniciais com cobaias reforçaram os experimentos in vitro, apresentando resultados favoráveis à continuação dos estudos.7,8,9,10 Em 2006 foi desenvolvida uma versão sintética de elevada pureza do material vitrocerâmico. 1,11,12,13 Desta forma, esta vitrocerâmica é considerada mais adequada para possíveis aplicações biomédicas. Dentre os estudos de biocompatibilidade, insere-se a toxicidade sistêmica, a qual é analisada através dos possíveis efeitos dos componentes químicos liberados por um material, que podem vir interagir com o organismo vivo, desestabilizando ou não o funcionamento sistêmico geral ou de certos órgãos-vitais (fígado, cérebro, intestino, rins), que podem estar distante do local de contato. O teste de toxicidade sistêmica aguda é determinado pelas normas ISO 1099314 11 , compreende no efeito adverso, com curta observação de tempo, originado após a administração de uma dose única. Os resultados do teste estendem-se a uma observação, do comportamento dos animais, em intervalos pré-determinados contados a partir de aplicação única. Para o teste de toxicidade sistêmica, pode se utilizar extratos de aplicação como: salina fisiológica, saliva artificial 15 e óleos vegetais com adições do material em teste. A interpretação desses resultados baseia-se nas diferenças apresentadas entre os grupos de testes e os controles. Neste trabalho, a via de administração escolhida para aplicação foi a via intraperitoneal, devido a importância anato-fisiológica da cavidade e do líquido peritoneal. Essa região é muito vascularizada e liga-se ao sistema fisiológico (ao qual está localizada) como um todo. Os ensaios in vivo toxicidade sistêmica seguem a ISO 10993-11 Tests for systemic toxicity. 14 2. Materiais e Métodos O veículo de extração utilizado foi saliva artificial fórmula de Fusayama conforme demonstra a Tabela 1. Para a confecção dos extratos seguiu-se a norma ISO 10993-11 Tests for systemic toxicity, onde para cada 20 mL de veículo de extração usa-se 2-4 g de material. Esse experimento tem a intenção de demonstrar o comportamento do material, quando em contato direto a um fluido biológico. A saliva artificial foi filtrada em filtros puradisc dentro da capela de fluxo laminar. Após filtrar a saliva artificial, adicionou-se à mesma, as amostras do material em teste (também estéreis). Os frascos contendo os veículos com e sem as amostras do material foram condicionados a 37 °C (± 2 °C) por 72 horas (± 2 h). Esse procedimento também foi realizado dentro da capela de fluxo laminar. Dividiu-se as amostras em 4 frascos estéreis, identificados na Tabela 2 abaixo: Vol. 1, No. 1, outubro-dezembro 2011, Página 11 Para o teste foram utilizados 20 ratos - Wistar com peso médio de 250 g, divididos em 4 grupos, sendo cada grupo com 5 animais. Os animais foram condicionados em gaiolas próprias, com alimentação e água ad libitum. Este teste avaliou sistemicamente a resposta do organismo dos animais frente ao extrato do material em teste e dos controles. Cada grupo específico entrou em contato com o inóculo demonstrado na Tabela 2 acima. Após separação dos animais em grupos, realizou-se tricotomia abdominal e identificação em todos os animais. Foi realizada a primeira pesagem, os animais foram pesados também nos momentos 24, 48 e 72 horas pós inoculação. Concluída a tricotomia e pesagem deu-se início a inoculação intraperitoneal dos extratos nos animais. A inoculação foi feita através de uma injeção na região da linha média abdominal (Figura 1). A dose de aplicação foi de 50 mL/Kg de peso corpóreo do animal. Os animais foram observados a partir do momento de inoculação dos extratos, no momento 0, 24, 48 e 72 horas. As reações são avaliadas segundo Tabela 3 a seguir: Vol. 1, No. 1, outubro-dezembro 2011, Página 12 Figura 1. Aplicação dos extratos na linha média abdominal (intraperitoneal) do rato. Todos os resultados obtidos através das reações que os animais tiveram após inoculação dos extratos em teste (período de 72 horas) foram anotados e comparados aos controles. Finalizado o período de observação de 72 horas, foi realizada a última pesagem, cada animal individualmente foi sedado e anestesiado. Confirmado o estado de anestesia do animal, usando um bisturi de lâmina, foi feita uma incisão na linha média abdominal, objetivando a região peritoneal. Injetou-se 5 mL de salina fisiológica dentro da cavidade peritônio-abdominal e em seguida foi feita a aspiração do líquido. O líquido aspirado de cada animal foi analisado no aparelho Coulter T-890. A intenção de analisar o lavado peritoneal é de verificar se houve, durante o tempo de contato do animal com o extrato, migração celular na área de inoculação. A contagem celular global do lavado peritoneal, sinaliza possível reação tóxica local ou sistêmica que possa ter gerado um processo inflamatório. Como valor de referência usou-se os indicativos da Tabela 4 abaixo baseada na contagem celular global do Grupo 4, pois as cavidades peritoneais dos animais desse grupo não tiveram quaisquer tipos de inóculos a elas inseridos. 3. Resultados e discussões A Tabela 5 demonstra os resultados de comparação entre os animais e os respectivos índices de observação após inoculação dos extratos (composição dos extratos, vide Tabela 2). Observou-se, que para o grupos 1 (inoculados com Extrato A) e o grupo 4 (sem inóculo), não houve nenhuma reação adversa notada em qualquer das observações, sendo considerada, portanto, como normalidade para os testes, ou seja, o grupo 1 é o controle para a inoculação da saliva artificial e o grupo 4 controle total do teste, o grupo 3 é um controle em relação a utilização de material cerâmico ( no caso alumina) e o grupo 2 é o do material em teste. Para a avaliação geral dos grupos, o nível sérico é igual a 0 – NORMAL, com ganho de peso dos animais ensaiados (Tabela 6). Vol. 1, No. 1, outubro-dezembro 2011, Página 13 Os animais chegaram ao final das 72 horas de experimentação sem anormalidades, significando que o extrato inoculado não causou qualquer tipo de disfunção nos órgãos adjacentes à inoculação ou de nível sistêmico. Os resultados observados em relação ao índice de toxicidade no grupo 2 (Tabelas 5 e 6), demonstraram que o extrato B não causa toxicidade aos animais. O resultado obtido no grupo 3, também são semelhantes aos dos grupo 1 e 2, como controle total, os animais (grupo 4) sem qualquer tipo de inóculo na cavidade intraperitoneal, também foram observados e os resultados obtidos nesse grupo, validam as afirmações acima citadas, conforme demonstram as Tabelas 5 e 6. Vol. 1, No. 1, outubro-dezembro 2011, Página 14 O resultado do teste sobre o lavado peritoneal foi obtido através de análise de contagem celular global no aparelho Coulter T-890. As análises macroscópicas do lavado peritoneal de todos as amostras coletadas, foram negativas, pois não apresentaram turbidez e estavam inodoras. Essa observação indica que não houve processo inflamatório local devido aos extratos injetados (Tabela 7). Como confirmação de que não houve migração celular excessiva devido à reação dos extratos inoculados, usou-se a contagem celular global do lavado peritoneal, como controle utilizou-se o lavado obtido do Grupo 4 (sem inoculação de extrato). Pode-se observar através da Tabela 8, a presença de raras hemácias na contagem celular dos lavados peritoneais de todos os grupos em teste. Essa presença celular é devido à incisão cirúrgica abdominal (com bisturi de lâmina) realizada para se fazer e coletar o lavado peritoneal. Como confirmação da presença celular não ser decorrente de processo inflamatório, devido a presença dos extratos, tem-se os resultados obtidos do controle total do ensaio (Grupo 4 - sem inóculo). A quantidade de leucócitos global do lavado em todos os grupos esteve dentro dos padrões de normalidade (Tabela 8). Vol. 1, No. 1, outubro-dezembro 2011, Página 15 4. Conclusão Após os extratos do vitrocerâmico com cristais de anortita (CaAl2Si2O8) serem absorvidos pelo sistema biológico (cobaias), intraperitonealmente, não foi observado indícios de toxicidade. Os ensaios preliminares de biocompatibilidade, representados pelo teste de toxicidade sistêmica e análise do lavado peritoneal, demonstraram que o material em teste é um material com fatores biocompatíveis, pois não causa efeitos destrutivos quando absorvidos sistemicamente. Salienta-se assim, a possibilidade do BR3G, em usos biomédicos. 5. Referências [1] NEVES, Etney and SPILLER, Andre. Intelligent Glass Ceramic Materials. GLASS ODISSEY: 6th European Congress on Glass. Montpellier – France. June, 168p, 2002. [2] NEVES, Etney, SPILLER, A. L., TRIDAPALLI, D., RIELLA, H. G., “Desenvolvimento de Cristais de Anortita em Vidros”, Simpósio Brasileiro de Estruturologia, Tiradentes / MG, Setembro 2001. [3] TOROPOV, N. A., TIGONEN, G. V., “Investigation of the Linear Rate of Growth of Anorthite Crystals in Glass at 1000C”, Neorganicheskie Materialy, v. 1, n. 5, p. 775779, 1965a. [4] TOROPOV, N. A., TIGONEN, G. V., “The Influence of Primary Heat Treatment on the Crystallization of Anorthite-Wollastonite Glasses Containing Chromic Oxide”, Neorganicheskie Materialy, v. 1, n. 11, p. 2014-2019, 1965b. [5] FERNANDES, B. L., NEVES, Etney, “In vitro Degradation Analysis of Intelligent Glass Ceramic”, CLAEB – III Congresso Latino - Americano de Engenharia Biomédica – João Pessoa – João Pessoa – PB, 2004. [6] TECPAR, “Laudo Técnico 05008607”, Laboratório de Microbiologia e Toxicologia, Paraná, 2005. [7] CAVALHEIRO, L. B. B. H., FERNANDES, B. L., NEVES, Etney, “Anorthite Glass Ceramic To Biomaterial”, 3rd International Symposium on non-crystalline solids and the 7th Brazilian Symposium on glass and related materials - Maringá, PR - Brazil November 2005. [8] CAVALHEIRO, L. B. B. H., “Estudo da Biocompatibilidade e da Degradacão do Vitrocerâmico de Anortita”, Mestrado, PUCPR, 2005. [9] SILVEIRA, J. C. C. da, “Proposta de Utilização do Vitrocerâmico anortita como um Sistema de Liberação Controlada de Fármacos”, Mestrado, PUCPR, 2006. [10] HISAO SATOH, et. all., In-situ measurement of dissolution of anorthite in Na-ClOH solutions at 22°C using phase-shift interferometry, American Mineralogist;92:503Vol. 1, No. 1, outubro-dezembro 2011, Página 16 509, 2007. [11] NEVES, Etney. Obtenção de Material Vitrocerâmico a Partir de Cinza Pesada de Carvão Mineral. Tese UFSC. junho 2002. [12 ]NEVES, Etney e SPILLER, Andre. Produção e Utilização da Fase Mineralógica anortita (CaAl2Si2O8), a partir da Cristalização Controlada de Vidros, para Utilização como Material Inteligente. Instituto Nacional da Propriedade Industrial. Patente de Invenção: PI02022410-9 de 4 de junho de 2002. [13] NEVES, E., BERGMANN, C. P., BUENO, L. A., PEVZNER, B. “Synthesis of Ca2+ Aluminosilicates Crystals – Part 1”, V Encontro da SBPMat – Sociedade Brasileira de Pesquisa em Materiais, Florianópolis, outubro 2006. [14] INTERNATIONAL ORGANIZATION FOR STANDARDIZATION. ISO 1099311. Tests for systemic toxicity:. biological evaluation of medical devices, Switzerland, ISO,1992. [15] FUSAYAMA,T.; KATAYORI, T.; NOMOTO, S. Corrosion of gold and amalgam placed in contact with each other. Journal Dentistic Research,v. 42, p.1183-1197, 1963. Vol. 1, No. 1, outubro-dezembro 2011, Página 17
 Vol. 2, No. 4, outubro-dezembro 2012, Página 58
Vol. 2, No. 4, outubro-dezembro 2012, Página 58