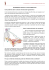CELY MARINI MELO INDUÇÃO DE OVULAÇÃO EM ÉGUAS
Transcrição
CELY MARINI MELO INDUÇÃO DE OVULAÇÃO EM ÉGUAS
CELY MARINI MELO INDUÇÃO DE OVULAÇÃO EM ÉGUAS Monografia apresentada à disciplina “Seminário em Reprodução Animal II” do Programa de Medicina Veterinária, Reprodução Pós-graduação Animal, em Área de Curso de Doutorado, Campus de Botucatu da Faculdade de Medicina Veterinária e Zootecnia da UNESP – Docentes responsáveis: Prof. Adj. Sony Dimas Bicudo Profª. Adj. Maria Denise Lopes BOTUCATU – SP 2006 Resumo Com o desenvolvimento da indústria eqüina têm-se difundido cada vez mais as biotecnologias aplicadas à reprodução. A utilização de agentes indutores da ovulação no manejo reprodutivo de éguas apresenta um papel fundamental na otimização dos resultados das biotecnologias, dentre elas a inseminação artificial, seja pelo uso de sêmen refrigerado ou congelado, bem como na transferência de embriões. Algumas raças, como é o caso do Puro Sangue Inglês, apresentam uma estação reprodutiva restrita, sendo importante o controle ovulatório para maximizar o uso do garanhão, reduzindo o número de coberturas e otimizar o ciclo das éguas, especialmente as recém-paridas, com o objetivo de concentrar os nascimentos no inicio da próxima estação reprodutiva em função do ano hípico nesta espécie. A utilização da gonadotrofina coriônica humana (hCG) vem sendo empregado durante muitos anos, entretanto, devido ao fato de ser uma grande molécula glicoprotéica, induz a uma ação antigênica por parte do sistema imunológico quando utilizado mais do que três vezes na mesma estação reprodutiva. Sendo assim, o uso de análogos do GnRH (deslorelina) e do extrato de pituitária eqüina tem sido uma alternativa ao uso do hCG na sincronização e indução da ovulação em éguas. O presente estudo objetivou abordar o uso dos agentes indutores da ovulação na espécie eqüina, com base na fisiologia reprodutiva desta espécie. Palavras chaves: éguas, ovulação, hCG, deslorelina, extrato de pituitária eqüina Sumário Resumo Introdução 1 Revisão de Literatura 3 1.0 Fisiologia do ciclo estral 3 1.1 Definições e termos 3 1.2 Duração das Fases do Ciclo Estral 3 1.3 Controle Endócrino da Função Ovariana 4 1.3.1) Hormônio Liberador de Gonadotrofina (GnRH) 4 1.3.2) Hormônio Folículo Estimulante (FSH) 4 1.3.3) Hormônio Luteinizante (LH) 5 1.3.4) Estrógeno 5 1.3.5) Inibina 6 1.4) Progestrerona 6 1.5) Prostraglandina 7 1.6) Dinâmica Ovariana 8 1.7) Ovulação 10 2.0) Indução da ovulação 12 2.1) Agentes indutores da Ovulação 12 2.1.1) Gonadotrofina coriônica humana (hCG) 12 2.1.2) Hormônio Liberador de Gonadotrofina (GnRH) 14 2.1.2.1) Down Regulation 15 2.1.3) Extrato de Pituitária Eqüina (EPE) 16 3.0) Considerações Finais 17 4.0) Referências 17 1 Introdução Nos últimos cinco anos houve um aumento significativo na prestação de serviços, na comercialização e no número de criadores envolvidos no setor de eqüideocultura. Esse incremento na indústria eqüina está ocorrendo devido a recuperação da economia brasileira e principalmente devido ao desenvolvimento e utilização de novas biotécnicas de reprodução assistida, como sêmen refrigerado e transportado, sêmen congelado e transferência de embriões. Outro aspecto responsável por esse aumento se deve a aquisição de animais de diferentes raças por criadores brasileiros nas ultimas três décadas, aumentando o potencial genético do nosso plantel e colocando o Brasil num patamar elevado em termos de criação de eqüinos e uso de diferentes biotécnicas da reprodução. Considerando cada égua individualmente, a mesma pode apresentar uma variabilidade quanto à duração do período de estro, momento da ovulação, bem como do diâmetro folicular e ovulação. A aplicação das modernas biotecnologias na reprodução eqüina, dentre elas a transferência de embrião e a inseminação artificial, requerem um rigoroso controle do ciclo estral. A alta variabilidade na duração do período do estro e a dificuldade em predizer o momento exato da ovulação fizeram com que fossem desenvolvidos métodos para o controle do ciclo estral e da ovulação, especialmente para aumentar a performance reprodutiva tanto de garanhões como de éguas durante a estação de monta (Veronesi et. al., 2003). Além da égua ser classificada como poliéstrica estacional, ou seja, período reprodutivo restrito a 6 meses, a raça de cavalos de corrida (Puro Sangue Inglês – PSI) impõem algumas restrições adicionais quanto ao período de cobertura (Pycock, 2000), restringindo esse tempo. Tais restrições impostas exigem do Médico Veterinário a preparação do garanhão tanto para as potras e éguas vazias, como para as que iniciam a parição em meados de julho e devem ser cobertas no primeiro cio pós-parto ou cio do potro, com o objetivo de otimizar o uso do garanhão e antecipar e agrupar os partos do próximo ano. Com relação às demais raças eqüinas criadas no Brasil, o emprego de agentes indutores da ovulação contribui na melhoria da eficiência reprodutiva, uma vez que viabiliza a redução do período de estro e sincroniza o momento das 2 inseminações, as quais ocorrem num período de até 48 horas após a indução. A predição do momento da ovulação reduz o número de inseminações ou cobertura por estro, reduzindo os gastos com o transporte de sêmen refrigerado e otimizando tanto as doses de sêmen congelado, bem como o garanhão. O objetivo do presente estudo é abordar protocolos de indução de ovulação nas fêmeas eqüinas, tendo como embasamento a fisiologia do ciclo estral nesta espécie. 3 REVISÃO DE LITERATURA 1.0) Fisiologia do Ciclo Estral 1.1) Definições e termos A égua é classificada como poliéstrica sazonal uma vez que apresenta ciclos repetitivos durante a estação do ano (Neely et al., 1985; McKinnon & Voss, 1993; Blanchard et al., 1998). O ciclo estral é definido como o período de uma ovulação até a outra subseqüente, o qual é acompanhado de sinais de estro e concentração plasmática de progesterona inferior a 1ng/mL e composto de duas fases: folicular e luteal (McKinnon & Voss, 1993; Blanchard et al., 1998). A fase folicular (estro) envolve o processo ovulatório, sendo o período de receptividade sexual ao garanhão, bem como a preparação do trato genital da fêmea para receber e transportar os espermatozóides até o oviduto para a fertilização. A fase folicular nas éguas se caracteriza pela fase final do crescimento folicular culminando com a ovulação (Ginther, 1992) no ovário, onde são produzidos altos níveis de estrógeno pelas células da granulosa. Entretanto, a fase luteal (diestro) compreende o momento em que a fêmea não aceita o macho e o trato genital encontra-se preparado para nutrir e receber o concepto (Blanchard et al., 1998). Após a ovulação, a ruptura do folículo desenvolve um corpo lúteo, o qual secreta progesterona e faz com que a fêmea rejeite o garanhão; o fim desta fase se dá no momento em que ocorre a lise desta estrutura, aproximadamente 14 a 15 dias da ovulação, dando início ao estro 1 a 2 dias após (McKinnon & Voss, 1993). 1.2) Duração das Fases do Ciclo Estral A maioria dos autores acredita que os ciclos estrais nas éguas são muito irregulares. Esta irregularidade se deve a falta de padronização na detecção do estro, a individualidade, ao fator racial, além de estudos em diferentes condições ambientais por diferentes técnicos. Uma análise de diferentes estudos que determinaram a duração das diferentes fases do ciclo estral na égua concluiu que o período de estro, diestro e ciclo estral são em média: 6.5, 14.9 e 21.7, respectivamente (Ginther, 1992; McKinnon & Voss, 1993). 4 1.3) Controle Endócrino da Função Ovariana As alterações no trato genital feminino, bem como o comportamento sexual são controlados através de interações complexas dos hormônios hipotalâmicos, hipofisários, ovarianos e uterinos. Os hormônios envolvidos neste controle são o hormônio liberador de gonadotrofina (GnRH) pelo hipotálamo, as gonadotrofinas (hormônio folículo estimulante – FSH e hormônio luteinizante – LH) pela hipófise anterior, esteróides (progesterona e estradiol) bem como os hormônios peptídicos (inibina) por parte do ovário e a prostraglandina (PGF2α) através do endométrio (McKinnon & Voss, 1993). 1.3.1) Hormônio Liberador de Gonadotrofina (GnRH) O GnRH é um decapeptídeo (10 aminoácidos) com peso molecular de 1183 daltons, sintetizado e armazenado na base do hipotálamo. Este hormônio é responsável pela conexão entre o sistema nervoso e endócrino. A liberação de pulsos de GnRH através do sistema porta hipofisário estimula a síntese e liberação de LH e FSH pela hipófise anterior (Hafez, 2000), os quais vão atingir os ovários através do sistema circulatório (McKinnon & Voss, 1993). A frequência dos pulsos de GnRH é mediada através da liberação da melatonina. Uma baixa freqüência ocorre durante o anestro devido a alta concentração de melatonina devido a menor luminosidade dos períodos de outono e inverno. A freqüência da liberação de GnRH também se encontra diminuída durante o diestro como resultado do feedback negativo exercido pelas elevadas concentrações de progesterona. A liberação de gonadotrofinas pela hipófise anterior é mediada pela freqüência dos pulsos de GnRH (Knottenbelt et al., 2003). 1.3.2) Hormônio Folículo Estimulante (FSH) O FSH é o hormônio responsável pelo crescimento dos folículos ovarianos ou de Graaf. Este hormônio na presença do LH estimula a produção de estrógeno (Hafez, 2000) através de sua ligação às células da granulosa, inclusive dos folículos pré-antrais e o estradiol por sua vez estimula a produção de mais células da granulosa e aumenta a sensibilidade às gonadotrofinas. Sendo assim, o FSH através do estrógeno é um potente estimulante folicular (Ginther, 1992). 5 A secreção de FSH é estimulada pelo comprimento do dia e suprimido pelo estrógeno e a inibina, hormônio liberado pelos folículos em desenvolvimento (Knottenbelt et al., 2003). Durante a estação de monta as concentrações de FSH atinge dois picos em intervalos de 10 a 11 dias. O primeiro pico de FSH ocorre próximo do final do estro e coincide com o pico de LH próximo ou após a ovulação. O segundo pico se dá na metade do diestro, quando a atividade folicular encontra-se baixa, em teoria este pico é responsável pelo desenvolvimento de uma nova onda folicular a qual originará o folículo ovulatório durante o próximo estro (Knottenbelt et al., 2003). 1.3.3) Hormônio Luteinizante (LH) O LH é um hormônio glicoproteico composto de uma sub-unidade alfa e uma beta com peso molecular de 30.000 daltons e uma meia vida biológica de 30 minutos. Os níveis tônicos e basais atuam em conjunto com o FSH na secreção ovariana de estrógeno. O limiar pré-ovulatório é responsável pela ruptura da parede do folículo e ovulação (Hafez, 2000). As concentrações plasmáticas de LH são baixas nos dias 6 a 15 após a ovulação devido a ação do feedback negativo da progesterona no hipotálamo, causando a supressão do GnRH. As concentrações começam a aumentar próximo ao início do estro (dia 17), quando não existe efeito da progesteronae provavelmente ao estímulo positivo do estrógeno na freqüência do pulso de GnRH. O pico de LH ocorre 2 dias após a ovulação e então declina lentamente. Devido a prolongada meia-vida, o LH atinge concentrações basais em torno de 5 a 6 dias pós-ovulação (Knottenbelt et al., 2003). 1.3.4) Estrógeno As concentrações de estrógeno folicular atingem o pico 1 a 2 dias da ovulação, decrescendo a concentrações basais 2 dias após a ovulação. Na ausência de progesterona (concentrações <1ng/mL), o estrógeno secretado pelo folículo préovulatório induz a receptividade sexual, relaxamento da cervix e vulva, estimula produção de secreções do trato genital, permite a passagem e o transporte 6 espermático, alem de ter um papel importante na maturação folicular e ovulação (McKinnon & Voss, 1993). 1.3.5) Inibina Inibina é um hormônio gonadal não esteróide hidrófilo que regula o FSH através de feedback negativo (Squires & Seidel, 1995). Este hormônio glicoproteico é composto de subunidades α e β (designada βA ou βB) (Hafez , 2000; Senger, 2003) produzidas pelas células da granulosa de mamíferos durante a fase folicular (Nambo et al, 2002). Atuam na pituitária como um sinalizador químico inibindo a liberação de FSH sem alterar a concentração de LH, conseqüentemente controlando o desenvolvimento folicular (Hafez, 2000). A manutenção do FSH em altas concentrações durante a fase folicular pode evitar a atresia dos folículos menores, e com isso resultar em múltiplas ovulações (Squires & Seidel, 1995). Algumas tentativas supressoras de inibina para indução de múltiplas ovulações em éguas têm sido estudadas, com o intuito de impedir o seu efeito (Mckinnon, et al., 1992), através da imunoneutralização de inibina, que consiste na utilização de fragmentos sintéticos ou recombinantes da subunidade - α, o que promove o bloqueio do mecanismo de feedback negativo da liberação de FSH, permitindo a elevação dos níveis de FSH endógeno durante a fase folicular. 1.4) Progestrerona Progesterona (P4) é um hormônio esteróide secretado pelo corpo lúteo (CL), placenta e glândula adrenal. Este hormônio é transportado para a corrente sanguínea ligada a globulina, do mesmo modo que os andrógenos e os estrógenos. Tem como função preparar o endométrio para implantação e manutenção da gestação aumentando a atividade secretora das glândulas endometriais e inibindo a motilidade do endométrio; inibe o estro e a liberação de LH a níveis elevados. Com isso, a progesterona é um importante regulador do ciclo estral (Hafez, 2000). A concentração de progesterona durante o estro encontra-se abaixo de 1ng/mL. Durante a fase de estro encontra-se inferior à 1ng/mL (normalmente <0,5ng/Ml). Após 24 a 48 horas da ovulação esta concentração eleva-se progressivamente, atingindo valores máximos de diestro (4 a 22ng/mL) entre os dias 7 5 a 7 pós ovulação. A concentração de P4 se mantém elevada até os dias 13 e 14 do diestro (aproximadamente 3 dias próximo do início do estro) e então regridem rapidamente até atingirem os valores baixos, correspondente ao período de estro (Ginther, 1992). 1.5) Prostraglandina As prostraglandinas são secretadas por quase todos os tecidos do organismo. São classificadas como ácido graxo insaturado com um anel de ciclopentano. O ácido aracdônico, um ácido graxo essencial, é precursor das prostraglandinas PGF2α e PGE2 (Hafez, 2000). Este por sua vez é liberado na forma livre como resultado da hidrólise da membrana fosfolipídica pela enzima fosfolipase A (PLA). O ácido aracdônico é então convertido em prostraglandina e componentes relacionados à via cilo-oxigenase, utilizando uma enzima do complexo microssomal denominada de prostraglandina sintetase. A PGF2α e PGE2 são duas prostraglandinas intimamente relacionadas à reprodução, sendo liberadas no trato reprodutivo em função de estímulos endócrinos, neurais e físicos (Allen & Cooper, 1993). A PGF2α atua como hormônio luteolítico, modulando a fase luteal, a função e a duração do ciclo estral em éguas. O aumento da liberação uterina de PGF2α está relacionado com a luteólise durante o ciclo estral. Na égua a liberação de PGF2α ocorre entre 14 e 17 dias pós-ovulação e o primeiro pulso de PGF2α precede de em torno de 3 a 4 horas do declíneo mensurável de P4. As concentrações de P4 regridem a valores basais (i.e., <1ng/mL) dentro de 24 e 48 horas, mas a liberação substancial pulsátil de PGF2α se mantém por 1 a 2 dias após a luteólise completa (Allen & Cooper, 1993). A PGE2 tem papel importante no transporte de gametas e do embrião pelo controle da função da musculatura lisa do oviduto (Woods et al., 2000). O embrião eqüino secreta quantidades detectáveis de PGE2 quando atinge o estágio de desenvolvimento de mórula compacta no dia 5 após a ovulação. Esse hormônio age localmente relaxando as fibras da musculatura circular lisa na parede do oviduto, permitindo um movimento progressivo rápido e entrada do embrião no útero 24 horas depois (Allen, 2001). A atividade eletromiográfica do oviduto da égua é 8 estimulada pela administração intramuscular de PGE2 (Troedsson et al., 1995) e a administração local de PGE2 induz o relaxamento da musculatura circular do istmo do oviduto (Weber et al., 1995). 1.6) Dinâmica Ovariana O desenvolvimento folicular nas espécies monovulares é subscrito em três fases: primeiramente pela ativação do folículo primordial, em seguida ocorre o recrutamento folicular, posteriormente a seleção de um ou dois folículos dominantes em associação com a atresia dos folículos subordinados (Ginther & Bergfelt, 1993). A ativação dos folículos primordiais é necessária para que ocorra a passagem dos folículos quiescentes em uma reserva, para o pool de folículos em crescimento (Russe, 1983). O primeiro sinal desta ativação é o retorno da proliferação das células da granulosa, aumento do tamanho do oócito, ocorrendo a passagem do estágio de folículo primordial para o de folículo primário (Hisfield, 1985). O desenvolvimento folicular é caracterizado pela diferenciação e proliferação das células da granulosa. A formação de múltiplas camadas de células foliculares cúbicas indica a transformação de folículo primário em secundário. Acompanhando este processo está a formação da zona pelúcida ao redor do oócito. Folículos primários e secundários também são denominados como folículos pré-antrais (Hafez, 2000). Ginther (2000) definiu as ondas foliculares como as ondas maiores e ondas menores. As ondas maiores são caracterizadas pelo desenvolvimento inicial de um grupo de folículos que cresce rapidamente até que apenas um folículo , ou ocasionalmente dois, torna-se dominante sobre os outros. Estas são divididas em ondas primárias e secundárias, de acordo com o momento de sua emergência. Quando a emergência ocorre durante o cio ou no início do diestro é classificada como onda folicular secundária, a qual origina a um folículo dominante no diestro, o qual pode regredir ou , mais raramente, ovular. A emergência da onda na metade do diestro é denominada de onda folicular primária e produz um folículo dominante que irá ovular durante a fase de estro. As ondas que não apresentam folículos dominantes são classificadas como ondas menores. Para que ocorra o recrutamento folicular, é necessário que haja uma elevação das concentrações de FSH (Fortune, 1994). Em contrapartida, a redução dos níveis 9 de FSH coincide com o desvio nas taxas de crescimento entre o futuro folículo dominante e os folículos subordinados da onda maior. O desvio também é precedido pelo aumento nas concentrações de LH (Bergfelt, 1998; Gastal et al., 2000). Com a diferenciação entre o folículo dominante e os subordinados, o folículo dominante adquire a capacidade de refratariedade aos níveis decrescentes de FSH, desencadeados pelo mesmo e por supressores do desenvolvimento dos folículos subordinados (Fortune, 1994). Sendo assim, o futuro folículo dominante encontra-se apto a suprimir os níveis de FSH a concentrações inferiores as necessárias ao crescimento dos folículos subordinados e adquire a habilidade de utilizar baixas concentrações de FSH para prosseguir o seu desenvolvimento (Ginther, 2000). Frente à diminuição dos níveis de FSH circulantes, a aquisição de receptores para LH pelas células da granulosa e as mudanças na vascularização folicular e no sistema IGF parecem ser fundamentais para a continuação do crescimento e diferenciação celular resultando em ovulação (Fortune, 2001). As alterações hormonais inerentes ao ciclo estral da égua estão dispostas em forma de gráfico na figura 2. Fig 1: Controle hormonal do ciclo estral na égua. AP, hipófise anterior; LH, hormônio luteinizante; GnRH, hormônio liberador de gonadotrofina (adaptado de Knottenbelt , D.C., Equine Stud Farm Medicine and Surgery, 1 ed, Saunders, 2003. 10 Fig 2: Alterações hormonais ocorridas durante do ciclo estral normal de 21 dias na espécie eqüina, as setas demonstram o dia da ovulação (adaptado de Knottenbelt, D.C., Equine Stud Farm Medicine and Surgery, 1 ed, Saunders, 2003). 1.7) Ovulação Durante o processo ovulatório, os folículos sofrem três alterações: a) maturação citoplasmática e nuclear, b) ruptura da coesão entre as células do cumulus e as células da granulosa e c) adelgaçamento e ruptura da parede folicular externa (Hafez, 2000). A maioria das éguas ovulam com folículo medindo 40 a 45mm, no período correspondente a 24 a 48 horas do final do estro, o qual dura em média 6,5 dias. Entretando, apesar destes parâmetros estarem bem estabelecidos para a maioria das éguas, tanto o diâmetro folicular pré-ovulatório, bem como a duração do ciclo estral são amplamente variáveis. Algumas éguas podem ovular com um folículo de 35mm de diâmetro e com a consistência firme, considerando que outras não ovularão até que o folículo atinja 50mm (Samper, 1997). A utilização da consistência folicular tem sido defendida por alguns pesquisadores e questionada por outros, por não ser uma avaliação suficientemente segura em predizer o momento da ovulação. Com relação a sensibilidade à palpação, esta é variável de acordo com a égua, a qual pode demonstrar vários graus de sensibilidade. A égua pode elevar o membro próximo ao abdômen, mover as patas ou virar a cabeça para o examinador. Eventualmente sinais temporários de cólica severa podem estar associadas a ovulação (Ginther, 1992). A ovulação é resultado de alterações citológicas e bioquímicas na parede do folículo para que a ovulação seja bem sucedida, o fluido folicular contendo o oócito 11 tem que passar através do epitélio folicular, da lâmina basal, teca interna, teca externa, estroma ovariano, túnica albugínea e epitélio germinativo. Tipicamente próximo ao momento que o folículo é estimulado pelo LH, este cresce o suficiente para fazer uma protuberância na superfície do ovário, tanto que o estroma oferece pouca ou nenhuma resistência à ovulação (McKinnon & Voss, 1993). A detecção da ovulação pode ser realizada com o auxílio de ultra-sonografia trans-retal conforme pode ser observado na figura 3. Fig 3: seqüência de eventos da evacuação folicular. A) Folículo pré-ovulatório aproximadamente 5 minutos antes da ovulação; B) Início do extravasamento do fluido folicular; C-F) Imagens 37, 60, 60 minutos mais 15 segundos e 65 minutos após a imagem B. De acordo com Fritz & Speroff (1982), o mecanismo da ovulação pode ser resumido em: a. Aumento do LH plasmático estimulando o aumento do AMPc intracelular; b. O AMPc é o mediador da luteinização e da retomada da meiose, superando a ação local do inibidor da luteinização e da maturação do oócito; c. A síntese de progesterona aumenta e a parede folicular tem aumentada sua capacidade de distenção; d. Aumentam os níveis de prostaglandina que associado à plasmina e a colagenase, digerem a parede do folículo ovariano; e. O aumento dos níveis de LH completa a divisão reducional e formação do primeiro corpúsculo polar; f. A continuidade da digestão enzimática resulta na ruptura da parede folicular; 12 g. Ocorre a expulsão do oócito; h. Invasão da granulosa luteinizada pelos vasos sanguíneos. 2.0) Indução da Ovulação Em éguas cíclicas o propósito de se induzir a ovulação é melhorar o manejo reprodutivo e sincronizar a ovulação o mais próximo possível da cobertura, inseminação ou conveniência. Quando a monta natural ou sêmen fresco são utilizados, o intervalo entre a inseminação e a ovulação pode variar entre 0 a 48 horas. Quando do uso de sêmen congelado, uma maior acurácia é necessária, e o intervalo deve ser menor que 24 horas (Palmer, 1993). A maneira mais apropriada para selecionar o momento de induzir a ovulação consiste na utilização de agentes indutores quando um folículo de 33mm é detectado em éguas pôneis e um de 35mm em éguas, momento em que o folículo encontra-se responsivo ao LH (Palmer, 1993). Deste modo, após a indução da ovulação, a maioria das éguas irão ovular no período correspondente a 36 e 48 horas da indução, demonstrando uma variação individual acentuada, a qual pode estar relacionada ao diâmetro ovulatório de cada animal (Samper, 1997). A ultra-sonografia é uma ferramenta bastante eficiente na indução da ovulação, não somente pela acurácia proporcionada pela mensuração do diâmetro folicular, como também pela classificação do escore do edema endometrial (variando de 0 a 5, sendo 0 a ausência de edema e 5 o edema máximo). De acordo com Samper (1997) a indução da ovulação com hCG quando o escore de edema encontra-se entre 4 e 5, associado a um folículo entre 35 a 40 mm de diâmetro apresenta 95% de eficácia nos dois primeiros ciclos. 2.1) Agentes indutores da Ovulação 2.1.1) Gonadotrofina coriônica humana (hCG) O hCG tem sido utilizado por muitos anos para diminuir o período de estro e acelerar a ovulação, sua eficiência é amplamente demonstrada na indução da ovulação quando um folículo pré-ovulatório é detectado de fato, a administração do hCG em éguas com um folículo pré-ovulatório de pelo menos 35mm é capaz de induzir a ovulação em até 48 horas em 80% dos casos (Bergfelt, 2000). 13 Portanto, a utilização de hCG aumenta a probabilidade de um ciclo ovulatório estar associado a uma única cobertura, viabilizando o planejamento do acasalamento. Objetivando inseminar cada vez mais éguas uma única vez o mais próximo possível da ovulação (Veronesi et al., 2003). A administração do hCG em éguas em cio contendo mais de um folículo pré-ovulatório tem ampliado a possibilidade de ocorrer dupla ovulação (Woods & Ginther, 1983). Uma única dose de hCG é utilizada para induzir a ovulação. Aparentemente não existe um padrão ou nível de dose, variando entre 1000UI a 6000UI ou mais, sendo que a maioria das doses utilizadas é entre 2000 a 3000 UI. O momento da administração do hCG normalmente é ditado pela associação de alguns fatores, dentre eles: a) período do ano, b) comportamento de estro, c) ecotextura uterina, tônus uterino e cervical, d) ecotextura da parede do folículo pré-ovulatório e f) diâmetro e formato do maior folículo. De todos os fatores citados, a administração do hCG é realizada quando um folículo atinge 35mm de diâmetro durante a fase folicular (Bergfelt, 2000). Apesar de ser um agente indutor de ovulação largamente utilizado, o hCG apresenta a inconveniência de induzir a formação de anticorpo após algumas injeções sucessivas (Duchamp et al., 1987). Roser et al. (1979) demonstraram que a formação de anticorpos se inicia após 2 a 5 injeções de hCG, mas falhou em demonstrar refratariedade, a despeito das altas taxas de anticorpos, discordando de Sullivan et al., (1973), os quais observaram a refratariedade após a terceira administração do hCG. A utilização de uma dose de dexametasona (20mg de fofato de sódio de dexametasona + 40mg fenilpropionato de dexametasona) simultaneamente ao hCG, objetivando a inibição da formação de anticorpos não foi eficiente de acordo com Duchamp et al. (1987), entretanto estes mesmos autores admitem a possibilidade de uma única dose não ser eficiente na inibição do sistema imunológico. McCue et al. (2004) também observaram que repetidas doses de hCG durante a estação de monta está relacionada com a menor eficácia na indução da ovulação, sugerindo a utilização deste agente no máximo duas vezes por estação de monta. Os mesmos autores também observaram uma redução no percentual ovulação entre 24 e 48 horas após a indução nas (acima de 15 anos). éguas com idade avançada 14 2.1.2) Hormônio Liberador de Gonadotrofina (GnRH) Muitos estudos tem avaliado o uso do GnRH e seus análogos no controle do ciclo estral de éguas. A administração do GnRH sintético durante o estro estimula a liberação de LH e reduz a duração do estro (Irvine et al., 1975). O desenvolvimento de agonistas e análogos de GnRH aumentou a meia vida deste hormônio através de modificações estruturais no GnRH natural, o que permitiu o aumento nos níveis de LH por 12 a 24 horas após a administração dos mesmos (Bergfelt, 2000). A maioria dos análogos são produzidos pela substituição e/ou remoção dos aminoácidos da molécula natural de GnRH. A substituição da glicina na posição 6 por D-alanina, triptofano ou serina confere uma maior estabilidade estrutural e metabólica, aumentando a meia-vida e a açãodo análogo (Monahan et al., 1973). Um dos agonistas do GnRH utilizados na espécie eqüina é a burserelina, a qual foi bem sucedida quando administrada duas vezes ao dia após a detecçao de um folículo de 35mm (Squires et al., 1981). A deslorelina é um análogo do GnRH produzido pela substituição da glicina na posição 6 pelo triptofano, retirando a glicina da posição 10 e adicinando uma amida na prolina da posição 9 (6-D-triptofano-9-(N-etil-L-prolinamida)-10- Desglicinamida LH-RH). Encontra-se disponível na forma comercial de Ovuplant , um implante de curta duração que libera 2,2mg a cada 2 a 3 dias. Este implante de deslorelina tem-se demonstrado eficiente em aumentar as concentrações de LH e induzir a ovulação em éguas cíclicas (McKinnon et al., 1993; Squires et al., 1994; Mumford et al., 1995) Três estudos compararam o Ovuplant com o hCG e obtiveram um intervalo entre tratamento e ovulação, respectivamente, de 1.98 a 1.88 dias (McKinnon et al., 1993), 46,9 a 43 horas (Meinert el al., 1993) e 2, 2 a 2,2 dias (Vanderwall et al., 2001). Melo et al. (2005) compararam o uso de deslorelina (1 mg/IM) com o extrato de pituitária eqüina (EPE) (10mg/IV) e constataram que ambos os agentes foram eficientes na indução da ovulação, sendo que o período ovulatório após a administração da deslorelina e do EPE, foram respectivamente: 38, 9 e 34, 7 horas. Mumford et al. (1995) compararam o efeito do número de implantes subcutâneos (1, 3 ou 5 implantes de 2,2mg de deslorelina) injetados após a detecção de um folículo de 35mm, repetindo o mesmo protocolo por três vezes com 15 a mesma éguas. Estes autores não observaram diferenças entre as doses utilizadas, bem como não foi observado nenhum efeito deletério na administração da deslorelina durante três ciclos consecutivos. Com relação às taxas de ovulação, quando da injeção de um implante de deslorelina, 83,3% das éguas ovularam num intervalo de até 48 horas da injeção e para 3 ou 5 implantes, foram de 73,3 e 85,7 , respectivamente. Samper et al. (2002) compararam o uso de hCG (Chorulon, Intervet) com a deslorelina (Ovuplant – Pharmacia and UpJohn Co), nas doses de 2500 UI e 2,2mg respectivamente. As éguas foram distribuídas aleatoriamente nos dois grupos e a ovulação foi induzida quando as éguas apresentaram edema uterino com escore entre 2 a 4. O intervalo entre a indução e a ovulação foi maior para as éguas que receberam hCG (28 a 96 horas) em relação às que receberam a deslorelina (36 a 42 horas). Com isso pode-se concluir a eficiência da deslorelina em reduzir o número de coberturas, bem como o número de visitas do veterinário para realizar o controle folicular, sendo de grande auxílio para os programas de transferência de embrião e inseminação artificial, especialmente para sêmen refrigerado e congelado. 2.1.2.1) Down Regulation Os receptores de GnRH quando estimulados continuadamente e uma eventual redução no número de receptores são fatores que levam a refratariedade deste hormônio, acarretando na supressão das gonadotrofinas endógenas. A falta de gonadotrofinas inibe a função reprodutiva, incluindo o desenvolvimento folicular, a ovulação e a fase luteal (Fraser, 1981). A redução do número de gonadotrofos tem sido denominada de “down regulation”, o que tem sido um eficiente método contraceptivo (Irvine, 1983). Dentre as possíveis causas para a redução nas concentrações de LH e FSH encontra-se a redução na secreção endógena de GnRH pelo hipotálamo (Crowder et al., 1986), desensibilização da pituitária ao estímulo do GnRH e/ou a depleção de LH e FSH pela pituitária. A prolongada supressão das gonadotrofinas pelo down regulation seguido do estímulo elevado e constante pelo GnRH geralmente é ocasionado pela redução da sensibilidade dos gonadotrofos (Heber and Swerdloff, 1981; Nett et al., 1981; Sandow, 1983), mais que pela estimulação do GnRH (Belchetz et al., 1978; Zilberstein et al., 1983). 16 De um modo geral, acredita-se que as éguas sejam relativamente refratárias ao down regulation ocasionado pelos análogos do GnRH (Fitzgerald et al., 1993; Irvine and Alexander, 1993). Em equinos, o tratamento com análogos de GnRH por período prolongado (28 dias) e altas doses (1,3mg/kg/dia) reduziu a concentração de LH semelhante as outras espécies (Fitzgerald et al.,1990). O tratamento de éguas com altas doses de análogo de GnRH (10mg/dia) resultou em uma supressão reversiva da atividade ovariana causando uma redução na duração do ciclo estral (Palmer and Quellier, 1988). 2.1.3) Extrato de Pituitária Eqüina (EPE) O extrato de pituitária eqüina tem sido usado em diversos protocolos de superovulação em éguas (Douglas, 1974 e 1979; Lapin & Ginther, 1977; Woods & Ginther, 1983; Alvarenga et al, 1999 e 2001). Duchamp et al. (1987) demonstraram que uma única administração de 25mg de EPE, na presença de um folículo de 35mm de diâmetro, induziu a ovulação em 75% das éguas no período entre 24 e 48 horas. Medeiros et al. (2005) compararam o uso do EPE na concetração de 10 e 5 mg intravenoso e constataram que ambas as doses foram eficientes em induzir a ovulação em um período de 48 horas do momento da ovulação, sendo para 10 e 5mg, respectivamente, 34,4±6,72 e 37,54±3,05horas. O extrato de pituitária eqüina ao contrário do hCG não induz a formação de anticorpos. Entretanto deve-se levar em consideração a heterogeneidade das amostras de EPE (Palmer, 1993). Além da eficiência do EPE na indução de ovulação em éguas, outra vantagem é o estreito do intervalo entre a indução e a ovulação , o que favorece o uso de sêmen congelado nesta espécie, por reduzir o número de inseminações sem o comprometimento da fertilidade (Melo, 2005). 17 3.0) Considerações Finais A indústria eqüina vem se desenvolvendo a cada dia, sendo o Brasil o segundo maior rebanho de eqüinos do mundo, contando com um plantel de qualidade de nível internacional, crescendo com isso, o interesse no aprimoramento das biotecnologias da reprodução. A utilização de agentes indutores de ovulação é uma importante ferramenta na aplicação das biotecnologias reprodutivas, dentre elas, o uso de sêmen refrigerado e/ou congelado e na transferência de embriões; atuam reduzindo o intervalo pré-ovulatório, facilitando a sincronização da ovulação e com isso otimizando o uso do garanhão, bem como das doses de sêmen e sincronizando as doadoras e receptoras nos programas de inseminação artificial. Entretanto, para que possa ser eficiente, a utilização das drogas indutoras de ovulação deve ser realizada com o acompanhamento diário do estro, através de palpação retal e ultra-som, monitorando o crescimento folicular e o edema uterino, para que a administração seja realizada no momento adequado e não haja falha na indução. 4.0) Referências ALLEN, W.R. Fetomaternal interactions and influences during equine pregnancy. Reproduction, v.121, p.513- 527, 2001. ALLEN, W.R., COOPER, M.J. Prostraglandins. In: McKinnon, A.O. & Voss, J.L. Equine Reproduction. Malvern: Lea & Febiger, p.69-80, 1993. ALVARENGA, M.A.; MCCUE, P.; SQUIRES, E.L.; NEVES NETO, J.R. Improvement of ovarian superstimulatory. Response and embryo production in mares treated with equine pituitary extract twice daily. Theriogenology, Los Angeles, v.56, p.879-887, 2001. ALVARENGA, M.A.; MCCUE, P.; SQUIRES, E.L.; NEVES NETO, J.R. Improvement of ovarian superestimulation in mares treated with EPE twice daily. Arq. Fac. Vet. UFRGS, Porto Alegre, suppl. 27, p. 197, 1999. 18 BELCHETZ, P. E., T. M. PLANT, Y. NAKAI, E. J. KEOGH, E. KNOBIL. Hypophysial responses to continuous and intermittent delivery of hypothalamic gonadotropinreleasing hormone. Science, v.202, p.631-633, 1978. BERGEFELT, D.R. Estrous synchronization. mare. In: Equine Breeding Management and Artificial Insemination. Philadelphia: Saunders, p.195-228, 2000. BERGEFELT, D.R. Ovarian follicular waves dynamics in mares. Arquivos da Faculdade de Veterinária UFRGS, v.26, p. 104-124, 1998. BLANCHARD, T.L., VARNER, D.D., SCHUMACHER, J. Manual of Equine Reproduction, 1 ed., St. Louis: Mosby-Year Book, 208p., 1998. CROWDER, M. E., R. D. HERRING, AND T. M. NETT. Rapid recovery of gonadotroph function after down-regulation of receptors for GnRH in ewes. J. Reprod. Fertil., v.78, p.577-585. 1986. DOUGLAS, R.H.; Review of induction of suprovulation and embryo transfer in the equine. Theriogenology, Los altos, v.11, p.33-46, 1979. DOUGLAS, R.H.; NUTI, L.; GINTHER, O.J. Induction of ovulation and multiple ovulation in seasonally-anovulatory mares with equine pituitary fractions. Theriogenology, v.2, p.133-142, 1974. DUCHAMP, G., BOUR, B., COMBARNOUS, Y., PALMER, E. Alternative solutions to hCG induction of ovulation in the maré. Journal of Reproduction and Fertility Supplement, v.35, p. 221-228, 1987. FITZGERALD, B. P., PETERSON, K. D., SILVIA, P. J. Effect of constant administrationof a gonadotropin-releasing hormone agonist on reproductive activity in mares:Preliminary evidence on suppression of ovulation during the breeding season. Am. J. Vet. Res., v.54, p.1746-1751, 1993. 19 FORTUNE, JE. Selection and maintenance of the dominant follicle: An introduction. Biology of Reproduction, v.65, p. 637, 2001. FORTUNE, J.E. Ovarian follicular growth and development in mammal. Biology of Reproduction, v.50, p. 225-232, 1994. FRASER, H. M. Luteinizing hormone-releasing hormone and fertility control. Oxford, Rev. Reprod. Biol., v.3, p.1-48, 1981. FRITZ, M.A.; SPEROFF, L. The endocrinology of the menstrual cycle: the interaction of folliculogenesis and neuroendocrine mechanisms. Fertility and Sterility, v. 38, p. 509 – 529, 1982. GASTAL, E.L., GASTAL, M.O., NOGUEIRA, G.P., BERGFELT, D.R., GINTHER, O.J. Temporal interrelationships among luteolysis, FSH, and LH concentrations and follicle deviation in mares. Theriogenology, v.53, p.925-940, 2000. GINTHER, O. J. Selection of the dominat follicle in cattle and horses. Animal Reproduction Science, v.60-61, p.61-79, 2000. GINTHER, O. J. & BERGFELT, D.R. Growth of animal follicles and concentrations of FSH during the equine estrous cycles. Journal of Reproduction and Fertility, v.99, p.105-111, 1993. GINTHER, O.J. Reproductive biology of the mare: basic and applied Aspects, 2ed. Cross Plains, Wisconsin : Equiservices, 1992. HAFEZ, E.S.E., Reproduction in farm animals, 7. ed, Philadelphia: Lea & Febiger, 2000. HEBER, D & SWERDLOFF, R. S. Down-regulation of pituitary gonadotropin secretion in postmenopausal females by continuous gonadotropin-releasing hormone administration. J. Clin. Endocrinol. & Metab., v.52, p.171-172, 1981. 20 HIRSHFIELD, A.N. Comparison of granulose cell proliferation in small follicles of hypophysectomized, prepuberal and mature rats. Biology of Reproduction, v.32, p.979-987, 1985. IRVINE, C. H. G. & ALEXANDER, S. L. GnRH. In: Equine Reproduction . Malvern: Lea & Febiger, p.37-44, 1993. IRVINE, C. H. G. Gonadotropin-releasing hormone. J. Equine Vet. Sci. v.3:168-170, 1983. IRVINE, D. S., DOWNEY, B. R., PARKER, W. G., SULLIVAN, J. J. Duration of oestrus and time of ovulation in mares treated with synthetic Gn-RH (AY-24,031). J. Reprod. Fertil. Suppl., v.23, p.279-283. 1975. KNOTTENBELT, D.C., Le BLANC, M., LOPATE, C., PASCOE, R.R. Equine Stud Farm Medicine and Surgery, 1 ed, Saunders, 402p., 2003 LAPIN, D.R. & GINTHER, O.J. Introduction of ovulation and multiple ovulations in seasonally anovulatory and ovulatory mares with na equine extract. J. Anim. Sci., Champaign, v.44, p.834-842, 1977. McCUE, P., HUDSON, J.J., BRUEMMER, J.E., SQUIRES, E.L. Efficacy of hCG at Inducing Ovulation: A New Look at an Old Issue. 50th Annual Convention of the American Association of Equine Practitioners, p. 1492-1207, 2004. McKINNON, A. O., NOBELLIUS, A. M., TARRIDA DEL MARMOL FIGUEROA, S. SKIDMORE, J., VASEY, J. R., TRIGG, T. E. Predictable ovulation in mares treated with an implant of the GnRH analogue deslorelin. Equine Veterinary Journal, v.25, p.321-323, 1993. MCKINNON, A.O. & VOSS, J.L. The estrous cycles. In: Mckinnon, Equine Reproduction., Malvern: Lea & Febizer, 1993. p. 114 – 189. 21 MCKINNON, A.O.; BROWN, R.W.; PASSION, R.L. Increased ovulation rate in mares after immunization against recombinant bovine inhibin ∝-subunit. Equine Vet. J. London, v.24, p.144-146, 1992. MEINERT, C., J. F. SILVA, I. KROETZ, E. KLUG, T. E. TRIGG, H. O. HOPPEN, AND W. JÖCHLE. Advancing the time of ovulation in the mare with a short-term implant releasing the GnRH analogue deslorelin. Equine Veterinary Journal, v.25, p.65-68, 1993. MEDEIROS, A.S.L.; SILVA JÚNIOR, B.L.; MELO, C.M.; CARMO, M.T.; PAPA, F.O.; PUOLI FILHO, J N P; ARAÚJO, G.H. M; ALVARENGA, M.O. Utilização do extrato de pituitária eqüina como agente indutor da ovulação em éguas. In: XIX REUNIÃO ANUAL DA SBTE, 2005, Angra dos Reis. Acta Scientiae Veterinariae. v. 30, p. 195, 2005. MELO, C.M. Efeito do armazenamento por 24 horas em diferentes sistemas de refrigeração sobre a viabilidade e fertilidade de sêmen congelado eqüino. Botucatu, 2005. 104 p. Dissertação (Mestrado) – Faculdade de medicina Veterinária e Zootecnia, Universidade Estadual Paulista. MELO, C.M.; PAPA, F.O.; MEDEIROS, A.S.L.; DELL'AQUA JR,J.A.; CARMO, M.T.; ARAÚJO, G.M.; ALVARENGA, M.A. .Efeito da Deslorelina e do extrato de pituitária equina na indução da ovulação em éguas. In: XIXREUNIÃO ANUAL DA SBTE, 2005, Acta Scientiae Veterinariae., v. 33, p.193, 2005. MONAHAN, M. W., AMOSS, M. S., ANDERSON, H. A., VALE, W. Synthetic analogs of the hypothalamic luteinizing hormone-releasing factor with increased agonist of antagonist properties. Biochemistry v.12, p.4616-4620, 1973. MUMFORD, E. L., SQUIRES, E. L., JÖCHLE, W., HARRISON, L. A., NETT, T. M., TRIGG, T. E. Use of deslorelin short-term implants to induce ovulation in cycling mares during three consecutive estrous cycles. Animal Reproduction Science v.39, p.129-140, 1995. 22 NAMBO, Y.; NAGAOKA, K.; TANAKA, Y.; NAGAMINE, N; SINBO, H.; NAGATA, S.; YOSHIHARA, T.; WATANABE, G.; GROOME, N.P.; TAYA, K. Mechanisms responsible for increase in circulating inhibin levels at time ovulation in mares. Theriogenology, v. 57, p.1707-1717, 2002. NEELY, D.P.LUI, I.K., HILLMAN, R.B. Equine Reproduction. Laurenville, Veterinary Learning Systems, 148p., 1983. NETT, T. M., M. E. CROWDER, G. E. MOSS, AND T. M. DUELLO. GnRH-receptor interaction. V. Down-regulation of pituitary receptors for GnRH in ovariectomized ewes by infusion of homologous hormone. Biol. Reprod., v.24, p.1145-1155, 1981. PALMER, E. & QUELLIER, P. Uses of LHRH and analogues in the mare. In: Proc. 5th Internatl. Cong. Anim. Reprod. Artif. Insem., Dublin, Irlanda. P.339-346, 1988. PALMER, E. Induction of ovulation. In: McKinnon, A.O. & Voss, J.L. Equine Reproduction. Malvern: Lea & Febiger, p.344-347, 1993. PYCOCK, J. Beeding management of the problem mare. In: Equine Breeding Management and Artificial Insemination. Philadelphia: Saunders, p.165-177, 2000. RUSSE, I. Oogenesis in cattle and sheep. Bibliotheca anatomica, v.24, p.77-92, 1983. SAMPER, J.C. JENSEN, S., SERGENAT, J., Timing of induction of ovulation in mares treated with ovuplant or chorulon. JOURNAL OF EQUINE VETERINARY SCIENCE, v.22, n7, p.320-323, 2002. SAMPER, J.C. Ultrasonographic Appearance and the Pattern of Uterine Edema to Time Ovulation in Mares, AAEP PROCEEDINGS, v.43, p.189-191, 1997. SANDOW, J. The regulation of LHRH action at the pituitary and gonadal receptor level: A review. Psychoneuroendocrinology, v.8, p.277-297, 1983. 23 SENGER, P.L. Pathways to pregnancy and parturition, 2ed., Ephrata: Current Conceptions, 368p., 2003. SIROIS, J., BALL, B.A., FORTUNE, J.E. Patterns of groth and regression of ovarian follicles during the estrous cycle and after hemiovariectomy in mares. Equine Veterinary Journal, suppl. 8, p43-48, 1989. SQUIRES, E.L. & SEIDEL, G.E. Superovulation. In: Collection and transfer of equine embryos. Animimal Reproduction and Biotecnology Lab. Bulletin, n.8, p.32-8, 1995. SQUIRES, E.L., MORAN, D. M., FARLIN, M. E., JASKO, D. J., KEEFE, T. J.,. MEYERS, S. A., FIGUEIREDO, E., McCUE, P. M., JÖCHLE, W. Effect of dose of GnRH analog on ovulation in mares. Theriogenology , v.41, p.757-769, 1994. SQUIRES, E. L., WALLACE, R. A., VOSS, J. L., PICKETT, B. W., SHIDELER, R. K. 1981. The effectiveness of PGF2α, HCG, and GnRH for appointment breeding of mares. Journal of Equine Veterinary Science , v.1, p.5-9. SULLIVAN, J.J., PARKER, W.G., LARSON, L.L. Duration of estrus and ovulation time in non-lactating mares given human chorionic gonadotropin during three successive estrous periods. Journal of American Veterinary Medical Association, v.162, p.895-898, 1973. TROEDSSON, M. T., LIU, I.K.M., ING, M.G., PASCOE, J.. Smooth muscle electrical activity in the oviduct, and the effect of oxytocin, prostaglandin F2α and prostaglandin E2 on the myometrium and the oviduct of the cycling mare. Biol. Reprod. (Mono), v.1, p.475-488, 1995. VANDERWALL, D. K., JUERGENS, T. D., WOODS, G. L. Reproductive performance of commercial broodmares after induction of ovulation with hCG or Ovuplant™ (deslorelin). J. Equine Veterinary Science, v.21, p.539-542, 2001. 24 VERONESI, M.C., BATTOCHIO, M., FAUSTINI, M., GANDINI, M., CAIROLI, F. Relationship between pharmacological induction of estrous and/or ovulation and twin pregnancy in the Thoroughbred mares. Domestic Animal Endocrinology, v.25, p.133-140, 2003. WEBER J.A.; WOODS G.L; LICTENWALNER A.B. Relaxatory effect of prostaglandin E2 on circular smooth muscle isolated from the equine oviductal isthmus. Biol. Reprod. (Mono) v.1, p.125-130, 1995. WOODS, J., RIGBY, S., BRINSKO, S., STEPHENS, R., VARNER, D., BLANCHARD, T. Effect of intrauterine treatment with prostaglandin E2 prior to inseminantion of mares in the uterine horn or body. Theriogenology, v.53, p.1827- 1836, 2000. WOODS, G.L., GINTHER, O.J. Induction of multiple ovulations during the ovulatory season in mares. Theriogenology, v.20, p.347-375, 1983. ZILBERSTEIN, ZAKUT, M., H., NAOR, Z. Coincidence of down-regulation and desensitization in pituitary gonadotrophs stimulated by gonadotropin releasing hormone. Life Science, v.32, p.663-669, 1983.