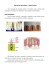Baumer CO-10 Baumer CO-10 Baumer CO-10
Transcrição
Baumer CO-10 Baumer CO-10 Baumer CO-10
English Español Português Baumer CO-10 Baumer CO-10 Baumer CO-10 DESCRIPTION: DESCRIPCIÓN: DESCRIÇÃO: A cementless prosthesis having a modular anatomic design, which makes it possible to use several types of acetabulum x femoral head x femoral stem assemblies, providing the surgeon with the best choice available according to the patient’s characteristics. Femoral stem in 6 line sizes with more 6 sizes available upon inquiry. Femoral head in 3 sizes: Ø22,25mm, Ø28,00mm and Ø32,00mm, being available with different neck heights: Ø22,25mm - medium and long size necks; Ø28,00mm and Ø32,00mm - short, medium, long and extra long necks. A threaded metal acetabular component in 16 sizes. Polyethylene acetabular core in 5 sizes, each one with variations that allow the fitting of the femoral head selected. Also in the normal, offset and self-retaining versions. The femoral stems can be made of Titanium (just by special order) Ti6Al4VEli as per ASTM-F.136 / ISO-5832-3, Stainless Steel as per ASTM-F.138 / ISO-5832-1 or Chrome-Cobalt-Molybdenum alloy as per ASTM-F.75 / ISO-5832-4/ Stainless Steel ASTM- F-1586 / ISO 5832-9. The metal acetabular component can be made of Titanium ASTM-F.67 / ISO-5832-2, Stainless Steel or ChromeCobalt-Molybdenum alloy as above. The polyethylene acetabular core is made of a material having an Ultra High Molecular Weight (UHMWPE-ASTM-F.648 / ISO-5834-2). Both the medical portion of the femoral stem and the metal acetabular component are coated with hydroxyapatite by a spray plasma process reaching a thickness of 50 to 150 microns. Also available are femoral stems without the hydroxyapatite coating, made exclusively of Stainless Steel as per ASTM-F.138 / ISO5832-1 or the Chrome-Cobalt-Molybdenum alloy as per ASTMF.75 / ISO-5832-4 Stainless Steel / ASTM- F-1586 / ISO 5832-9 for a cemented implantation. Prótesis no cementada, de concepción modular, con diseño anatómico, que hace posible varios montajes acetábulo x cabeza femoral x asta femoral, proporcionando al cirujano la mejor elección de acuerdo a las características del paciente. Asta femoral en 6 dimensiones de línea, con 6 dimensiones más disponibles bajo consulta. Cabeza femoral con 3 dimensiones: Ø22,25mm, Ø28,00mm y Ø32,00mm, estando disponibles diferentes alturas de cuello:Ø22,25mm - cuellos mediano y largo Ø28,00mm y Ø32,00mm - cuellos corto, mediano, largo y extra largo. Componente acetabular metálico rosqueado en 16 dimensiones. Núcleo acetabular de polietileno en 5 dimensiones, cada cual con variaciones que permiten el alojamiento de la cabeza femoral seleccionada y además en las versiones Normal, Displásico y Autoretenedor. Las astas femorales pueden ser fabricadas en Titanio Ti6Al4VEli conforme ASTM-F.136 / ISO-5832-3, Acero Inoxidable conforme ASTM-F.138 / ISO-5832-1, liga Cromo-Cobalto-Molibdeno conforme ASTM-F.562 / ISO-5832-6 y Acero ASTM- F-1586 / ISO 5832-9. El componente acetabular metálico puede ser fabricado en Titanio conforme ASTM-F.67 / ISO-5832-2, Acero Inoxidable o liga CromoCobalto-Molibdeno conforme consta arriba. La cabeza femoral, cuando fabricada en titanio (solamente bajo consulta especial), recibe revestimiento de nitruro de titanio, para optimar sus características de acabamiento superficial. El núcleo acetabular de polietileno es fabricado con material de Ultra Alto Peso Molecular (UHMWPE - ASTM-F.648 / ISO- 58342). Tanto la porción media del asta femoral como la superficie externa del componente acetabular metálico son recubiertos con hidroxiapatita, por proceso plasma spray, con espesor de 50 a 150 micras. Están disponibles astas femorales sin hidroxiapatita, fabricadas exclusivamente en Acero Inoxidable conforme ASTMF.138 / ISO-5832-1 o liga cromo-cobalto-molibdeno conforme ASTM-F.562 / ISO-5832-6 - ASTM- F-1586 / ISO 5832-9, para implantación cementada. Prótese não cimentada, de concepção modular, com desenho anatômico, que disponibiliza várias montagens acetábulo x cabeça femoral x haste femoral, proporcionando ao cirurgião a melhor escolha de acordo com as características do paciente. Haste femoral em 06 dimensões de linha, com mais 06 dimensões disponíveis sob consulta. Cabeça femoral com 03 dimensões: Ø22,25mm,Ø28,00mm e Ø32,00mm, estando disponíveis diferentes alturas de colo:Ø22,25mm - colos médio e longo ; Ø28,00mm e Ø32,00mm - colos curto, médio, longo e extra longo. Componente acetabular metálico rosqueado em 16 dimensões. Núcleo acetabular de polietileno em 05 dimensões, cada qual com variações que permitem o alojamento da cabeça femoral selecionada e ainda nas versões Normal, Displásico e Autoretentor. As hastes femorais podem ser fabricadas em titânio Ti6Al4VEli conforme ASTM-F.136 / ISO-5832-3, Aço Inoxidável conforme ASTM-F.138 / ISO-5832-1 ou liga Cromo-Cobalto-Molibdênio conforme ASTM-F.75 / ISO-5832-4 - Aço Inoxidável conforme ASTM- F-1586 / ISO 5832-9. A cabeça femoral quando fabricada em titânio (somente pedido especial) recebe revestimento de nitreto de titânio, para otimizar suas características de acabamento superficial, ou poderá ser fabricada em Aço inoxidável conforme ASTM F-138/ISO 5832-1; liga de Cromo Cobalto Molibdênio, conforme ASTM F-75/ISO 5832-4; ou Aço Inoxidável conforme ASTM F-1586/ISO 5832-9. O componente acetabular metálico pode ser fabricado em Titânio conforme ASTM-F.67 / ISO-5832-2, Aço Inoxidável ou liga Cromo-Cobalto-Molibdênio conforme acima. O núcleo acetabular de polietileno é fabricado com material de Ultra Alto Peso Molecular (UHMWPE - ASTM-F.648 / ISO- 5834-2). Tanto a porção medial da haste femoral como a superfície externa do componente acetabular metálico são recobertos com hidroxiapatita, por processo plasma spray, com espessura de 50 a 150 microns. Estão disponíveis hastes femorais sem hidroxiapatita, fabricadas exclusivamente em Aço Inoxidável conforme ASTM-F.138 / ISO-5832-1 ou liga Cromo-CobaltoMolibdênio conforme ASTM-F.75 / ISO-5832-4, ou ASTM- F-1586 / ISO 5832-9 para implantação cimentada. INDICACIONES: INDICAÇÕES: INDICATIONS: ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ Hip osteoarthritis. Posttraumatic osteoarthritis. Avascular necrosis of the femoral head. Ankylosing spondylitis. Otopelvis. Hip dysplasia. Femoral neck fracture sequel. Femoral neck pseudoarthrosis. Revision of Cemented arthroplasty. HOW TO USE: Care must be taken in the preparation of the medullary canal as well as the acetabular implant region for a perfect fitting of the components, thus preventing radiolucency and the undesirable development of micromovements. Special instruments and tests to assist in the surgical implantation of this prosthesis are available. It is important that the instruments and tests used be specifically designed for this system. Design variations, instrument size and similar tests may affect the critical measures required for an accurate implant. Before starting the surgery, make sure that all the required instruments are available. To protect the doctor and patient against possible future problems, it is recommended to write down on the patient’s record the code and batch number of each implant used. NOTE: Surgical technique 1.30 and 10.30 available upon inquiry. Templates: 9001, 9002, 9025 and 9026. CONTRAINDICATIONS: ♦ An active infection and its sequels. ♦ All those known against the use of cemented prosthesis. PRECAUTIONS: For safety and effectiveness in the use of this prosthesis, the surgeon must be acquainted with the procedures and recommendations for the implant (see information on how to use). To assure an adequate implant, only CO-10 instruments and tests made by BAUMER must be used. In all the cases, traditional surgical practices must be followed in the postoperative period. The patient must be warned about the limitations involved in the total reconstruction of the joint and the recent history of this practice. Excessive physical activities and traumatisms, affecting the replaced joint, have implied the premature failure of the reconstruction by lack, fracture and/or wear of the implant. The patient must be warned about keeping the activities according to the situation and protecting the replaced joint against excessive stress. Obese or very heavy patients may produce overload. To maintain its sterility, the product should only be opened at the time of utilization and handled in sterile environments. The mixing of different materials on the same patient and the micro movement of the components may cause metalosis. In case of implant’s removal and forwarding for manufacturer analysis, it should be previously cleaned and disinfected by the user (surgeon / hospital / nurse).Therefore, the user should proceed with the methods cited below, or any other known and validated. An implant should never be reused. Although it may be in good condition, the prior stress may have produced imperfections that could reduce its useful life. ADVERSE EFFECTS: The implant of foreign materials in tissues may result in histologic involving several types of macrophages and fibroblasts. Cases of patients with reactions of sensitivity to metal after a total joint replacement have been seldom reported. STERILITY: All the prosthesis components as supplied are sterilized. The metal components are sterilized with saturated dry vapor or ethylene oxide while the UHMWPE are sterilized with ethylene oxide. To resterilize unused components, call our factory. All the instruments and tests must be sterilized before being used in a surgery. We recommend using a steam autoclave. Never sterilize the UHMWPE with vapor. Do not use the implant if the package has been violated. Check the date of expiration for the sterilization. In case of implant’s removal and forwarding for manufacturer analysis, it should be previously cleaned and desinfected by the user (surgeon/hospital/nurse). Therefore, the user should proceed with the methods cited below, or any other known and validated: ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ Osteoartritis de la cadera. Osteoartritis postraumática. Necrosis avascular de la cabeza femoral. Espondilitis anquilosante. Otopelvis. Displasia de la cadera. Secuela de fractura de cuello del fémur. Pseudoartrosis del cuello del fêmur. Revisión de artroplastías cementadas. INFORMACIONES DE USO: ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ ♦ Osteoartrite do quadril Osteoartrite pós-traumática. Necrose avascular da cabeça femoral. Espondilite anquilosante. Otopelve. Displasia do quadril. Seqüela de fratura do colo do fêmur. Pseudoartrose do colo do fêmur. Revisão de artroplastias cimentadas. INFORMAÇÕES DE USO: Se debe tomar todo cuidado en la preparación del canal medular, así como también de la región del implante acetabular, para obtenerse perfecto encaje de los componentes, evitándose radioluminiscencia y el indeseable surgimiento de micro movimientos. Están disponibles instrumental especial y pruebas para auxiliar en la implantación quirúrgica de esta prótesis. Es importante que el instrumental y pruebas usados sean aquellos especificamente proyectados para este sistema. Variación en el proyecto y dimensiones de instrumentales y pruebas similares pueden comprometer las medidas críticas requeridas para una implantación precisa. Antes de iniciar la cirugía asegúrese de que el respectivo instrumental está completo. A fin de proteger al médico y a su paciente, en eventuales problemas futuros, conviene anotar en la historia del paciente el código y el número del lote de cada implante utilizado. NOTA : Técnicas quirúrgicas 1.30 y 10.30 disponibles bajo consulta. Templates 9001, 9002, 9025 y 9026. Todo cuidado deve ser tomado na preparação do canal medular, bem como da região do implante acetabular, para se obter perfeito encaixe dos componentes, evitando-se radioluscência e o indesejável surgimento de micro movimentos. Estão disponíveis instrumental especial e testes para auxiliar a implantação cirúrgica desta prótese. É importante que o instrumental e testes usados sejam aqueles especificamente projetados para este sistema. Variação no projeto e dimensões de instrumentais e testes similares podem comprometer as medidas críticas requeridas para uma implantação precisa. Antes de iniciar a cirurgia certifique-se de que o respectivo instrumental está completo. A fim de proteger o médico e seu paciente, em eventuais problemas futuros, convém anotar no protocolo do paciente o código e o número do lote de cada implante utilizado. NOTA : Técnicas cirúrgicas 1.30 e 10.30 disponíveis sob consulta. Templates 9001, 9002, 9025 e 9026. CONTRAINDICACIONES: ♦ Infección activa o sus secuelas. ♦ Todas aquellas conocidas para el uso de prótesis cementadas. ♦ Infecção ativa ou suas seqüelas. ♦ Todas aquelas conhecidas para o uso de próteses cimentadas. PRECAUCIONES: Para seguridad y efectividad del uso de esta prótesis, el cirujano debe estar familiarizado con los procedimientos y recomendaciones para el implante ( vea informaciones de uso ). Para asegurar el implante adecuado, solamente deben utilizarse instrumentales y pruebas CO-10 fabricados por BAUMER. En todos los casos, deben ser seguirse prácticas quirúrgicas consagradas en el postoperatorio. El paciente debe ser alertado sobre las limitaciones de la reconstrucción total de la articulación y del histórico reciente de uso de esa práctica. Actividad física excesiva y traumatismos, afectando la articulación sustituida, implicó falla prematura de la reconstrucción por pérdida, fractura y/o desgaste del implante. El paciente debe ser alertado para mantener sus actividades de acuerdo a su situación, protegiendo a la articulación sustituida contra stress excesivo. Un paciente obeso o muy pesado puede producir sobrecarga. Para mantener la esterilidad, el producto se deberá abrir solamente en el momento de la utilización y manejado en ambientes estériles. La mezcla de diferentes materiales en el mismo paciente y movimientos microscópicos de los componentes pueden causar metalosis. En caso de remoción y envío del implante al fabricante para análisis, éste se deberá limpiar y desinfectar previamente por el usuario (médico/hospital/enfermero). Por lo tanto el usuario deberá proceder de acuerdo con los métodos citados a seguir, o cualquier otro conocido o validado: Un implante nunca debe ser reutilizado, aunque pueda presentar buenas condiciones, el stress previo puede haber creado imperfecciones que podrían reducir la vida útil del mismo. EFECTOS ADVERSOS: Implantación de materiales extraños en el tejidos, pueden resultar en reacciones histológicas envolviendo varios tipos de macrófagos y fibroblastos. Fueron raramente relatadas reacciones de sensibilidad al metal en pacientes, después de la sustitución total de la articulación ESTERILIDAD: To d o s l o s c o m p o n e n t e s d e l a p r ó t e s i s s o n s u m i n i s t r a d o s esterilizados. Los metálicos por vapor saturado seco u óxido de etileno y los de UHMWPE por óxido de etileno. Para la reesterilización de componentes no usados consulte a la fábrica. Todo el instrumental y las pruebas deben ser esterilizadas CONTRA-INDICAÇÕES: PRECAUÇÕES: Para segurança e efetividade no uso desta prótese, o cirurgião deve estar familiarizado com os procedimentos e recomendações para o implante (veja informações de uso). Para assegurar o implante adequado, use apenas instrumentais e provas BAUMER CO-10 fabricados pela BAUMER. Em todos os casos, devem ser seguidas práticas cirúrgicas consagradas no pós operatório. O paciente deve ser alertado sobre as limitações da reconstrução total da articulação e do histórico recente de uso dessa prática. Atividade física excessiva e traumatismos, afetando a articulação substituída, tem implicado em falha prematura da reconstrução pôr perda, fratura e/ou desgaste do implante. O paciente deve ser alertado para manter suas atividades de acordo com sua situação, protegendo a articulação substituída contra stress excessivo. Um paciente obeso ou muito pesado pode produzir sobrecarga. Para manter a esterilidade, o produto deverá ser aberto somente no momento da utilização e manuseado em ambientes estéreis. A mescla de diferentes materiais no mesmo paciente e micromovimentos dos componentes podem causar metalose. Em caso de remoção e envio do implante ao fabricante para análise, este deverá ser previamente limpo e desinfectado pelo usuário (médico / hospital / enfermeiro). Portanto, o usuário deverá proceder de acordo com os métodos citados abaixo, ou qualquer outro conhecido e validado. Um implante nunca deve ser reutilizado, mesmo que apresente boas condições, o estresse prévio pode ter criado microimperfeições que poderão reduzir a vida útil do mesmo. EFEITOS ADVERSOS: Implantação de materiais estranhos em tecidos, podem resultar em reações histológicas envolvendo vários tipos de macrófagos e fibroblastos. Reações de sensibilidade ao metal em pacientes, após substituição total da articulação tem sido raramente relatadas. ESTERILIDADE: Todos os componentes da prótese são fornecidos esterilizados. Os metálicos pôr vapor saturado seco ou óxido de etileno e os de UHMWPE por óxido de etileno. Para a reesterilização de componentes não usados consulte a fábrica. Todo o instrumental e as provas devem ser esterilizadas antes do uso cirúrgico. Recomendamos autoclavagem à vapor. Português Nunca esterilizar pôr vapor componentes de UHMWPE. Não utilize o implante, caso a embalagem esteja violada. Verifique a validade da esterilização. Em caso de remoção e envio do implante ao fabricante para análise, este deverá ser previamente limpo e desinfectado pelo usuário (médico/hospital/enfermeiro). Portanto, o usuário deverá proceder de acordo com os métodos citados abaixo, ou qualquer outro conhecido e validado: Dispositivo Implantável / Desinfecção Componentes ortopédicos poliméricos (UHMWPE) Método de limpeza Solução de enzima proteolítica, com tratamento ultra-sônico, ou 3% de peróxido de hidrogênio estabilizado, ou solução 1:100 de hipoclorito de sódio Método de desinfecção ou esterilização Borrifar com solução 2% alcalina de glutaraldeído ou gás óxido de etileno. Dispositivo Implantável / Desinfecção Componentes ortopédicos metálicos Método de limpeza Enxague intensamente com água, 70% à 80% de etanol aquoso ou isopropanol com tratamento Na embalagem deve constar informações sobre condições do implante, tais como: métodos de limpeza e desinfecção utilizados, bem como a identificação do mesmo. Para envio dos implantes removidos ao fabricante, deve-se utilizar embalagens que mantenham a integridade do mesmo. Na embalagem deve constar informações sobre condições do implante, tais como métodos de limpeza e desinfecção utilizados, bem como a identificação do mesmo. Español antes del uso quirúrgico. Recomendamos autoclavado a vapor. Nunca esterilizar con vapor componentes de UHMWPE. No utilice el implante, en caso que el embalaje esté violado. Verifique la validez de la esterilización. En caso de remoción y envío del implante al fabricante para análisis, éste se deberá limpar y desinfectar previamente por el usuario (médico/hospital/enfermero). Por lo tanto el usuario deberá proceder de acuerdo con los métodos citados a seguir, o cualquier otro conocido o validado. Dispositivo con capacidad de Implantación / Desinfección Componentes ortopédicos de polímeros (UHMWPE) Método de limpieza Solución de enzima proteolítica, con tratamiento de ultrasonido, o 3% de peróxido de hidrógeno estabilizado, o solución 1:100 de hipoclorito de sodio. Método de desinfección o esterilización Pulverización con solución 2% alcalina de glutaraldehido o gas óxido de etileno. Dispositivo con capacidad de Implantación / Desinfección Componentes ortopédicos metálicos Método de limpieza Enjuague intensamente con agua, 70% a 80% de etanol acuoso o isopropanol con tratamiento de ultrasonido en la secuencia, o enzima proteolítica, o solución 1:100 de hipoclorito de sodio. Método de desinfección o esterilización Someta a autoclave a vapor o a óxido de etileno. Para el envío al fabricante de los implantes retirados, se debe utilizar embalajes que mantengan la integridad del mismo. En el embalaje deben constar informaciones sobre las condiciones del implante, tales como métodos de limpieza y desinfección utilizados, como la identificación del mismo. BAUMER S.A. • Vendas - Fone: 55 (11) 3670.0000 • Fax: 55 (11) 3670.0053 • E-mail: [email protected] Fábrica - Av. Pref. Antonio T. Leite, 181 • CEP 13803-330 • E-mail: [email protected] • Mogi Mirim, SP - Brasil • www.baumer.com.br Registro M.S.: 103.455.000.31 - Resp. Técnico: Eng. Carlos Dal Gallo - CREA-SP: 0641480680 201.759 - 2004-10 English Device / Implant disinfected Polymeric orthopaedic components (PMMA, PE-UHMW) Cleaning method Proteolytic enzyme solution, with ultrasonic treatment, or 3% stabilized hydrogen peroxide, or 1:100 solution sodium hypochlorite Sterilizing or disinfecting method Buffered, alkaline 2% solution of glutaraldehyde or ethylene oxide gas Device / Implant disinfected Metallic ortophaedic components Cleaning method Intense water rinse, 70% to 80% aqueous ethanol or isopropanol with subsequent ultrasonic treatment or proteolytic enzyme or 1:100 solution sodium hypochlorite Sterilizing or disinfecting method Steam autoclave or ethylene oxide To f o r w a r d t h e r e m o v e d i m p l a n t s t o t h e m a n u f a c t u r e r, packages must be used, which retain the implant’s integrity. The package must contain information about the implant’s conditions, such as: used methods of cleaning and disinfecting, as well as their identification.