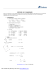termodinâmica básica – apostila 01
Transcrição
termodinâmica básica – apostila 01
1 Engenharia Aeronáutica Engenharia de Produção Mecânica Engenharia Mecatrônica 4º / 5° Semestre TERMODINÂMICA BÁSICA – APOSTILA 01 Prof Daniel Hasse Conceitos Fundamentais Propriedades Termodinâmicas SÃO JOSÉ DOS CAMPOS, SP Capítulo -1 CONCEITOS FUNDAMENTAIS Capítulo – 1 - Termodinâmica Aplicada - pág - 2 1 - CONCEITOS FUNDAMENTAIS 1.1 - Sistema Termodinâmico Sistema termodinâmico consiste em uma quantidade de matéria ou região para a qual nossa atenção está voltada. Demarcamos um sistema termodinâmico em função daquilo que desejamos calcular. Tudo que se situa fora do sistema termodinâmico é chamado MEIO ou VIZINHANÇA. O sistema termodinâmico a ser estudado é demarcado através de uma FRONTEIRA ou SUPERFÍCIE DE CONTROLE a qual pode ser móvel, fixa, real ou imaginária. Sistema Fechado - É o sistema termodinâmico no qual não há fluxo de massa através das fronteiras que definem o sistema. Volume de Controle - Ao contrário do sistema fechado, é o sistema termodinâmico no qual ocorre fluxo de massa através da superfície de controle que define o sistema. Assim, dependendo da interação entre o sistema termodinâmico definido para estudo, e a vizinhança, chamaremos a essa região de Sistema Fechado (demarcado pela fronteira) ou Volume de Controle (demarcado pela superfície de controle) conforme se verifique as definições acima citadas. Exemplos de Sistema Fechado e Volume de Controle A figura 1.1-1 é um sistema termodinâmico fechado, pois não há fluxo de massa através das fronteiras do sistema, embora haja fluxo de calor. A figura 1.1-2, por sua vez, constitui um volume de controle pois temos fluxo de massa atravessando a superfície de controle do sistema. Fig. 1.1-1 - Sistema fechado Fig. 1 .1-2 - Volume de controle Sistema Isolado - Dizemos que um sistema termodinâmico é isolado quando não existe qualquer interação entre o sistema termodinâmico e a sua vizinhança. (ou seja, através das fronteiras não ocorre fluxo de calor, massa, trabalho etc. ) Capítulo – 1 - Termodinâmica Aplicada - pág - 3 1.2 - Estado e Propriedades de uma Substância Se considerarmos uma massa de água, reconhecemos que ela pode existir sob várias formas. Se é inicialmente líquida pode-se tornar vapor após aquecida ou sólida quando resfriada. Assim nos referimos às diferentes fases de uma substância: uma fase é definida como uma quantidade de matéria totalmente homogênea; quando mais de uma fase está presente, as fases se acham separadas entre si por meio dos contornos das fases. Em cada fase a substância pode existir a várias pressões e temperaturas ou, usando a terminologia da termodinâmica, em vários estados. O estado pode ser identificado ou descrito por certas propriedades macroscópicas observáveis; algumas das mais familiares são: temperatura, pressão, volume, etc. Cada uma das propriedades de uma substância num dado estado tem somente um valor definido e essa propriedade tem sempre o mesmo valor para um dado estado, independente da forma pela qual a substância chegou a ele. De fato, uma propriedade pode ser definida como uma quantidade que depende do estado do sistema e é independente do caminho (isto é, da história) pelo qual o sistema chegou ao estado considerado. Inversamente, o estado é especificado ou descrito pelas propriedades. Propriedades Termodinâmicas - As propriedades termodinâmicas podem ser divididas em duas classes gerais, as intensivas e as extensivas. Propriedade Extensiva - Chamamos de propriedade extensiva àquela que depende do tamanho (extensão) do sistema ou volume de controle. Assim, se subdividirmos um sistema em várias partes (reais ou imaginárias) e se o valor de uma dada propriedade for igual à soma das propriedades das partes, esta é uma variável extensiva. Por exemplo: Volume, Massa, etc. Propriedade Intensiva - Ao contrário da propriedade extensiva, a propriedade intensiva, independe do tamanho do sistema. Exemplo: Temperatura, Pressão etc. Propriedade Específica - Uma propriedade específica de uma dada substância é obtida dividindo-se uma propriedade extensiva pela massa da respectiva substância contida no sistema. Uma propriedade específica é também uma propriedade intensiva do sistema. Exemplo de propriedade específica: V Volume específico , ν , ν = M U Energia Interna específica , u, u = M onde: M é a massa do sistema, V o respectivo volume e U é a energia interna total do sistema. Capítulo – 1 - Termodinâmica Aplicada - pág - 4 1.3 - Mudança de Estado de um Sistema Termodinâmico Quando qualquer propriedade do sistema é alterada, por exemplo; Pressão, Temperatura, Massa, Volume, etc. dizemos que houve uma mudança de estado no sistema termodinâmico. Processo - O caminho definido pela sucessão de estados através dos quais o sistema passa é chamado processo. Exemplos de processos: - Processo Isobárico - Processo Isotérmico - Processo Isocórico (isométrico) - Processo Isoentálpico - Processo Isoentrópico - Processo Adiabático (pressão constante) (temperatura constante) (volume constante) (entalpia constante) (entropia constante) (sem transferência de calor) Ciclo Termodinâmico - Quando um sistema (substância), em um dado estado inicial, passa por certo número de mudança de estados ou processos e finalmente retorna ao estado inicial, o sistema executa um ciclo termodinâmico. Deve ser feita uma distinção entre ciclo termodinâmico, descrito acima, e um ciclo mecânico. Um motor de combustão interna de quatro tempos executa um ciclo mecânico a cada duas rotações. Entretanto o fluido de trabalho não percorreu um ciclo termodinâmico dentro do motor, uma vez que o ar e o combustível são queimados e transformados nos produtos de combustão, que são descarregados para a atmosfera. 1.4 - Lei Zero da Termodinâmica Quando dois corpos tem a mesma temperatura dizemos que estão em equilíbrio térmico entre si. Podemos definir a lei zero da termodinâmica como: " Se dois corpos estão em equilíbrio térmico com um terceiro eles estão em equilibrio térmico entre si ". A lei zero da termodinâmica define os medidores de temperatura, os TERMÔMETROS. Capítulo – 1 - Termodinâmica Aplicada - pág - 5 1.5 - Escalas de Temperatura Para a maior parte das pessoas a temperatura é um conceito intuitivo baseado nas sensações de "quente" e "frio" proveniente do tato. De acordo com a segunda lei da termodinâmica, a temperatura está relacionada com o calor ficando estabelecido que este, na ausência de outros efeitos, flui do corpo de temperatura mais alta para o de temperatura mais baixa espontaneamente. O funcionamento dos termômetros está baseada na lei zero da termodinâmica pois são colocados em contato com um corpo ou fluido do qual se deseja conhecer a temperatura até que este entre em equilíbrio térmico com o respectivo corpo. A escala do aparelho foi construída comparando-a com um termômetro padrão ou com pontos físicos fixos de determinadas substâncias. Quatro escalas de temperatura são hoje usadas para se referir à temperatura, duas escalas absolutas e duas escalas relativas; são elas respectivamente: Escala KELVIN (K) e RANKINE (°R) e escala Celsius (°C) e Fahrenheit (°F). A Fig. 1.5-1 mostra as quatro escalas de temperatura e a relação entre elas. Figura 1.5-1 - As escalas de temperatura e sua inter-relação Tipos de Termômetros - Termômetro de Mercúrio em vidro - Termômetro de Alcool em vidro - Termômetro de Par Bimetálico - Termômetro de Termistores - Termômetro de Gás Perfeito - Termômetro de Termopar - Pirômetro Ótico - etc. (expansão volumétrica) (expansão volumétrica) (dilatação linear diferenciada) (variação da resistividade) (expansão volumétrica) (força eletromotriz) (cor da chama) Capítulo – 1 - Termodinâmica Aplicada - pág - 6 Exemplo 1.5-1 Escreva a relação entre graus Celsius (oC) e Fahrenheit (oF) Solução - Considere-se a escala dos dois Termômetros, Celsius e Fahrenheit como mostrado na figura Interpolando linearmente as escalas entre a referência de gelo fundente e a referência de vaporização da água temos: C − 0 O F − 32 = → 100 − 0 212 − 32 O O C= 5 O ( F − 32) 9 1.6 - Pressão Pressão, uma propriedade termodinâmica, é definida como sendo a relação entre uma força e a área normal onde está sendo aplicada a força. A Fig. 1.6-1 ilustra a definição dada pela equação 1.6 -1 P= lim δA → δA i δ FN δA (1.6 -1) Figura 1.6-1 - Definição de Pressão Capítulo – 1 - Termodinâmica Aplicada - pág - 7 Unidades de Pressão Pascal, Pa = N m2 , Quilograma - força por metro quadrado, = Psig = lbf , (manométrica) in 2 kgf m2 Psia = lbf (absoluta) in 2 bar = 105 Pascal As pressões abaixo da pressão atmosférica e ligeiramente acima e as diferenças de pressão (como por exemplo, ao longo de um tubo, medidas através de um orifício calibrado) são obtidas freqüentemente com um manômetro em U que contém como fluido manométrico: água, mercúrio, Alcool, etc. como mostra a Fig. 1.6-2 Figura 1.6-2 manômetro em U usado junto com um orifício calibrado Pelos princípios da hidrostática podemos concluir que, para uma diferença de nível, L em metros, em um manômetro em U, a diferença de pressão em Pascal é dada pela relação : ∆P = ρ gL onde g é a aceleração da gravidade, em m/s2, ρ é a densidade do fluido manométrico, em kg/m3 e L é a altura da coluna de líquido, em m (metros) . OBS. A pressão atmosférica padrão é definida como a pressão produzida por uma coluna de mercúrio exatamente igual a 760 mm sendo a densidade do mercúrio de 13,5951 gm / cm3 sob a aceleração da gravidade padrão de 9,80665 m / s2 uma atmosfera padrão = 760 mmHg =101325 Pascal = 14,6959 lbf / in2 Capítulo – 1 - Termodinâmica Aplicada - pág - 8 Exemplo 1.6-1 Em uma análise para se obter o balanço térmico de um motor diesel é necessário medir-se a vazão de ar admitido pelo motor. Um orifício calibrado é montado em uma caixa de entrada junto com um manômetro em U na admissão do motor, como mostrado, • esquematicamente na figura. A vazão mássica do fluido escoando, m , em kg/m3 está • relacionada, em um orifício calibrado, pela seguinte expressão, m = A C D 2ρ ρ ∆P , onde ∆P é a diferença de pressão no manômetro em U , em Pascal, A é a área do orifício calibrado, em metros quadrados, CD é o coeficiente de descarga do orifício, cujo valor particular, para este caso é 0,59, ρ é a densidade do fluido em escoamento. Determinar a vazão de ar para os dados mostrados na figura. (Considere a aceleração gravitacional local igual a 9,81 m/s2 , a densidade do ar como sendo, ρ = 1,2 kg/m3 e a densidade da água do manômetro igual a 1000 kg/m3) Solução - Cálculo da diferença de Pressão indicada no manômetro em U: ∆P = ρ g L = 1000 • 9,81 • 0,260 = 2 550,6 Pa - Calculo da área do orifício calibrado. Dos dados da figura temos π d 2 3,14159 • ( 0,045) 2 A= = = 0, 00159 m 2 4 4 - A vazão em massa de ar admitida pelo motor diesel, pela expressão será • m AR = 0,00159 • 0,59 2 • 1,2 • 2.550,6 = 0,0734 kg s Capítulo – 1 - Termodinâmica Aplicada - pág - 9 Exercícios 1-1) Um manômetro montado em um recipiente indica uma pressão de 1,25MPa e um barômetro local indica 96kPa. Determinar a pressão interna absoluta do recipiente em: a) MPa , b) kgf/cm2, c) Psia e d) em milímetros de coluna de mercúrio. OBS.: Adote para o mercúrio a densidade de 13,6gm/cm3 1-2) Um termômetro, de liquido em vidro, indica uma temperatura de 30 oC. Determine a respectiva temperatura nas seguintes escalas: a) em graus Fahrenheit (oF) , b) em graus Rankine (oR) e c) em Kelvin (K). 1-3) Um manômetro contém um fluido com densidade de 816 kg/m3. A diferença de altura entre as duas colunas é 50 cm. Que diferença de pressão é indicada em kgf/cm2? Qual seria a diferença de altura se a mesma diferença de pressão fosse medida por um manômetro contendo mercúrio (adote densidade do mercúrio de 13,60 gm/cm3) 1-4) Um manômetro de mercúrio, usado para medir um vácuo, registra 731 mm Hg e o barômetro local registra 750 mm Hg. Determinar a pressão em kgf/cm2 e em microns. Capítulo - 2 PROPRIEDADES TERMODINÂMICAS Capítulo - 2 - Termodinâmica Aplicada - pág. - 2 2 - PROPRIEDADES DE UMA SUBSTÂNCIA PURA 2.1 - Substância Pura Substância pura é aquela que tem composição química invariável e homogênea. Pode existir em mais de uma fase, mas a sua composição química é a mesma em todas as fases. Assim água líquida e vapor d'água ou uma mistura de gelo e água líquida são todas substância puras, pois cada fase tem a mesma composição química. Por outro lado uma mistura de ar líquido e gasoso não é uma substância pura, pois a composição química da fase líquida é diferente daquela da fase gasosa. Neste trabalho daremos ênfase àquelas substâncias que podem ser chamadas de substância simples compressíveis. Por isso entendemos que efeitos de superfície, magnéticos e elétricos, não são significativos quando se trata com essas substâncias. Equilíbrio de Fase Líquido - Vapor - Considere-se como sistema 1 kg de água contida no conjunto êmbolo-cilindro como mostra a figura 2.1-1. Suponha que o peso do êmbolo e a pressão atmosférica local mantenham a pressão do sistema em 1,014 bar e que a temperatura inicial da água seja de 15 OC. À medida que se transfere calor para a água a temperatura aumenta consideravelmente e o volume específico aumenta ligeiramente (Fig. 2.1-1b) enquanto a pressão permanece constante. Figura 2.1-1 - Representação da terminologia usada para uma substância pura à pressão P e temperatura T, onde Tsat é a temperatura de saturação na pressão de saturação P. Quando a água atinge 100 OC uma transferência adicional de calor implica em uma mudança de fase como mostrado na Fig. 2.1-1b para a Fig. 2.1-1c, isto é, Capítulo - 2 - Termodinâmica Aplicada - pág. - 3 uma parte do líquido torna-se vapor e, durante este processo, a pressão permanecendo constante, a temperatura também permanecerá constante mas a quantidade de vapor gerada aumenta consideravelmente (aumentado o volume específico), como mostra a Fig. 2.1-1c. Quando a última porção de líquido tiver vaporizado (Fig. 2.1-1d) uma adicional transferência de calor resulta em um aumento da temperatura e do volume específico como mostrado na Fig. 2.1-1e e Fig. 2.1-1f Temperatura de saturação - O termo designa a temperatura na qual se dá a vaporização de uma substância pura a uma dada pressão. Essa pressão é chamada “pressão de saturação” para a temperatura dada. Assim, para a água (estamos usando como exemplo a água para facilitar o entendimento da definição dada acima) a 100 oC, a pressão de saturação é de 1,014 bar, e para a água a 1,014 bar de pressão, a temperatura de saturação é de 100 oC. Para uma substância pura há uma relação definida entre a pressão de saturação e a temperatura de saturação correspondente. Líquido Saturado - Se uma substância se encontra como líquido à temperatura e pressão de saturação diz-se que ela está no estado de líquido saturado, Fig.2.1-1b. Líquido Subresfriado - Se a temperatura do líquido é menor que a temperatura de saturação para a pressão existente, o líquido é chamado de líquido sub-resfriado (significa que a temperatura é mais baixa que a temperatura de saturação para a pressão dada), ou líquido comprimido, Fig. 2.1-1a, (significando ser a pressão maior que a pressão de saturação para a temperatura dada). Título (x) - Quando uma substância se encontra parte líquida e parte vapor, vapor úmido, Fig. 2.1-1c, a relação entre a massa de vapor pela massa total, isto é, massa de líquido mais a massa de vapor, é chamada título. Matematicamente: x= mv mv = ml + mv mt (2.1-1) Vapor Saturado - Se uma substância se encontra completamente como vapor na temperatura de saturação, é chamada “vapor saturado”, Fig. 2.1-1d, e neste caso o título é igual a 1 ou 100% pois a massa total (mt) é igual à massa de vapor (mv), (freqüentemente usa-se o termo “vapor saturado seco”) Vapor Superaquecido - Quando o vapor está a uma temperatura maior que a temperatura de saturação é chamado “vapor superaquecido” Fig. 2.1-1e. A pressão e a temperatura do vapor superaquecido são propriedades independentes, e neste caso, a temperatura pode ser aumentada para uma pressão constante. Em verdade, as substâncias que chamamos de gases são vapores altamente superaquecidos. A Fig. 2.1-1 retrata a terminologia que acabamos de definir para os diversos estados termodinâmicos em que se pode encontrar uma substância pura. Capítulo - 2 - Termodinâmica Aplicada - pág. - 4 Considerações importantes 1) Durante a mudança de fase de líquido-vapor à pressão constante, a temperatura se mantém constante; observamos assim a formação de patamares de mudança de fase em um diagrama de propriedades no plano T x v ou P x v, como mostrado na Fig. 2.2-1. Quanto maior a pressão na qual ocorre a mudança de Fase líquido-vapor maior será a temperatura. 2) Aumentando-se a pressão observa-se no diagrama que as linhas de líquido saturado e vapor saturado se encontram. O ponto de encontro dessas duas linhas define o chamado "Ponto Crítico". Pressões mais elevadas que a pressão do ponto crítico resultam em mudança de fase de líquido para vapor superaquecido sem a formação de vapor úmido. Figura 2.2-1 diagrama T x v e diagrama P x v 3) A linha de líquido saturado é levemente inclinada em relação à vertical pelo efeito da dilatação volumétrica (quanto maior a temperatura maior o volume ocupado pelo líquido), enquanto a linha de vapor saturado é fortemente inclinada em sentido contrário devido à compressibilidade do vapor. A Fig. 2.2-1b mostra o diagrama P -V no qual é fácil visualizar as linhas de temperatura constante e o ponto de inflexão da isoterma crítica Como exemplo, o ponto crítico para a água, é: Pcrítica = 22,09 MPa Tcrítica = 374,14 OC Vcritico = 0,003155 m3 / kg Ponto Triplo - Corresponde ao estado no qual as três fases (sólido, líquido e gasosa) se encontram em equilíbrio. A Fig. 2.3-1 mostra um diagrama de fases (P x T). Para qualquer outra substância o formato do diagrama é o mesmo. Capítulo - 2 - Termodinâmica Aplicada - pág. - 5 Uma substância na fase vapor com pressão acima da pressão do ponto triplo muda de fase (torna-se líquido) ao ser resfriada até a temperatura correspondente na curva de pressão de vapor. Resfriando o sistema ainda mais será atingida uma temperatura na qual o líquido irá se solidificar. Este processo está indicado pela linha horizontal 1→2→3 na Fig. 2.3-1. Para uma substância na fase sólida com pressão abaixo da pressão do ponto triplo ao ser aquecida observe que, mantendo a pressão constante, será atingida uma temperatura na qual ela passa da fase sólida diretamente para a fase vapor, sem passar pela fase líquida, como mostrado na Fig. 2.3-1 no processo 4→5. Como exemplo a pressão e a temperatura do ponto triplo para a água corresponde a 0,6113 kPa e 0,01 OC respectivamente. Figura 2.3-1 Diagrama de fases para a água (sem escala) 2.2 - Propriedades Independentes das Substâncias Puras Uma propriedade de uma substância é qualquer característica observável dessa substância. Um número suficiente de propriedades termodinâmicas independentes constituem uma definição completa do estado da substância. As propriedades termodinâmicas mais comuns são: temperatura (T), pressão (P), e volume específico (v) ou massa específica (ρ). Além destas propriedades termodinâmicas mais familiares, e que são diretamente mensuráveis , existem outras propriedades termodinâmicas fundamentais usadas na análise de transferência de energia (calor e trabalho), não mensuráveis diretamente, que são: energia interna específica (u), entalpia específica (h) e entropia específica (s). Energia Interna (U) - é a energia possuída pela matéria devido ao movimento e/ou forças intermoleculares. Esta forma de energia pode ser decomposta em duas partes: a - Energia cinética interna, a qual é devida à velocidade das moléculas e, b - Energia potencial interna, a qual é devida às forças de atração que existem entre as moléculas. As mudanças na velocidade das moléculas são identificadas macroscopicamente pela alteração da temperatura da substância (sistema), enquanto que as variações na posição são identificadas pela mudança de fase da substância (sólido, liquido ou vapor) Entalpia (H) - na análise térmica de alguns processos específicos, freqüentemente encontramos certas combinações de propriedades termodinâmicas. Uma dessas combinações ocorre quando temos um processo a Capítulo - 2 - Termodinâmica Aplicada - pág. - 6 pressão constante, resultando sempre uma combinação (U + PV). Assim considerou-se conveniente definir uma nova propriedade termodinâmica chamada “ENTALPIA”, representada pela letra H, determinada matematicamente pela relação: H=U+PV (2.2-1) h=u+Pν (2.2-2) ou a entalpia específica, Entropia (S) - Esta propriedade termodinâmica representa, segundo alguns autores, uma medida da desordem molecular da substância ou, segundo outros, a medida da probabilidade de ocorrência de um dado estado da substância. Matematicamente a definição de entropia é δ Q dS = T reversivel (2.2-3) 2.3 - Equações de Estado Equação de estado de uma substância pura é uma relação matemática que correlaciona pressão temperatura e volume específico para um sistema em equilíbrio termodinâmico. De uma maneira geral podemos expressar de forma genérica essa relação na forma da Eq. (2.3-1) f(P, v, T) = 0 (2.3 -1) Existem inúmeras equações de estado, muitas delas desenvolvidas para relacionar as propriedades termodinâmicas para uma única substância , outras mais genéricas, por vezes bastante complexas, com objetivo de relacionar as propriedades termodinâmicas de várias substâncias. Uma das equações de estado mais conhecida e mais simples é aquela que relaciona as propriedades termodinâmicas de pressão, volume específico e temperatura absoluta do gás ideal, que é; _ Pν=ℜT (2.3-2) _ onde P, é a pressão absoluta (manométrica + barométrica), em Pascal, ν , o volume molar específico, em m3/kmol, a constante universal do gás, que vale, ℜ = 8,314 kJ/kmol-K, e T a temperatura absoluta, em Kelvin. A Eq. (2.3-2) pode ser escrita de várias outras formas. Uma forma interessante é escreve-la usando o volume específico e a constante particular do gás, como na Eq. (2.3-3) Pν = RT (2.3-3) onde ν , é o volume específico do gás, em m3/kg e R é a constante particular do gás. O valor de R está relacionado à constante universal dos gases pela massa molecular da substância (M). Isto é: Capítulo - 2 - Termodinâmica Aplicada R= - ℜ M pág. - 7 (2.3-4) Como sabemos, a Eq. (2.3-2) ou (2.3-3) só representa satisfatoriamente gases reais a baixas pressões. Para gases reais a pressões um pouco mais elevadas e gases poliatômicos os resultados obtidos com a equação do gás ideal não é satisfatório, sendo necessário, para gás real, lançar mão de equações mais elaboradas. Exemplo 2.3-1 Considere o ar atmosférico como um gás ideal e determine o volume específico e a densidade para a pressão atmosférica padrão na temperatura de 20 oC. (adote a massa molecular do ar = 28,97 kg/kmol , ℜ = 8 314 J/ kmol-K) Solução Para a hipótese de gás ideal temos: P v = RT ⇒ v= RT P A constante particular do gás é dada por: R= ℜ M R= ⇒ 8314 28,97 ⇒ Ra r ≅ 287 J kg • K logo, o volume específico será a) v= 287 . (273,15 + 20) 101325 ≅ 0,8303 m3 kg A densidade é o inverso do volume específico, assim; b) ρ= 1 v = 1 = 1,204 0,8303 kg m3 A equação de estado para gás real mais antiga é a equação de van der Waals (1873) e foi apresentada como uma melhoria semi-teórica da equação de gases ideais, que na forma molar é; P= ℜT _ ν−b − a _2 ν (2.3-5) Capítulo - 2 - Termodinâmica Aplicada - pág. - 8 O objetivo da constante "b" na equação é corrigir o volume ocupado pelas _ 2 moléculas e o termo " a / ν " é uma correlação que leva em conta as forças intermoleculares de atração das moléculas. As constantes "a " e "b " são calculadas a partir do comportamento do gás. Estas constantes são obtidas observando-se que a isoterma crítica (Fig. 2.2b) tem um ponto de inflexão no ponto crítico e portanto nesse ponto a inclinação é nula [2] Os valores das constantes " a " e " b " são determinados em função das propriedades do ponto crítico, pressão crítica , PC, e temperatura crítica, TC, para cada gás. 27 ℜ 2 TC2 a= , 64 PC b= ℜ TC 8 PC (2.3-6) Uma outra equação, considerada mais precisa que a equação de van der Waals e com o mesmo nível de dificuldade é a equação de Redlich - kwong (1949), que para propriedades molares é: P= ℜT _ ν− b − a _ _ ν ( ν + b) T 1 (2.3-7) 2 Esta equação é de natureza empírica, as constantes "a " e " b " valem; 2 a 5 TC2 0,4278 , P b = 0, 08664 ℜ TC PC (2.3-8) Constantes para as equações de estado de van der Waals e de RedlichKwong para algumas substâncias são dadas na tabela 2.3 -1. As constantes dadas na tabela (2.3-1) são para pressão, P, em bar, volume _ específico molar, ν , em m3 / kmol e temperatura, T, em Kelvin Capítulo - 2 Tabela (2.3-1) - Termodinâmica Aplicada van der Waals 3 Substâncias Ar Butano (C4H10) Dióxido de carbono (CO2) Monóxido de carbono (CO) Metano (CH4) Nitrogênio (N2) Oxigênio (O2) Propano (C3H8) Refrigerante 12 Dióxido Sulfúrico (SO2) Vapor Água (H2O) - a, bar( m 2 ) kmol 1,368 13,860 3,647 1,474 2,293 1,366 1,369 9,349 10,490 6,883 5,531 3 b, m kmol 0,0367 0,1162 0,0428 0,0395 0,0428 0,0386 0,0317 0,0901 0,0971 0,0569 0,0305 pág. - 9 Redlich - Kwong m3 m 3 2 0, 5 b , a, bar( ) K kmol kmol 15,989 289,55 64,43 17,22 32,11 15,53 17,22 182,23 208,59 144,80 142,59 0,02541 0,08060 0,02963 0,02737 0,02965 0,02677 0,02197 0,06342 0,06731 0,03945 0,02111 Exemplo 2.3-2 Um tanque cilíndrico vertical contém 4,0 kg de monóxido de carbono gás à temperatura de -50 OC. O diâmetro interno do tanque é, D=0,2 m e o comprimento, L=1,0 m. Determinar a pressão, em bar, exercida pelo gás usando: a) O modelo de gás ideal, b) O modelo de van der Waals e c) O modelo de Redlich - Kwong Solução Conhecemos: Tanque cilíndrico de dimensões conhecidas contendo 4,0 kg de monóxido de carbono, CO, a - 50 OC Determinar: A pressão exercida pelo gás usando três modelos diferentes. Hipóteses: 1) Como mostrado na figura ao lado o gás é adotado como sistema fechado 2) O sistema está em equilíbrio termodinâmico Análise: O volume molar específico do gás é necessário nos três modelos requeridos, assim π d2L 3,14159 .(0,2) 2 . 1 V= = = 0,0314 m 3 4 4 o volume molar específico será: Capítulo - 2 - Termodinâmica Aplicada _ ν = Mν = M ( V m ) = 28( kmol )( kg - 0,0314 m 3 )( kg ) = 0,2198 4,0 pág. - 10 m3 kmol A equação de estado para o gás ideal resulta ℜT _ Pν=ℜT → P = = _ ν (8314)( −50 + 27315 , ) bar ( 5 ) = 84,41 bar 0,2198 10 Pa Para a Equação de estado de van der Waals as constantes " a " e " b " podem ser lidas diretamente da tabela 2.3-1, então; 3 3 a = 1,474 bar( m kmol ) 2 e b = 0, 0395( m kmol ) substituindo, ℜT P= _ ν−b − a _2 ν = (8314)( −50 + 27315 , ) bar 1,474 ( )− = 72,3 bar ( 0,2198 − 0,0395) 10 5 Pa ( 0,2198 ) 2 Também, para a equação de estado de Redlich-Kwong da tabela 2.3-1 1 m6 K 2 ) e b = 0, 02737 obtemos; a = 17,22 bar ( kmol 2 m3 kmol substituindo na respectiva equação temos; P= ℜT _ ν− b − a _ _ ν ( ν + b) T = 1 2 ( 8314)( −50 + 27315 , ) bar 17,22 ( 5 )− 1 ( 0,2198 − 0,02737) 10 Pa ( 0,21980)( 0,24717)( 22315 , )2 P = 75,2 bar Observação: Comparando os valores calculados de Pressão, a equação do modelo de gás ideal resulta em 11 % maior que a equação de van der Waals. Comparando o valor de Pressão obtido pela equação de van der Waals com dados obtidos do diagrama de compressibilidade (Shapiro [2]) este valor é 5% menor. O valor obtido pela modelo de Redlich-Kwong é 1% menor que o valor obtido no diagrama de compressibilidade. Um outro exemplo de equações de estado são as de Eq. (2.3-9) até (2.3-18) que são usada para relacionar as propriedades termodinâmicas dos refrigerantes hidrocarbonos fluorados (R-12, R-22,... etc.) [5] P= RT + v −b 5 ∑[ i=2 Ai + Bi T + Ci EXP (− kT / Tc ) A + B6T + C6 EXP (− kT / Tc ) ]+ 6 i ( v − b) (1 + c EXP (αv )) EXP (αv ) (2.3-9) Capítulo - 2 - Termodinâmica Aplicada - pág. - 11 5 Gi i A + (1 + kT / TC ) Ci EXP (− kT / Tc ) 1 1 (T − T0i ) − G5 ( − ) + ∑ [ i ]+ T T0 (i − 1)(v − b) (i − 1) i =1 i i =2 4 u = u0 + ∑ + A6 + (1 + kT / Tc ) C6 EXP (− kT / Tc ) α EXP (αv ) (2.3-10) h = u+ Pv (2.3-11) 4 s = s0 + G1 ln( T / T0 ) + ∑ Gi G 1 1 ( T ( i −1) − T0(i −1) ) − 5 ( 2 − 2 ) + 2 T T0 i = 2 (i − 1) 5 + R ln( v − b) − ∑ [ i=2 Bi − ( k / TC ) Ci EXP ( − kT / Tc ) B − ( k / Tc ) C6 EXP (− kT / Tc ) ]− 6 (2.3-12) ( i − 1) α EXP (αv ) (i − 1)( v − b ) ln Psat = F1 + F2 γ −T + F3 ln T + F4 T + F5 ( ) ln(γ − T ) T T (2.3-13) dP F − F F F γ ln(γ − T ) = F4 + 3 5 − 22 − 5 Psat dT sat T T T2 Hlv = T vlv ( dP ) dT sat T ρl = ∑ Di 1 − Tc i =1 5 slv = (2.3-15); i −1 3 (2.3-14) 1 Hlv T (2.3-16) T 2 T + D61 − + D7 1 − Tc Tc (2.3-17) vlv = vv − vl (2.3-18) 2 onde Ai , Bi ,Ci ,Di , Fi , Gi ,c, k, b, γ, α e Tc ,são constantes que dependem da substância. Muitos outros exemplos de Eqs. de estado, algumas mais simples outras mais complexas poderiam se apresentadas. Entretanto, dado a complexidade das equações de estado para correlacionar as propriedades termodinâmicas das substâncias reais seria interessante que tivéssemos um meio mais rápido para obter tais relações. As tabelas de propriedades termodinâmicas, obtidas através das equações de estado, são as ferramentas que substituem as equações. Capítulo - 2 - Termodinâmica Aplicada - pág. - 13 2.4 - Tabelas de Propriedades Termodinâmicas Existem tabelas de propriedades termodinâmicas para todos as substâncias de interesse em engenharia. Essas tabelas são obtidas através das equações de estado, do tipo mostrado anteriormente. As tabelas de propriedades termodinâmicas estão divididas em três categorias de tabelas, uma que relaciona as propriedades do líquido comprimido (ou líquido subresfriado), outra que relaciona as propriedades de saturação (líquido saturado e vapor saturado) e as tabelas de vapor superaquecido. Em todas as tabelas as propriedades estão tabeladas em função da temperatura ou pressão e em função de ambas como pode ser visto nas tabelas a seguir. Para a região de liquido+vapor, (vapor úmido) conhecido o título, x, as propriedades devem ser determinadas através das seguintes equações: u = uL + x(uv - uL) (2.4-1) h = hL + x(hv - h L) (2.4-2) v = vL + x(vv - vL) (2.4-3) s = sL + x(sv - sL) (2.4-4) As tabelas de (2.4-1) até (2.4-12) são exemplos de tabelas de propriedades termodinâmicas de líquido comprimido, saturadas e superaquecidas de qualquer substância. Observe nessas tabelas que para condições de saturação basta conhecer apenas uma propriedade para obter as demais, que pode ser temperatura ou pressão, propriedades diretamente mensuráveis. Para as condições de vapor superaquecido e líquido comprimido é necessário conhecer duas propriedades para ser obter as demais. Nas tabelas de propriedades saturadas, aqui apresentadas, pode-se observar que para temperatura de 0,0 oC e líquido saturado (x = 0), o valor numérico de entalpia (h) é igual a 100,00 kcal/kg para os refrigerantes R-12, R-22, e R-717, sendo igual a 200,00 kJ/kg para o R134a, e a entropia (S), vale 1,000 para todas as tabelas dadas independente das unidades usadas. Estes valores são adotados arbitrariamente como valores de referência e os demais valores de entalpia (h) e entropia (S), são calculados em relação a esses valores de referência. Outros autores podem construir tabelas dos mesmos refrigerantes com referências diferentes. Quando as referências são diferentes, como dissemos, as propriedades têm outros valores nessas tabelas, entretanto, a diferença entre mesmos estados é igual para qualquer referência adotada. Assim, o valor numérico da entalpia (h), e entropia (S) em diferentes tabelas podem apresentar valores completamente diferentes para o mesmo estado termodinâmico, sem contudo, modificar os resultados de nossas análises térmicas, bastando para tanto que se utilize dados de entalpia e entropia de uma mesma tabela, ou de tabelas que tenham a mesma referência. Para dados retirados de duas ou mais tabelas com referências diferentes estes devem ser devidamente corrigidos para uma única referência. Capítulo - 2 - Termodinâmica Aplicada - pág. - 14 Tabela (2.4-1) Propriedades da Água Saturada (Líquido-Vapor) Tabela de Pressão Volume Específico m3 /kg Pres. Temp Líquid Vapor Sat. Sat. o C vL x103 bar vG Energia Interna kJ/kg Líquid Vapor Sat. Sat. uL uG Entalpia kJ/kg Líquid LíquiVapor Sat. Vapor Sat. hL hLG hG Entropia kJ/kg.K Líquid Vapor Sat. Sat. sL sG 0,04 0,06 0,08 0,10 0,20 28,96 36,16 41,51 45,81 60,06 1,0040 1,0064 1,0084 1,0102 1,0172 34,800 23,739 18,103 14,674 7,649 121,45 151,53 173,87 191,82 251,38 2415,2 2425,0 2432,2 2437,9 2456,7 121,46 151,53 173,88 191,83 251,40 2432,9 2415,9 2403,1 2392,8 2358,3 2554,4 2567,4 2577,0 2584,7 2609,7 0,4226 0,5210 0,5926 0,6493 0,8320 8,4746 8,3304 8,2287 8,1502 7,9085 0,30 0,40 0,50 0,60 0,70 69,10 75,87 81,33 85,94 89,95 1,0223 1,0265 1,0300 1,0331 1,0360 5,229 3,993 3,240 2,732 2,365 289,20 317,53 340,44 359,79 376,63 2468,4 2477,0 2483,9 2489,6 2494,5 289,23 317,58 340,49 359,86 376,70 2336,1 2319,2 2305,4 2293,6 2283,3 2625,3 2636,8 2645,9 2653,5 2660,0 0,9439 1,0259 1,0910 1,1453 1,1919 7,7686 7,6700 7,5939 7,5320 7,4797 0,80 0,90 1,00 1,50 2,00 93,50 96,71 99,63 111,4 120,2 1,0380 1,0410 1,0432 1,0528 1,0605 2,087 1,869 1,694 1,159 0,8857 391,58 405,06 417,36 466,94 504,49 2498,8 2502,6 2506,1 2519,7 2529,5 391,66 405,15 417,46 467,11 504,70 2274,1 2265,7 2258,0 2226,5 2201,9 2665,8 2670,9 2675,5 2693,6 2706,7 1,2329 1,2695 1,3026 1,4336 1,5301 7,4346 7,3949 7,3594 7,2233 7,1271 2,50 3,00 3,50 4,00 4,50 127,4 133,6 138,9 143,6 147,9 1,0672 1,0732 1,0786 1,0836 1,0882 0,7187 0,6058 0,5243 0,4625 0,4140 535,10 561,15 583,95 604,31 622,25 2537,2 2543,6 2546,9 2553,6 2557,6 535,37 561,47 584,33 604,74 623,25 2181,5 2163,8 2148,1 2133,8 2120,7 2716,9 2725,3 2732,4 2738,6 2743,9 1,6072 1,6718 1,7275 1,7766 1,8207 7,0527 6,9919 6,9405 6,8959 6,8565 5,00 6,00 7,00 8,00 9,00 151,9 158,9 165,0 170,4 175,4 1,0926 1,1006 1,1080 1,1148 1,1212 0,3749 0,3157 0,2729 0,2404 0,2150 639,68 669,90 696,44 720,22 741,83 2561,2 2567,4 2572,5 2576,8 2580,5 640,23 670,56 697,22 721,11 742,83 2108,5 2086,3 2066,3 2048,0 2031,1 2748,7 2756,8 2763,5 2769,1 2773,9 1,8607 1,9312 1,9922 2,0462 2,0946 6,8212 6,7600 6,7080 6,6628 6,6226 10,0 15,0 20,0 25,0 30,0 179,9 198,3 212,4 224,0 233,9 1,1273 1,1539 1,1767 1,1973 1,2165 0,1944 0,1318 0,0996 0,0800 0,0667 761,68 843,16 906,44 959,11 1004,8 2583,6 2594,5 2600,3 2603,1 2604,1 762,81 844,84 908,79 962,11 1008,4 2015,3 1947,3 1890,7 1841,0 1795,7 2778,1 2792,2 2799,5 2803,1 2804,2 2,1387 2,3150 2,4474 2,5547 2,6457 6,5863 6,4448 6,3409 6,2575 6,1869 35,0 40,0 45,0 50,0 60,0 242,6 250,4 257,5 264,0 275,6 1,2347 1,2522 1,2692 1,2859 1,3187 0,0571 0,0498 0,0441 0,0394 0,0324 1045,4 1082,3 1116,2 1147,8 1205,4 2603,7 2602,3 2600,1 2597,1 2589,7 1049,8 1087,3 1121,9 1154,2 1213,4 1753,7 1714,1 1676,4 1640,1 1571,0 2803,4 2801,4 2798,3 2794,3 2784,3 2,7253 2,7964 2,8610 2,9202 3,0267 6,1253 6,0701 6,0199 5,9734 5,8892 70,0 80,0 90,0 100,0 110,0 285,9 295,1 303,4 311,1 318,2 1,3513 1,3842 1,4178 14,524 14,886 0,0274 0,0235 0,0205 0,0180 0,0160 1257,6 1305,6 1350,5 1393,0 1433,7 2580,5 2569,8 2557,8 2544,4 2529,8 1267,0 1316,6 1363,3 1407,6 1450,1 1505,1 1441,3 1378,9 1317,1 1255,5 2772,1 2758,0 2742,1 2724,7 2705,6 3,1211 3,2068 3,2858 3,3596 3,4295 5,8133 5,7432 5,6772 56,141 55,527 Capítulo - 2 - Termodinâmica Aplicada - pág. - 15 Tabela (2.4-2) - Propriedades da Água Saturada (Líquido-Vapor) Tabela de Temperatura Volume Energia Específico Interna Entalpia Entropia m3 /kg kJ/kg kJ/kg kJ/kg.K Temp Press. Líquid Vapor Líquid Vapor Líquid Líqui- Vapor Líquid Vapor Sat. Sat. Sat. Sat. Sat. Vapor Sat. Sat. Sat. o C bar vL x103 vG uL uG hL hLG hG sL sG 0,01 5 10 15 20 0,00611 0,00872 0,01228 0,01705 0,02339 1,0002 1,0001 1,0004 1,0009 1,0018 206,136 147,120 106,379 77,926 57,791 0,00 20,97 42,00 62,99 83,95 2375,3 2382,3 2389,2 2396,1 2402,9 0,01 20,98 42,01 62,99 83,96 2501,3 2489,6 2477,7 2465,9 2454,1 2501,4 2510,6 2519,8 2528,9 2538,1 0,0000 0,0761 0,1510 0,2245 0,2966 9,1562 9,0257 8,9008 8,7814 8,6672 25 30 35 40 45 0,03169 0,04246 0,05628 0,07384 0,09593 1,0029 1,0043 1,0060 1,0078 1,0099 43,360 32,894 25,216 19,523 15,258 104,88 125,78 146,67 167,56 188,44 2409,8 2416,6 2423,4 2430,1 2436,8 104,89 125,79 146,68 167,57 188,45 2442,3 2430,5 2418,6 2406,7 2394,8 2547,2 2556,3 2565,3 2574,3 2583,2 0,3674 0,4369 0,5053 0,5725 0,6387 8,5580 8,4533 8,3531 8,2570 8,1648 50 55 60 65 70 0,1235 0,1576 0,1994 0,2503 0,3119 1,0121 1,0146 1,0172 1,0199 1,0228 12,032 9,568 7,671 6,197 5,042 209,32 230,21 251,11 272,02 292,95 2443,5 2450,1 2456,6 2463,1 2469,6 209,33 230,23 251,13 272,06 292,98 2382,7 2370,7 2358,5 2346,2 2333,8 2592,1 2600,9 2609,6 2618,3 2626,8 0,7038 0,7679 0,8312 0,8935 0,9549 8,0763 7,9913 7,9096 7,8310 7,7553 75 80 85 90 95 0,3858 0,4739 0,5783 0,7014 0,8455 1,0259 1,0291 1,0325 1,0360 1,0397 4,131 3,407 2,828 2,361 1,982 313,90 334,86 355,84 376,85 397,88 2475,9 2482,2 2488,4 2494,5 2500,6 313,93 334,91 355,90 376,92 397,96 2321,4 2308,8 2296,0 2283,2 2270,2 2635,3 2643,7 2651,9 2660,1 2668,1 1,0155 1,0753 1,1343 1,1925 1,2500 7,6824 7,6122 7,5445 7,4791 7,4159 100 110 120 130 140 1,014 1,433 1,985 2,701 3,613 1,0435 1,0516 1,0603 1,0697 1,0797 1,673 1,210 0,8919 0,6685 0,5089 418,94 461,14 503,50 546,02 588,74 2506,5 2518,1 2529,3 2539,9 2550,0 419,04 461,30 503,71 546,31 589,13 2257,0 2230,2 2202,6 2174,2 2144,7 2676,1 2691,5 2706,3 2720,5 2733,9 1,3069 1,4185 1,5276 1,6344 1,7391 7,3549 7,2387 7,1296 7,0269 6,9299 150 160 170 180 190 4,758 6,178 7,917 10,02 12,54 1,0905 1,1020 1,1143 1,1274 1,1414 0,3928 0,3071 0,2428 0,1941 0,1565 631,68 674,86 718,33 762,09 806,19 2559,5 2568,4 2576,5 2583,7 2590,0 632,20 675,55 719,21 763,22 807,62 2114,3 2082,6 2049,5 2015,0 1978,8 2746,5 2758,1 2768,7 2778,2 2786,4 1,8418 1,9427 2,0419 2,1396 2,2359 6,8379 6,7502 6,6663 6,5857 6,5079 200 220 240 260 280 15,54 23,18 33,44 46,88 64,12 1,1565 1,1900 1,2291 1,2755 1,3321 0,1274 0,08619 0,05976 0,04221 0,03017 850,65 940,87 1033,2 1128,4 1227,5 2595,3 2602,4 2604,0 2599,0 2586,1 852,45 943,62 1037,3 1134,4 1236,0 1940,7 1858,5 1766,5 1662,5 1543,6 2793,2 2802,1 2803,8 2796,6 2779,6 2,3309 2,5178 2,7015 2,8838 3,0668 6,4323 6,2861 6,1437 6,0019 5,8571 300 320 340 360 374,14 85,81 112,7 145,9 186,5 220,9 1,4036 1,4988 1,6379 1,8925 3,1550 0,02167 0,01549 0,01080 0,00695 0,00316 1332,0 1444,6 1570,3 1725,2 2029,6 2563,0 2525,5 2464,6 2351,5 2029,6 1344,0 1461,5 1594,2 1760,5 2099,3 1404,9 1238,6 1027,9 720,5 0,0 2749,0 2700,1 2622,0 2481,0 2099,3 3,2534 3,4480 3,6594 3,9147 4,4298 5,7045 5,5362 5,3357 5,0526 4,4298 Capítulo - 2 - Termodinâmica Aplicada - pág. - 16 Tabela (2.4-3) Propriedades do Vapor de Água Superaquecida (Resumida) Pressão = 0,010 MPa Pressão = 0,100 MPa Pressão = 0,500 MPa o o o Temperatura de Sat.(45,81 C) Temperatura de Sat.(99,62 C) Temperatura de Sat.(151,86 C) Temperatura Volume Volume Volume Específic Entalpia Específic Entalpia Entropia Entropia Específic Entalpia Entropia o o o h s h h s s ↓ v O C Sat. 100 150 200 250 300 400 500 600 700 800 900 1000 1100 1200 3 v 3 v 3 m /kg kJ/kg kJ/kg.K m /kg kJ/kg kJ/kg.K m /kg kJ/kg kJ/kg.K 14,6736 17,1956 19,5125 21,8251 24,1356 26,4451 31,0625 35,6790 40,2949 44,9105 49,5260 54,1414 58,7567 63,3720 67,9872 2584,63 2687,50 2782,99 2879,52 2977,31 3076,51 3279,51 3489,05 3705,40 3928,73 4159,10 4396,44 4640,58 4891,19 5147,78 8,1501 8,4479 8,6881 8,9037 9,1002 9,2812 9,6076 9,8977 10,161 10,403 10,628 10,840 11,039 11,229 11,409 1,69400 -------1,93636 2,17226 2,40604 2,63876 3,10263 3,56547 4,02781 4,48986 4,95174 5,41353 5,87526 6,33696 6,79863 2675,46 -------2776,38 2875,27 2974,33 3074,28 3278,11 3488,09 3704,72 3928,23 4158,71 4396,12 4640,31 4890,95 5147,56 7,3593 -------7,6133 7,8342 8,0332 8,2157 8,5434 8,8341 9,0975 9,3398 9,5652 9,7767 9,9764 10,1658 10,3462 0,37489 --------------0,42492 0,47436 0,52256 0,61728 0,71093 0,80406 0,89691 0,98959 1,08217 1,17469 1,26718 1,35964 2748,67 --------------2855,37 2960,68 3064,20 3271,83 3483,82 3701,67 3925,97 4156,96 4394,71 4639,11 4889,88 5146,58 6,8212 --------------7,0592 7,2708 7,4598 7,7937 8,0872 8,3521 8,5952 8,8211 9,0329 9,2328 9,4224 9,6028 Temperatura Pressão = 1,00 MPa o O Temperatura de Sat.(179,91 C) ↓ C 0,19444 2778,08 6,5864 Sat. 0,20596 2827,86 6,6939 200 0,25794 3051,15 7,1228 300 0,30659 3263,88 7,4650 400 0,35411 3478,44 7,7621 500 0,40109 3697,85 8,0289 600 0,44779 3923,14 8,2731 700 0,49432 4154,78 8,4996 800 0,54075 4392,94 8,7118 900 0,58712 4637,60 8,9119 1000 0,63345 4888,55 9,1016 1100 0,67977 5145,36 9,2821 1200 Pressão = 2,00 MPa Pressão = 4,00 MPa o o Temperatura de Sat.(212,42 C) Temperatura de Sat.(250,40 C) 0,09963 2799,51 6,3408 0,04978 2801,36 6,0700 ------------------------------0,12547 3023,50 6,7663 0,05884 2960,68 6,3614 0,15120 3247,60 7,1270 0,07341 3213,51 6,7689 0,17568 3467,55 7,4316 0,08643 3445,21 7,0900 0,19960 3690,14 7,7023 0,09885 3674,44 7,3688 0,22323 3917,45 7,9487 0,11095 3905,94 7,6198 0,24668 4150,40 8,1766 0,12287 4141,59 7,8502 0,27004 4389,40 8,3895 0,13469 4382,34 8,0647 0,29333 4634,61 8,5900 0,14645 4628,65 8,2661 0,31659 4885,89 8,7800 0,15817 4880,63 8,4566 0,33984 5142,92 8,9606 0,16987 5138,07 8,6376 Pressão = 6,00 MPa Temperatura o O Temperatura de Sat.(275,64 C) ↓ C 0,03244 2784,33 5,8891 Sat. 0,03616 2884,19 6,0673 300 0,04223 3042,97 6,3334 350 0,04739 3177,17 6,5407 400 0,05214 3301,76 6,7192 450 0,05665 3422,12 6,8802 500 0,06525 3266,89 7,1676 600 0,07352 3894,28 7,4234 700 0,08160 4132,74 7,6566 800 0,08958 4375,29 7,8727 900 0,09749 4622,74 8,0751 1000 0,10536 4875,42 8,2661 1100 0,11321 5133,28 8,4473 1200 Pressão = 8,00 MPa Pressão = 10,00 MPa o o Temperatura de Sat.(295,06 C) Temperatura de Sat.(311,06 C) 0,02352 0,02426 0,02995 0,03432 0,03817 0,04175 0,04845 0,05481 0,06097 0,06702 0,07301 0,07896 0,08489 2757,94 2784,98 2987,30 3138,28 3271,99 3398,27 3642,03 3882,47 4123,84 4368,26 4616,87 4870,25 5128,54 5,7431 5,7905 6,1300 6,3633 6,5550 6,7239 7,0205 7,2812 7,5173 7,7350 7,9384 8,1299 8,3115 0,01803 -----0,02242 0,02641 0,02975 0,03279 0,03837 0,04358 0,04859 0,05349 0,05832 0,06312 0,06789 2724,67 -----2923,39 3096,46 3240,83 3373,63 3625,34 3870,52 4114,91 4361,24 4611,04 4865,14 5123,84 5,6140 -----5,9442 6,2119 6,4189 6,5965 6,9028 7,1687 7,4077 7,6272 7,8315 8,0236 8,2054 Referência " Fundamentals of Thermodynamics" - Fith Edition - R. E. Sonntag, C. Borgnakke and G. J. Van Wylen - 1998 Capítulo - 2 - Termodinâmica Aplicada - pág. - 17 Tabela (2.4-4) Propriedades da Água Subresfriada ou Líquido Comprimido (Resumida) Pressão = 2,50 MPa Pressão = 5,00 MPa Pressão = 7,50 MPa o o o Temperatura de Sat.(223,29 C) Temperatura de Sat.(263,99 C) Temperatura de Sat.(290,59 C) Temperatura Volume Volume Volume Específic Entalpia Entropia Específic Entalpia Entropia Específic Entalpia Entropia o o o h s h s h s ↓ 3 3 3 v x 10 O C 0 20 40 80 100 140 180 200 220 260 Sat. 3 v x 10 m /kg kJ/kg ------1,001 1,007 1,028 1,042 1,078 1,126 1,156 1,190 -----1,1973 -----86,30 169,77 336,86 420,85 590,52 763,97 852,80 943,70 -----962,10 3 kJ/kg.K m /kg ------0,2961 0,5715 1,0737 1,3050 1,7369 2,1375 2,3294 2,5174 -----2,5546 0,998 1,000 1,006 1,027 1,041 1,077 1,124 1,153 1,187 1,275 1,286 v x 10 kJ/kg 5,02 88,64 171,95 338,83 422,71 592,13 765,24 853,85 944,36 1134,30 1154,21 kJ/kg.K 0,0001 0,2955 0,5705 1,0719 1,3030 1,7342 2,1341 2,3254 2,5128 2,8829 2,9201 3 m /kg -----0,998 1,004 1,026 1,040 1,075 1,122 -----1,184 1,270 1,368 kJ/kg kJ/kg.K ------83,50 166,64 333,15 416,81 585,72 758,13 -----936,2 1124,4 1282,0 -----0,2950 0,5696 1,0704 1,3011 1,7317 2,1308 -----2,5083 2,8763 3,1649 Temperatura Pressão = 10,00 MPa Pressão = 15,00 MPa Pressão = 20,00 MPa o o o O Temperatura de Sat.(311,06 C) Temperatura de Sat.(342,24 C) Temperatura de Sat.(365,81 C) ↓ C 0,995 10,05 0,0003 0,993 15,04 0,0004 0,990 20,00 0,0004 0 1,003 176,36 0,5685 1,001 180,75 0,5665 0,999 185,14 0,5646 40 1,025 342,81 1,0687 1,022 346,79 1,0655 1,020 350,78 1,0623 80 1,039 426,48 1,2992 1,036 430,26 1,2954 1,034 434,04 1,2917 100 1,074 595,40 1,7291 1,071 598,70 1,7241 1,068 602,03 1,7192 140 1,120 767,83 2,1274 1,116 770,48 2,1209 1,112 773,18 2,1146 180 1,148 855,97 2,3178 1,143 858,18 2,3103 1,139 860,47 2,3031 200 1,219 1025,94 2,6872 1,211 1038,99 2,6770 1,205 1040,04 2,6673 240 1,322 1234,11 3,0547 1,308 1232,09 3,0392 1,297 1230,62 3,0248 280 1,397 1342,31 3,2468 1,377 1337,23 3,2259 1,360 1333,29 3,2071 300 ---------------1,472 1453,13 3,4246 1,444 1444,53 3,3978 320 ---------------1,631 1591,88 3,6545 1,568 1571,01 3,6074 340 1,452 1407,53 3,3595 1,658 1610,45 3,6847 2,035 1826,18 4,0137 Sat. Pressão = 25,00 MPa Pressão = 30,00 MPa Pressão = 50,00 MPa Temperatura O Pressão acima do ponto Crítico Pressão acima do ponto Crítico Pressão acima do ponto Crítico ↓ C ---------------0,986 29,82 0,0001 0,977 49,03 -0,0014 0 0,9907 82,47 0,2911 0,989 111,82 0,2898 0,980 130,00 0,2847 20 0,9971 164,60 0,5626 0,995 193,87 0,5606 0,987 211,20 0,5526 40 ---------------1,016 358,75 1,5061 1,007 374,68 1,0439 80 1,0313 412,08 1,2881 1,029 441,63 1,2844 1,020 456,87 1,2703 100 ---------------1,062 608,73 1,7097 1,052 622,33 1,6915 140 ---------------1,105 778,71 2,1024 1,091 790,24 2,0793 180 1,1344 834,5 2,2961 1,130 865,24 2,2892 1,115 875,46 2,2634 200 ---------------1,192 1042,60 2,6489 1,170 1049,20 2,6158 240 ---------------1,275 1228,96 2,9985 1,242 1229,26 2,9536 280 1,3442 1296,6 3,1900 1,330 1327,80 3,1740 1,286 1322,95 3,1200 300 ---------------1,400 1432,63 3,3538 1,339 1420,17 3,2867 320 ---------------1,492 1546,47 3,5425 1,430 1522,07 3,4556 340 ---------------1,627 1675,36 3,7492 1,484 1630,16 3,6290 360 Referência " Fundamentals of Thermodynamics" - Fith Edition - R. E. Sonntag, C. Borgnakke and G. J. Van Wylen 1998 Capítulo - 2 - Termodinâmica Aplicada - pág. - 18 TABELA (2.4-5) Propriedades de Saturação - REFRIGERANTE - R-12 (Resumida) TEMP. o PRES. VOLUME ESPECÍFICO Líquido Vapor m3/kg m3/kg 3 vL x 10 vv ENTALPIA ESPECÍFICA Líquido Líq-vap Vapor kcal/kg kcal/kg kcal/kg hL h LV hv ENTROPIA ESPECÍFICA Líquido kcal/kg.K SL Vapor kcal/kg.K SV TEMP. C kgf/cm2 -40,0 -36,0 -32,0 -30,0 -28,0 0,6544 0,7868 0,9394 1,0239 1,1142 0,6595 0,6644 0,6694 0,6720 0,6746 0,2419 0,2038 0,1727 0,1594 0,1473 91,389 92,233 93.081 93,506 93,931 40,507 40,104 39,696 39,490 39,282 131,896 132,337 132,776 132,995 133,213 0,96610 0,96968 0,97321 0,97496 0,97670 1,13982 1,13877 1,13781 1,13736 1,13692 -40,0 -36,0 -32,0 -30,0 -28,0 -26,0 -24,0 -22,0 -20,0 -18,0 1,2107 1,3134 1,4228 1,5391 1,6626 0,6772 0,6799 0,6827 0,6854 0,6883 0,1363 0,1263 0,1172 0,1088 0,1012 94,358 94,786 95,215 95,644 96,075 39,073 38,862 38,649 38,435 38,219 133,431 133,648 133,864 134,079 134,294 0,97842 0,98014 0,98185 0,98354 0,98523 1,13651 1,13611 1,13573 1,13536 1,13501 -26,0 -24,0 -22,0 -20,0 -18,0 -16,0 -14,0 -12,0 -10,0 -8,0 1,7936 1,9323 2,0792 2,2344 2,3983 0,6911 0,6940 0,6970 0,7000 0,7031 0,0943 0,0879 0,0820 0,0766 0,0717 96,506 96,939 97,373 97,808 98,244 38,001 37,781 37,559 37,335 37,109 134,507 134,720 134,932 135,143 135,352 0,98691 0,98857 0,99023 0,99188 0,99352 1,13468 1,13435 1,13405 1,13375 1,13347 -16,0 -14,0 -12,0 -10,0 -8,0 -6,0 -4,0 -2,0 0,0 2,0 2,5712 2,7534 2,9452 3,1469 3,3590 0,7062 0,7094 0,7126 0,7159 0,7192 0,0671 0,0629 0,0590 0,0554 0,0520 98,681 99,119 99,559 100,00 100,44 36,880 36,649 36,416 36,180 35,942 135,561 135,769 135,975 136,180 136,384 0,99515 0,99678 0,99839 1,00000 1,00160 1,13320 1,13294 1,13269 1,13245 1,13222 -6,0 -4,0 -2,0 0,0 2,0 4,0 6,0 8,0 10,0 12,0 3,5816 3,8152 4,0600 4,3164 4,5848 0,7226 0,7261 0,7296 0,7333 0,7369 0,0490 0,0461 0,0434 0,0409 0,0386 100,89 101,33 101,78 102,23 102,68 35,700 35,456 35,209 34,959 34,705 136,586 136,787 136,987 137,185 137,382 1,00319 1,00478 1,00636 1,00793 1,00950 1,13200 1,13179 1,13159 1,13139 1,13120 4,0 6,0 8,0 10,0 12,0 14,0 16,0 18,0 20,0 22,0 4,8655 5,1588 5,4651 5,7848 6,1181 0,7407 0,7445 0,7484 0,7524 0,7565 0,0364 0,0344 0,0325 0,0308 0,0291 103,13 103,58 104,04 104,50 104,96 34,448 34,188 33,924 33,656 33,383 137,577 137,770 137,961 138,151 138,338 1,01106 1,01262 1,01417 1,01572 1,01726 1,13102 1,13085 1,13068 1,13052 1,13036 14,0 16,0 18,0 20,0 22,0 26,0 30,0 34,0 38,0 40,0 6,8274 7,5959 8,4266 9,3225 9,7960 0,7650 0,7738 0,7831 0,7929 0,7980 0,0261 0,0235 0,0212 0,0191 0,0182 105,88 106,82 107,76 108,72 109,20 32,826 32,251 31,655 31,037 30,719 138,707 139,067 139,418 139,757 139,922 1,02034 1,02340 1,02645 1,02949 1,03101 1,13006 1,12978 1,12950 1,12923 1,12910 26,0 30,0 34,0 38,0 40,0 44,0 48,0 52,0 56,0 60,0 10,796 11,869 13,018 14,247 15,560 0,8086 0,8198 0,8318 0,8445 0,8581 0,0164 0,0149 0,0135 0,0122 0,0111 110,18 111,17 112,18 113,21 114,26 30,062 29,377 28,660 27,907 27,114 140,244 140,551 140,842 141,116 141,371 1,03405 1,03710 1,04015 1,04322 1,04630 1,12884 1,12857 1,12829 1,12800 1,12768 44,0 48,0 52,0 56,0 60,0 70,0 80,0 90,0 100,0 112,0 19,230 23,500 28,435 34,100 41,966 0,8971 0,9461 1,0119 1,1131 1,7918 0,0087 0,0068 0,0053 0,0039 0,0018 116,98 119,91 123,12 126,81 135,21 24,918 22,317 19,098 14,763 0,0 141,900 142,223 142,216 141,576 135,205 1,05414 1,06227 1,07092 1,08057 1,10199 1,12675 1,12546 1,12351 1,12013 1,10199 70,0 80,0 90,0 100,0 112,0 o C Capítulo - 2 - Termodinâmica Aplicada - pág. - 19 Tabela (2.4-6) Propriedades do Vapor Superaquecido Refrigerante - R -12 (Resumida) 2 Temperatura ↓ O C Sat. -15,0 -10,0 -5,0 0,0 5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0 45,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 120,0 Temperatura O ↓ C Sat. 35,0 40,0 45,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 120,0 130,0 Temperatura O ↓ C 60,0 70,0 80,0 90,0 100,0 110,0 120,0 130,0 2 Pressão = 1,5391 kgf/cm Pressão = 2,2344 kgf/cm o o Temperatura de Sat.(- 20 C) Temperatura de Sat.(-10 C) Volume Volume Específic Entalpia Entropia Específic Entalpia Entropia o o h s s h v 3 v m /kg 3 kcal/kg kcal/kg.K m /kg kcal/kg kcal/kg.K 0,1088 0,1115 0,1141 0,1167 0,1192 0,1217 0,1242 0,1267 0,1292 0,1317 0,1341 0,1366 0,1390 0,1414 0,1438 0,1486 0,1534 0,1582 0,1629 0,1676 0,1723 0,1770 134,079 134,79 135,51 136,23 136,96 137,68 138,42 139,15 139,89 140,63 141,38 142,13 142,89 143,65 144,41 145,95 147,51 149,08 150,67 152,27 153,90 155,53 135,14 ----------135,89 136,63 137,38 138,12 138,88 139,63 140,39 141,15 141,91 142,67 143,44 144,22 145,77 147,34 148,93 150,53 152,14 153,77 155,42 1,1354 1,1382 1,1409 1,1436 1,1463 1,1489 1,1515 1,1541 1,1564 1,1592 1,1617 1,1641 1,1665 1,1690 1,1713 1,1760 1,1806 1,1852 1,1896 1,1940 1,1982 1,2025 2 0,0766 ----------0,0785 0,0804 0,0822 0,0840 0,0858 0,0876 0,0894 0,01911 0,0929 0,0946 0,0963 0,0980 0,1014 0,1048 0,1081 0,114 0,1147 0,1180 0,1213 1,1338 ----------1,1365 1.1393 1,1420 1,1447 1,1473 1,1499 1,1525 1,1550 1,1575 1,1599 1,1624 1,1648 1,1695 1,1742 1,1787 1,1832 1,1876 1,1919 1,1961 2 Pressão = 4,31647 kgf/cm o Temperatura de Sat.(+10 C) Pressão = 7,5959 kgf/cm o Temperatura de Sat.(30 C) 0,0409 0,0461 0,0471 0,0480 0,0490 0,0509 0,0528 0,0546 0,0564 0,0582 0,0600 0,0617 0,0635 0,0235 0,0242 0,0249 0,0255 0,0262 0,0274 0,0286 0,0297 0,0309 0,0320 0,0331 0,0341 0,0352 137,185 141,20 142,01 142,81 143,61 145,22 146,84 148,46 150,10 151,74 153,40 155,07 156,75 1,3139 1,1450 1,1476 1,1501 1,1526 1,1575 1,1623 1,1670 1,1715 1,1760 1,1904 1,1847 1,1889 2 139,07 139,95 140,83 141,70 142,56 144,28 145,98 147,68 149,38 151,08 152,79 154,50 156,21 1,1298 1,1327 1,1355 1,1383 1,1409 1,1462 1,1512 1,1561 1,1608 1,1655 1,1700 1,1744 1,1787 2 Pressão = 12,4287 kgf/cm o Temperatura de Sat.(50 C) Pressão = 15,560 kgf/cm o Temperatura de Sat.(60 C) 0,0151 0,0160 0,0169 0,0177 0,0185 0,0192 0,0199 0,0207 0,0111 0,0120 0,0128 0,0135 0,0142 0,0148 0,0154 0,0160 142,66 144,55 146,40 148,22 150,03 151,82 153,60 155,38 1,1344 1,1400 1,1453 1,1504 1,1553 1,1600 1,1646 1,1691 141,37 143,46 145,46 147,39 149,28 151,14 152,98 154,81 1,1277 1,1339 1,1396 1,1450 1,1501 1,1550 1,1598 1,1644 2 Pressão = 3,1469 kgf/cm o Temperatura de Sat.(0 C) Volume Específico Entalpia Entropia v s h 3 m /kg 0,0554 --------------------0,0568 0,0582 0,0595 0,0609 0,0622 0,0635 0,0648 0,0660 0,0673 0,0686 0,0711 0,0735 0,0759 0,0783 0,0807 0,0831 0,0855 kJ/kg 136,18 --------------------136,95 137,73 138,50 139,28 140,05 140,83 141,61 142,39 143,17 143,92 145,53 147,12 148,73 150,34 151,97 153,61 155,27 kcal/kg.K 1,1325 --------------------1,1353 1,1380 1,1407 1,1434 1,1460 1,1486 1,1511 1,1536 1,1561 1,1586 1,1634 1,1681 1,1727 1,1772 1,1816 1,1860 1,1902 2 Pressão = 9,7960 kgf/cm o Temperatura de Sat.(40 C) 0,0182 ----------0,0187 0,0193 0,0204 0,0214 0,0223 0,0233 0,0242 0,0251 0,0259 0,0268 139,92 ----------140,86 141,78 143,58 145,36 147,12 148,87 150,62 152,36 154,10 155,85 1,1291 ----------1,1321 1,1349 1,1404 1,1457 1,1508 1,1556 1,1604 1,1650 1,1695 1,1738 2 Pressão = 19,230 kgf/cm o Temperatura de Sat.(70 C) -----0,0087 0,0095 0,0102 0,0109 0,0114 0,0120 0,0125 -----141,90 144,17 146,29 148,31 150,28 152,20 154,10 -----1,1268 1,1333 1,1392 1,1447 1,1499 1,1548 1,1596 Capítulo - 2 - Termodinâmica Aplicada - pág. - 20 TABELA (2.4-7) Propriedades de Saturação - Refrigerante - R- 22 (resumida) TEMP. PRESS. o kgf/cm C 2 VOLUME ESPECÍFICO Líquido Vapor 3 3 m /kg m /kg 3 vL x10 vv ENTALPIA ESPECÍFICA Líquido Líq-vap Vapor kcal/kg kcal/kg kcal/kg h LV hv hL ENTROPIA ESPECÍFICA Líquido Vapor kcal/kg.K kcal/kg.K SL SV TEMP. o C -40,0 -36,0 -32,0 -30,0 -28,0 1,0701 1,2842 1,5306 1,6669 1,8126 0,7093 0,7153 0,7214 0,7245 0,7277 0,2058 0,1735 0,1472 0,1359 0,1256 89,344 90,361 91,389 91,907 92,428 55,735 55,156 54,559 54,254 53,944 145,079 145,517 145,948 146,161 146,372 0,95815 0,96246 0,96674 0,96887 0,97099 1,19719 1,19503 1,19298 1,19199 1,19103 -40,0 -36,0 -32,0 -30,0 -28,0 -26,0 -24,0 -22,0 -20,0 -18,0 1,9679 2,1333 2,3094 2,4964 2,6949 0,7309 0,7342 0,7375 0,7409 0,7443 0,1162 0,1077 0,0999 0,0928 0,0864 92,951 93,477 94,006 94,537 95,071 53,630 53,311 52,987 52,659 52,325 146,581 146,788 146,993 147,196 147,396 0,97311 0,97522 0,97732 0,97941 0,98150 1,19009 1,18918 1,18829 1,18742 1,18657 -26,0 -24,0 -22,0 -20,0 -18,0 -16,0 -14,0 -12,0 -10,0 -8,0 2,9053 3,1281 3,3638 3,6127 3,8754 0,7478 0,7514 0,7550 0,7587 0,7625 0,0804 0,0750 0,0700 0,0653 0,0611 95,608 96,147 96,689 97,234 97,781 51,987 51,643 51,294 50,939 50,579 147,594 147,790 147,983 148,173 148,361 0,98358 0,98565 0,98772 0,98978 0,99184 1,18574 1,18492 1,18413 1,18335 1,18259 -16,0 -14,0 -12,0 -10,0 -8,0 -6,0 -4,0 -2,0 0,0 2,0 4,1524 4,4441 4,7511 5,0738 5,4127 0,7663 0,7703 0,7742 0,7783 0,7825 0,0572 0,0536 0,0502 0,0471 0,0443 98,332 98,885 99,441 100,00 100,56 50,214 49,842 49,465 49,083 48,694 148,546 148,728 148,907 149,083 149,255 0,99389 0,99593 0,99797 1,00000 1,00203 1,18184 1,18111 1,18039 1,17968 1,17899 -6,0 -4,0 -2,0 0,0 2,0 4,0 6,0 8,0 0,0 12,0 5,7684 6,1413 6,5320 6,9410 7,3687 0,7867 0,7910 0,7955 0,8000 0,8046 0,0416 0,0391 0,0369 0,0347 0,0327 101,13 101,69 102,27 102,84 103,42 48,298 47,897 47,489 47,074 46,653 149,425 149,591 149,754 149,913 150,068 1,00405 1,00606 1,00807 1,01008 1,01208 1,17831 1,17764 1,17698 1,17633 1,17569 4,0 6,0 8,0 10,0 12,0 14,0 16,0 18,0 20,0 22,0 7,8158 8,2828 8,7701 9,2784 9,8082 0,8094 0,8142 0,8192 0,8243 0,8295 0,0309 0,0291 0,0275 0,0260 0,0246 104,00 104,58 105,17 105,76 106,35 46,224 45,788 45,345 44,894 44,435 150,220 150,367 150,511 150,650 150,785 1,01408 1,01607 1,01806 1,02005 1,02203 1,17505 1,17442 1,17380 1,17319 1,17258 14,0 16,0 18,0 20,0 22,0 26,0 30,0 34,0 38,0 40,0 10,935 12,153 13,470 14,888 15,637 0,8404 0,8519 0,8641 0,8771 0,8839 0,0220 0,0197 0,0177 0,0160 0,0151 107,55 108,76 109,99 111,24 111,87 43,492 42,513 41,495 40,435 39,888 151,040 151,275 151,487 151,676 151,761 1,02599 1,02994 1,03389 1,03783 1,03981 1,17137 1,17018 1,16898 1,16778 1,16718 26,0 30,0 34,0 38,0 40,0 44,0 48,0 52,0 56,0 60,0 17,218 18,913 20,729 22,670 24,743 0,8983 0,9137 0,9304 0,9487 0,9687 0,0136 0,0123 0,0111 0,0100 0,0090 113,15 114,45 115,78 117,14 118,55 38,756 37,570 36,322 35,004 33,580 151,908 152,024 152,104 152,143 152,125 1,04376 1,04773 1,05172 1,05573 1,05984 1,16596 1,16471 1,16342 1,16208 1,16063 44,0 48,0 52,0 56,0 60,0 70,0 80,0 90,0 96,1 30,549 37,344 45,300 50,750 1,0298 1,1181 1,2822 1,9056 0,0069 0,0051 0,0036 0,0019 122,24 126,39 131,70 140,15 29,582 24,492 16,740 0,0 151,819 150,884 148,436 140,150 1,07035 1,08180 1,09597 1,11850 1,15656 1,15115 1,14207 1,11850 70,0 80,0 90,0 96,01 Capítulo - 2 - Termodinâmica Aplicada - pág. - 21 Tabela (2.4-8) Propriedades de Vapor Superaquecido - Refrigerante R - 22 (Resumida) 2 Temperatura ↓ O C Sat. -10 0,0 5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0 45,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 120,0 Temperatura O ↓ C Sat. 20,0 25,0 30,0 35,0 40,0 45,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 120,0 Temperatura O ↓ C 60,0 70,0 80,0 90,0 100,0 110,0 120,0 130,0 Pressão = 2,4964 kgf/cm o Temperatura de Sat.(- 20 C) Volume Específic Entalpia Entropia o h s v 3 m /kg 0,0928 0,0974 0,1019 0,1041 0,1063 0,1085 0,1107 0,1128 0,1150 0,1171 0,1192 0,1213 0,1234 0,1276 0,1318 0,1359 0,1400 0,1441 0,1482 0,1523 2 v 3 kcal/kg kcal/kg.K m /kg 147,196 148,761 150,337 151,130 151,926 152,726 153,530 154,339 155,152 155,969 156,791 157,618 158,449 160,127 161,825 163,544 165,284 167,045 168,827 170,631 1,18742 1,19348 1,19936 1,20223 1,20507 1,20787 1,21064 1,21337 1,21608 1,21875 1,22140 1,22402 1,22661 1,23172 1,23675 1,24168 1,24654 1,25132 1,25604 1,26068 2 2 Pressão = 3,6127 kgf/cm Pressão = 5,0738 kgf/cm o o Temperatura de Sat.(- 10 C) Temperatura de Sat.(0 C) Volume Volume Específic Entalpia Entropia Específico Entalpia Entropia o v s s h h 0,0653 -----0,0687 0,0703 0,0719 0,0735 0,0750 0,0766 0,0781 0,0797 0,0812 0,0827 0,0842 0,0872 0,0901 0,0930 0,0959 0,0988 0,1017 0,1046 3 kcal/kg kcal/kg.K m /kg 148,173 -----149,812 150,632 151,454 152,278 153,104 153,932 154,764 155,599 156,437 157,279 158,125 159,829 161,551 163,290 165,048 166,825 168,622 170,438 1,18335 -----1,18946 1,19244 1,19537 1,19825 1,20109 1,20389 1,20666 1,20939 1,21209 1,21476 1,21740 1,22259 1,22768 1,23268 1,23758 1,24241 1,24716 1,25184 2 0,0471 ----------0,0484 0,0496 0,0508 0,0520 0,0532 0,0544 0,0555 0,0567 0,0578 0,0589 0,0611 0,0633 0,0654 0,0675 0,0697 0,0717 0,0738 kcal/kg kcal/kg.K 149,083 ----------149,945 150,805 151,663 152,521 153,378 154,238 155,098 155,960 156,823 157,690 159,430 161,183 162,950 164,733 166,532 168,348 170,182 1,17968 ----------1,18281 1,18588 1,18888 1,19183 1,19474 1,19759 1,20041 1,20318 1,20592 1,20862 1,21392 1,21911 1,22418 1,22916 1,23405 1,23885 1,24357 2 Pressão = 6,9410 kgf/cm o Temperatura de Sat.(+10 C) Pressão = 12,1535 kgf/cm o Temperatura de Sat.(+30 C) Pressão = 15,6371 kgf/cm o Temperatura de Sat.(+40 C) 0,0347 0,0366 0,0376 0,0385 0,0394 0,0403 0,0412 0,0420 0,0437 0,0454 0,0470 0,0486 0,0502 0,0518 0,0534 0,0197 ---------------0,0204 0,0210 0,0216 0,0222 0,0234 0,0245 0,0255 0,0266 0,0276 0,0285 0,0295 0,0151 -------------------------0,0157 0,0162 0,0173 0,0182 0,0191 0,0200 0,0208 0,0216 0,0224 149,913 151,731 152,633 153,531 154,428 155,323 156,217 157,112 158,903 160,700 162,505 164,322 166,151 167,993 169,851 1,17633 1,18264 1,18569 1,18868 1,19161 1,19449 1,19732 1,20011 1,20557 1,21089 1,21607 1,22114 1,22611 1,23098 1,23577 2 Pressão = 19,80558 kgf/cm o Temperatura de Sat.(+ 50 C) 0,0126 0,0135 0,0143 0,0151 0,0158 0,0165 0,0172 0,0178 154,500 156,791 158,993 161,137 163,241 165,318 167,379 169,429 1,17148 1,17826 1,18459 1,19057 1,19629 1,20178 1,20709 1,21224 151,274 ---------------152,314 153,336 154,345 155,342 157,311 159,256 161,188 163,113 165,036 166,961 168,891 1,17017 ---------------1,17358 1,17687 1,18006 1,18317 1,18917 1,19493 1,20048 1,20585 1,2107 1,21616 1,22114 2 151,759 -------------------------152,886 153,985 156,119 158,196 160,234 162,248 164,245 166,234 168,219 1,16687 -------------------------1,17075 1,17417 1,18068 1,18682 1,19268 1,19830 1,20372 1,20898 1,21410 2 Pressão = 24,74350 kgf/cm o Temperatura de Sat.(+ 60 C) Pressão = 30,54892 kgf/cm o Temperatura de Sat.(+ 70 C) 0,0090 0,0099 0,0107 0,0114 0,0120 0,0127 0,0133 0,0138 -----0,0069 0,0078 0,0085 0,0091 0,0097 0,0102 0,0107 152,125 154,847 157,336 159,688 161,953 164,159 166,326 168,464 1,16063 1,16869 1,17584 1,18240 1,18856 1,19439 1,19997 1,20535 -----151,819 154,977 157,724 160,260 162,668 164,992 167,257 -----1,15656 1,16564 1,17331 1,18020 1,18657 1,19255 1,19824 Capítulo - 2 - Termodinâmica Aplicada - pág. - 22 TABELA (2.4-9) Propriedades de Saturação - REFRIGERANTE - R-134a (resumida) TEMP. o C PRESS. kPa VOLUME ESPECÍFICO m3/kg Líquido Vapor vL vv ENTALPIA ESPECÍFICA kJ/kg Líquido Líq-vap Vapor hL h LV hv ENTROPIA ESPECÍFICA kJ/kg-K Líquido Vapor SL SV TEMP. o C -40,0 -36,0 -32,0 -30,0 -28,0 51,14 62,83 76,58 84,29 92,61 0,0007 0,0007 0,0007 0,0007 0,0007 0,3614 0,2980 0,2474 0,2260 0,2069 148,4 153,4 158,4 160,9 163,5 225,9 223,4 220,9 219,6 218,3 374,3 376,8 379,3 380,6 381,8 0,7967 0,8178 0,8388 0,8492 0,8595 1,7655 1,7599 1,7548 1,7525 1,7502 -40,0 -36,0 -32,0 -30,0 -28,0 -26,0 -24,0 -22,0 -20,0 -18,0 101,58 111,22 121,57 132,67 144,54 0,0007 0,0007 0,0007 0,0007 0,0007 0,1896 0,1741 0,1601 0,1474 0,1359 166,0 168,6 171,1 173,7 176,3 217,1 215,7 214,4 213,1 211,7 383,1 384,3 385,5 386,8 388,0 0,8698 0,8801 0,8903 0,9005 0,9106 1,7481 1,7460 1,7440 1,7422 1,7404 -26,0 -24,0 -22,0 -20,0 -18,0 -16,0 -14,0 -12,0 -10,0 -8,0 157,23 170,78 185,22 200,60 216,95 0,0007 0,0007 0,0008 0,0008 0,0008 0,1255 0,1160 0,1074 0,0996 0,0924 178,9 181,5 184,1 186,7 189,3 210,4 209,0 207,6 206,2 204,7 389,2 390,4 391,7 392,9 394,1 0,9207 0,9307 0,9407 0,9507 0,9606 1,7387 1,7371 1,7356 1,7341 1,7327 -16,0 -14,0 -12,0 -10,0 -8,0 -6,0 -4,0 -2,0 0,0 2,0 234,32 252,74 272,26 292,93 314,77 0,0008 0,0008 0,0008 0,0008 0,0008 0,0858 0,0798 0,0743 0,0693 0,0646 192,0 194,6 197,3 200,0 202,7 203,3 201,8 200,3 198,8 197,3 395,3 396,4 397,6 398,8 400,0 0,9705 0,9804 0,9902 1,0000 1,0098 1,7314 1,7302 1,7290 1,7278 1,7267 -6,0 -4,0 -2,0 0,0 2,0 4,0 6,0 8,0 10,0 12,0 337,85 362,21 387,88 414,92 443,37 0,0008 0,0008 0,0008 0,0008 0,0008 0,0604 0,0564 0,0528 0,0494 0,0463 205,4 208,1 210,8 213,6 216,4 195,7 194,2 192,6 190,9 189,3 401,1 402,3 403,4 404,5 405,6 1,0195 1,0292 1,0389 1,0485 1,0582 1,7257 1,7247 1,7238 1,7229 1,7220 4,0 6,0 8,0 10,0 12,0 14,0 16,0 18,0 20,0 22,0 473,25 504,68 537,67 572,25 608,49 0,0008 0,0008 0,0008 0,0008 0,0008 0,0434 0,0408 0,0383 0,0360 0,0338 219,1 221,9 224,7 227,5 230,4 187,6 185,9 184,2 182,5 180,7 406,8 407,8 408,9 410,0 411,0 1,0678 1,0773 1,0869 1,0964 1,1060 1,7212 1,7204 1,7196 1,7189 1,7182 14,0 16,0 18,0 20,0 22,0 26,0 30,0 34,0 38,0 40,0 686,13 771,02 863,53 964,14 1017,61 0,0008 0,0008 0,0009 0,0009 0,0009 0,0300 0,0266 0,0237 0,0211 0,0200 236,1 241,8 247,7 253,6 256,6 177,0 173,3 169,3 165,3 163,2 413,1 415,1 417,0 418,9 419,8 1,1250 1,1439 1,1628 1,1817 1,1912 1,7168 1,7155 1,7142 1,7129 1,7122 26,0 30,0 34,0 38,0 40,0 44,0 48,0 52,0 56,0 60,0 1131,16 1253,95 1386,52 1529,26 1682,76 0,0009 0,0009 0,0009 0,0009 0,0010 0,0178 0,0160 0,0143 0,0128 0,0115 262,7 268,8 275,1 281,4 287,9 158,8 154,3 149,5 144,5 139,2 421,5 423,1 424,6 425,9 427,1 1,2101 1,2290 1,2479 1,2670 1,2861 1,7108 1,7093 1,7077 1,7059 1,7039 44,0 48,0 52,0 56,0 60,0 70,0 80,0 90,0 100,0 2117,34 2632,97 3242,87 3969,94 0,0010 0,0011 0,0012 0,0015 0,0087 0,0065 0,0046 0,0027 304,8 322,9 343,4 373,2 124,4 106,3 82,1 33,8 429,1 429,2 425,5 407,0 1,3347 1,3854 1,4406 1,5187 1,6971 1,6863 1,6668 1,6092 70,0 80,0 90,0 100,0 Capítulo - 2 - Termodinâmica Aplicada - pág. - 23 Tabela (2.4-10) Propriedades do Vapor Superaquecido - Refrigerante R-134a (Resumida) Pressão = 130 kPa Pressão = 200 kPa Pressão = 290 kPa o o o Temperatura de Sat.(- 20,47 C) Temperatura de Sat.(-10,08 C) Temperatura de Sat.(- 0,28 C) Temperatura Volume ↓ Específic o v O C Sat. -20,0 -15,0 -10,0 -5,0 0,0 5,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 3 m /kg 0,15026 0,15060 0,15423 0,15780 0,16134 0,16483 0,16829 0,17173 0,17857 0,18529 0,19198 0,19861 0,20521 0,21173 0,21825 0,22477 0,23116 0,23764 Volume Entalpia h kJ/kg 386,5 386,9 390,9 395,0 399,1 403,2 407,3 411,5 420,0 428,5 437,3 446,1 455,1 464,3 473,6 483,0 492,6 502,4 Entropia s Específic o v 3 kJ/kg.K m /kg 1,7426 1,7441 1,7600 1,7756 1,7910 1,8062 1,8212 1,8361 1,8654 1,8942 1,9225 1,9504 1,9778 2,0049 2,0316 2,0580 2,0841 2,1098 0,09985 ----------0,09989 0,10235 0,10478 0,10717 0,10953 0,11417 0,11874 0,12324 0,12767 0,13207 0,13643 0,14075 0,14505 0,14932 0,15359 Entalpia h kJ/kg 392,8 ----------392,9 397,1 401,4 405,6 409,9 418,5 427,3 436,1 445,1 454,2 463,4 472,8 482,3 491,9 501,7 Volume Entropia Específico v s 3 kJ/kg.K m /kg 1,7342 ----------1,7344 1,7504 1,7661 1,7815 1,7968 1,8267 1,8560 1,8847 1,9129 1,9406 1,9679 1,9948 2,0214 2,0476 2,0735 0,06995 --------------------0,07005 0,07183 0,07359 0,07701 0,08033 0,08358 0,08676 0,08990 0,09301 0,09606 0,09911 0,10213 0,10512 Entalpia h kJ/kg 398,6 --------------------398,9 403,3 407,8 416,6 425,6 434,6 443,7 452,9 462,3 471,7 481,3 491,0 500,9 Entropia s kJ/kg.K 1,7280 --------------------1,7289 1,7449 1,7607 1,7916 1,8216 1,8508 1,8795 1,9076 1,9352 1,9624 1,9892 2,0156 2,0416 Pressão = 425 kPa Temperatura o O Temperatura de Sat.(10,72 C) ↓ C 0,04827 404,9 1,7226 Sat. 0,04939 408,9 1,7366 15,0 0,05067 413,6 1,7526 20,0 0,05192 418,3 1,7683 25,0 0,05314 422,9 1,7838 30,0 0,05553 432,2 1,8140 40,0 0,05785 441,6 1,8434 50,0 451,0 1,8722 0,06010 60,0 0,06233 460,5 1,9003 70,0 470,1 1,9279 0,06452 80,0 0,06668 479,8 1,9550 90,0 0,06880 489,7 1,9817 100,0 0,07092 499,6 2,0081 110,0 0,07300 509,7 2,0340 120,0 0,07508 519,9 2,0596 130,0 Pressão = 800 kPa Pressão = 1 000 kPa o o Temperatura de Sat.(31,29 C) Temperatura de Sat.(39,35 C) Pressão = 1400 kPa Temperatura o O Temperatura de Sat.(52,39 C) ↓ C 0,01413 424,7 1,7076 Sat. 0,01502 434,0 1,7357 60,0 0,01607 445,6 1,7700 70,0 0,01703 456,8 1,8023 80,0 0,01793 467,8 1,8331 90,0 0,01878 478,8 1,8626 100,0 0,01960 489,6 1,8915 110,0 0,02038 500,5 1,9194 120,0 0,02115 511,3 1,9467 130,0 0,02189 522,2 1,9734 140,0 Pressão = 1800 kPa Pressão = 2200 kPa o o Temperatura de Sat.(62,87 C) Temperatura de Sat.(71,72 C) 0,02565 --------------------0,02705 0,02856 0,02998 0,03135 0,03267 0,03395 0,03520 0,03642 0,03763 0,03881 0,01558 -----0,01134 0,01227 0,01309 0,01386 0,01457 0,01524 0,01589 0,01652 415,7 --------------------424,8 435,1 445,2 455,3 465,4 475,5 485,7 495,9 506,3 516,7 427,8 -----437,4 450,0 462,0 473,6 485,0 496,3 507,5 518,7 1,7150 --------------------1,7445 1,7767 1,8076 1,8374 1,8664 1,8947 1,9223 1,9494 1,9761 2,0023 1,7022 -----1,7306 1,7667 1,8001 1,8317 1,8618 1,8909 1,9191 1,9466 0,02034 --------------------0,02044 0,02181 0,02308 0,02427 0,02541 0,02650 0,02756 0,02859 0,02959 0,03058 0,00825 ----------0,00909 0,00993 0,01067 0,01133 0,01195 0,01253 0,01308 419,5 --------------------420,2 431,2 441,8 452,3 462,7 473,1 483,5 493,9 504,4 515,0 429,3 ----------441,8 455,3 467,9 480,0 491,8 503,8 515,1 1,1177 --------------------1,7147 1,7491 1,7816 1,8126 1,8425 1,8715 1,8997 1,9273 1,9543 1,9809 1,6956 ----------1,7313 1,7690 1,8033 1,8354 1,8658 1,8951 1,9235 Capítulo - 2 - Termodinâmica Aplicada - pág. - 24 TABELA (2.4-11) Propriedades de Saturação - Refrigerante - 717 (Amônia) TEMP. o C PRES. kgf/cm 2 VOLUME ESPECÍFICO ENTALPIA ESPECÍFICA ENTROPIA ESPECÍFICA Vapor kcal/kg hv Líquido kcal/kg.K Vapor kcal/kg.K hL kcal/kg h LV SL SV Líquido 3 m /kg 3 vL x10 Vapor 3 m /kg vv Líquido kcal/kg Líq-vap TEM P o C -70,0 -65,0 -60,0 -55,0 0,112 0,159 0,223 0,309 1,3788 1,3898 1,4010 1,4126 9,0090 6,4518 4,7026 3,4866 25,90 31,00 35,63 40,89 349,80 346,85 344,75 341,59 375,70 377,85 380,38 382,48 0,6878 0,7124 0,7347 0,7591 2,4101 2,3794 2,3525 2,3253 -70,0 -65,0 -60,0 -55,0 -50,0 -45,0 -40,0 -35,0 -30,0 0,416 0,556 0,732 0,951 1,219 1,4245 1,4367 1,4493 1,4623 1,4757 2,6253 2,0053 1,5521 1,2160 0,9635 46,16 51,44 56,75 62,07 67,41 338,38 335,11 331,76 328,33 324,82 384,54 386,55 388,51 390,40 392,23 0,7830 0,8064 0,8293 0,8519 0,8741 2,2997 2,2755 2,2526 2,2309 2,2102 -50,0 -45,0 -40,0 -35,0 -30,0 -28,0 -26,0 -24,0 -22,0 -20,0 1,342 1,475 1,619 1,774 1,940 1,4811 1,4867 1,4923 1,4980 1,5037 0,8805 0,8059 0,7388 0,6783 0,6237 69,56 71,70 73,86 76,01 78,17 323,39 321,94 320,47 318,99 317,50 392,95 393,64 394,33 395,00 395,67 0,8828 0,8915 0,9002 0,9088 0,9173 2,2022 2,1944 2,1867 2,1792 2,1717 -28,0 -26,0 -24,0 -22,0 -20,0 -18,0 -16,0 -14,0 -12,0 -10,0 2,117 2,300 2,514 2,732 2,966 1,5096 1,5155 1,5215 1,5276 1,5337 0,5743 0,5295 0,4889 0,4521 0,4185 80,33 82,50 84,67 86,85 89,03 315,98 314,45 312,90 311,33 309,74 396,31 396,95 397,57 398,18 398,77 0,9258 0,9342 0,9426 0,9510 0,9592 2,1645 2,1573 2,1503 2,1433 2,1365 -18,0 -16,0 -14,0 -12,0 -10,0 -8,0 -6,0 -4,0 -2,0 0,0 3,216 3,481 3,761 4,060 4,379 1,5400 1,5464 1,5528 1,5594 1,5660 0,3878 0,3599 0,3343 0,3110 0,2895 91,21 93,40 95,60 97,80 100,00 308,13 306,51 304,86 303,19 301,51 399,34 399,91 400,46 400,99 401,51 0,9675 0,9757 0,9838 0,9919 1,0000 2,1298 2,1232 2,1167 2,1103 2,1040 -8,0 -6,0 -4,0 -2,0 0,0 5,0 10,0 15,0 20,0 25,0 5,259 6,271 7,427 8,741 10,225 1,5831 1,6008 1,6193 1,6386 1,6588 0,2433 0,2056 0,1748 0,1494 0,1283 105,54 111,12 116,73 122,40 128,11 297,20 292,75 288,16 283,42 278,53 402,74 403,87 404,89 405,82 406,64 1,0200 1,0397 1,0592 1,0785 1,0977 2,0886 2,0738 2,0594 2,0455 2,0320 5,0 10,0 15,0 20,0 25,0 30,0 32,0 34,0 36,0 38,0 11,895 12,617 13,274 14,165 14,990 1,6800 1,6888 1,6977 1,7068 1,7161 0,1106 0,1044 0,0986 0,0931 0,0880 133,87 136,18 138,51 140,84 143,18 273,48 271,42 269,32 267,19 265,04 407,35 407,60 407,83 408,03 408,22 1,1166 1,1241 1,1316 1,1391 1,1465 2,0189 2,0138 2,0086 2,0035 1,9985 30,0 32,0 34,0 36,0 38,0 40,0 42,0 44,0 46,0 48,0 15,850 16,742 17,682 18,658 19,673 1,7257 1,7354 1,7454 1,7555 1,7659 0,0833 0,0788 0,0746 0,0706 0,0670 145,53 147,89 150,26 152,64 155,04 262,85 260,62 258,35 256,05 253,69 408,38 408,51 408,61 408,69 408,73 1,1539 1,1613 1,1687 1,1761 1,1834 1,9934 1,9884 1,9835 1,9785 1,9735 40,0 42,0 44,0 46,0 48,0 50,0 55,0 60,0 65,0 20,727 23,553 26,657 30,059 1,7766 1,8044 1,8341 1,8658 0,0635 0,0556 0,0487 0,0428 157,46 163,63 170,09 177,10 251,28 244,92 237,95 229,98 408,74 408,55 408,04 407,08 1,1908 1,2094 1,2285 1,2490 1,9685 1,9559 1,9429 1,9292 50,0 55,0 60,0 65,0 Capítulo - 2 - Termodinâmica Aplicada - pág. - 25 Tabela (2.4-12) Propriedades de Vapor Superaquecido - Refrigerante - 717 (Resumida) 2 Temperatura ↓ O C Sat. -30 -20 -10 0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 Temperatura O ↓ C Sat. 0,0 10,0 20,0 30,0 40,0 50,0 60,0 70,0 80,0 90,0 100,0 110,0 120,0 130,0 2 Pressão = 0,73185 kgf/cm Pressão = 1,21907 kgf/cm o o Temperatura de Sat.(- 40 C) Temperatura de Sat.(- 30 C) Volume Volume Específic Entalpia Entropia Específico Entalpia Entropia o v h s h s v 3 m /kg 1,55206 1,62535 1,67736 1,76851 1,83906 1,90917 1,97894 2,04845 2,11776 2,18690 2,25591 2,32481 2,39361 2,46233 2,53098 2,59957 kcal/kg kcal/kg.K 388,51 393,87 399,10 404,26 409,37 414,47 419,57 424,68 429,81 434,96 440,14 445,35 450,60 455,89 461,20 466,56 2,25260 2,27513 2,29621 2,31618 2,33526 2,35359 2,37129 2,38844 2,40509 2,42129 2,43708 2,45250 2,46758 2,48233 2,49678 2,51096 2 Pressão = 2,96584 kgf/cm o Temperatura de Sat.(-10,0 C) 0,41845 0,43832 0,45754 0,47631 0,49473 0,51290 0,53087 0,54868 0,56636 0,58393 0,60142 0,61883 0,63618 0,65348 0,67073 398,77 404,79 410,56 416,17 421,69 427,15 432,57 437,98 443,38 448,80 454,22 459,67 465,14 470,64 476,18 2,13653 2,15896 2,17971 2,19920 2,21771 2,23542 2,25248 2,26879 2,28495 2,30051 2,31567 2,33046 2,34494 2,35911 2,37301 2 Temperatura Pressão = 11,89509 kgf/cm o O Temperatura de Sat.(+30,0 C) ↓ C 0,11062 407,35 2,01890 Sat. 0,11665 414,85 2,04321 40,0 0,12231 421,84 2,06519 50,0 0,12771 428,48 2,08546 60,0 0,13292 434,89 2,10441 70,0 0,13798 441,13 2,12234 80,0 0,14291 447,25 2,13943 90,0 0,14776 453,29 2,15583 100,0 0,15252 459,27 2,17165 110,0 0,15723 465,21 2,18696 120,0 0,16187 471,13 2,20183 130,0 0,16648 477,14 2,21631 140,0 3 m /kg 0.96354 0,96354 1,00868 1,05285 1,09633 1,13933 1,18197 1,22433 1,26647 1,30844 1,35028 1,39199 1,43361 1,47515 1,51661 1,55802 kcal/kg kcal/kg.K 392,24 392,24 397,78 403,16 408,44 413,66 418,86 424,05 429,25 434,45 439,68 444,94 450,22 455,53 460,88 466,26 2,21023 2,21023 2,23257 2,25340 2,27310 2,29189 2,30994 2,32735 2,34422 2,36059 2,37653 2,39206 2,40724 2,42208 2,43660 2,45084 2 Pressão = 4,37907 kgf/cm o Temperatura de Sat.(0,0 C) 0,28951 401,51 2,10402 0,28951 401,51 2,10402 0,30354 407,83 2,12673 0,31704 413,85 2,14762 0,33014 419,67 2,16717 0,34292 425,37 2,18567 0,35554 430,99 2,20334 0,36796 436,56 2,22032 0,38024 442,10 2,23670 0,39341 447,63 2,25258 0,40449 453,15 2,26801 0,41649 458,69 2,28304 0,42842 464,23 2,29771 0,44030 469,80 2,31205 0,45213 475,38 2,32609 2 Pressão = 1,93970 kgf/cm o Temperatura de Sat.(- 20 C) Volume Específico Entalpia Entropia v s h 3 m /kg kcal/kg kcal/kg.K 0,62371 -----0,62371 0,65299 0,68148 0,70942 0,73696 0,76419 0,79119 0,81801 0,84468 0,87123 2,44658 0,92405 0,95034 0,97657 395,67 -----395,67 401,43 406,98 412,42 417,78 423,09 428,39 433,85 438,99 444,30 449,64 455,00 460,38 465,80 2,17176 -----2,17176 2,19407 2,21479 2,23432 2,25393 2,27077 2,28798 2,30462 2,32077 2,33649 2,35182 2,36679 2,38142 2,39576 2 Pressão = 6,27085 kgf/cm o Temperatura de Sat.(+10,0 C) 0,20563 403,87 2,07380 ---------------0,20563 403,87 207380 0,21590 410,53 2,09692 0,22571 416,83 2,11807 0,23517 422,90 2,13777 0,24439 428,81 2,15635 0,25342 434,62 2,17404 0,26230 440,35 2,19100 0,27105 446,04 2,20734 0,27971 451,70 2,22316 0,28828 457,35 2,23851 0,29679 463,00 2,25345 0,30524 468,66 2,26803 0,31363 474,33 2,28227 2 2 Pressão = 15,84945 kgf/cm Pressão = 20,72716 kgf/cm o o Temperatura de Sat.(+40,0 C) Temperatura de Sat.(+50,0 C) 0,08326 0,08326 0,08808 0,09257 0,09682 0,10088 0,10481 0,10864 0,11238 0,11605 0,11966 0,12322 408,38 408,38 416,40 423,81 430,80 437,50 443,99 450,34 456,57 462,73 468,84 474,92 1,99346 1,99346 2,01866 2,04125 2,06193 2,08118 2,09932 2,11655 2,13305 2,14893 2,16428 2,17916 0,06346 -----0,06346 0,06748 0,07115 0,07458 0,07784 0,07867 0,08400 0,08695 0,08983 0,09267 408,74 -----408,74 417,43 425,35 432,75 439,79 446,56 453,16 459,61 465,97 472,26 1,96852 -----1,96852 1,99501 2,01845 2,03971 2,05936 2,07777 2,09521 2,11185 2,12783 2,14325 Capítulo - 2 - Termodinâmica Aplicada - pág. - 26 Exemplo 2.4-1 a) Determine o volume específico, a energia interna específica, a entalpia específica, e a entropia específica para líquido e vapor saturado da água na pressão de saturação de 2,5 MPa. b) Determine o volume específico, a entalpia específica e a entropia específica para a água com pressão de 10 bar e temperatura de 300 OC. Solução a) Água Saturada Da tabela de propriedades da água saturada para P = 25 bar temos a correspondente temperatura de saturação, T = 224 OC As demais propriedades são: Vl = 0,001973 m3/kg, VV = 0,0800 m3/kg hl = 962,11 kJ/kg, hV = 2803,1 kJ/kg Ul = 959,11 kJ/kg UV = 2603,1 kJ/kg Sl = 2,5547 kJ/kg-K SV = 6,2575 kJ/kg-K] b) Água na pressão de 10 bar e Temperatura de 300 OC Da tabela de propriedades saturadas para P = 10 bar temos T = 179,9 OC. Logo, a água a 300 OC está superaquecida. Da tabela de propriedades da água superaquecida (2.4-2) temos VV = 0,2579 m3/kg hV = 3051,2 kJ/kg SV = 7,1229 kJ/kg-K Exemplo 2.4-2 Considere um sistema composto de 2 kg de água no estado líquido à temperatura de 80 OC e pressão de 50 bar. Determine o volume específico e a entalpia para o sistema. a) através da tabela de propriedades comprimidas da água b) através da tabela de propriedades saturadas da água c) comente os desvios dos valores obtidos pelas duas formas. Solução a) Da tabela (2.4-3) de líquido comprimido para a água a 50 bar e Capítulo - 2 - Termodinâmica Aplicada - pág. - 27 temperatura de 80 OC temos; (observe que a temperatura de saturação correspondente à pressão de 50 bar é de 263,99 OC) V = 0,0010268 m3 /kg e h = 338,85 kJ/kg b) Como podemos observar, a tabela disponível para propriedades saturadas, não tem a temperatura de 80 OC sendo necessário fazermos interpolações lineares, que resulta em: V = 0,0010291 m3 / kg e h= 334,91 kJ /kg C) Os desvios da tabela de líquido comprimido em relação à de saturação são: δν = 0,0010268 − 0,0010291 x 100 = − 0,22% 0,0010268 δh = 338,85 − 334,91 x 100 = 116% , 338,85 Comentários: Pelos resultados, observamos ser insignificantes os desvios dos valores das propriedades obtidas pela tabela correta (liquido comprimido) e na forma aproximada, como líquido saturado na temperatura em que se encontra a substância sem levar em conta a pressão.(a pressão de saturação a 80 OC é de 0,4739 bar, bem inferior aos 50 bar do líquido comprimido) Concluímos assim que, as propriedades de líquido comprimido são aproximadamente iguais às de líquido saturado na mesma temperatura para substâncias que podem ser admitidas como incompressíveis.(para qualquer substância incompressível) Exemplo 2.4-3 Considere um cilindro de volume interno igual a 0,14 m3, contendo 10 kg de refrigerante R-134a. O cilindro é usado para fins de reposição de refrigerante em sistemas de refrigeração. Em um dado dia a temperatura ambiente é de 26 OC. Admita que o refrigerante dentro do cilindro está em equilíbrio térmico com o meio ambiente e determine a massa de refrigerante no estado líquido e no estado vapor no interior do cilindro. Solução: Conhecemos: tanque cilíndrico de dimensões conhecidas contendo 10 kg de refrigerante R-134a em equilíbrio térmico a 26 OC determinar: massa no estado líquido e massa no estado vapor Hipótese: 1) O gás no interior do cilindro é o sistema termodinâmico fechado 2) O sistema está em equilíbrio termodinâmico Capítulo - 2 - Termodinâmica Aplicada - pág. - 28 Análise: Se no interior do cilindro tivermos de fato as duas fases: líquido+vapor, então o sistema está na condição de vapor úmido e podemos determinar o título, x, da mistura. O volume específico da mistura, pela definição de volume específico é: ν = V 0,140 m 3 m3 = = 0,014 10,0 kg m kg da equação (2.4-3) , que relaciona volume específico com título temos; ν = νl + x (ν v − ν l ) → x= (ν − ν l ) (ν v − ν l ) da tabela de propriedades saturadas para o refrigerante R-134a obtemos os valores de volume específico do líquido e do valor, que valem: νl = 3 0,0008 m kg νv = 3 0,0300 m kg substituindo na equação do título , obtemos; x= 0,0140 − 0,0008 ⇒ 0,0300 − 0,0008 x = 0,452 da definição de título, em que, x = m v = 0,452 x 10,0 kg ⇒ mv , obtemos mt m v = 4,52 kg de vapor pela conservação de massa mt = mv + ml ⇒ ml = mt − mv ⇒ m l = 10,0 − 4,52 ⇒ m l = 5,48 kg 2.5 - Diagramas de Propriedades Termodinâmicas As propriedades termodinâmicas de uma substância, além de serem apresentadas através de tabelas, são também apresentadas na forma gráfica, chamados de diagramas de propriedades termodinâmicas. Estes diagramas podem ter por ordenada e abcissa respectivamente T x ν (temperatura versus volume específico), P x h (pressão versus entalpia específica), T x s (temperatura versus entropia específica) ou ainda h x s (entalpia específica versus entropia específica). O mais conhecido desses diagramas é o diagrama h x s conhecido como diagrama de Mollier. Uma das vantagem do uso destes diagramas de propriedades é que eles apresentam numa só figura as propriedades de líquido comprimido, do vapor úmido e do vapor superaquecido como está mostrado esquematicamente nas figuras 2.5-1, 2.5-2 e 2.5-3. Capítulo - 2 - Termodinâmica Aplicada - pág. - 29 Figura 2.5 - 1 - Diagrama Temperatura versus Entropia Específica Esses diagramas são úteis tanto como meio de apresentar a relação entre as propriedades termodinâmicas como porque possibilitam a visualização dos processos que ocorrem em parte do equipamento sob análise ou no todo. As três regiões características dos diagramas estão assim divididas: a) A região à esquerda da linha de liquido saturado (x=0) é a região de líquido comprimido ou líquido sub-resfriado (aqui estão os dados referentes às tabelas de líquido comprimido) b) A região compreendida entre a linha de vapor saturado (x=1) e a linha de líquido saturado (x = 0) é a região de vapor úmido. Nesta região, em geral os diagramas apresentam linhas de título constante como esquematizadas nas figuras. c) A região à direita da linha de vapor saturado seco (x = 1) é a região de vapor superaquecido. (nesta região estão os dados contidos nas tabelas de vapor superaquecido) Dado o efeito de visualização, é aconselhável, na análise dos problemas termodinâmicos, representar esquematicamente os processos em um diagrama, pois a solução torna-se clara. Assim, o completo domínio destes diagramas é essencial para o estudo dos processos térmicos. Figura 2.5 - 2 - Diagrama Entalpia Específica versus Entropia Específica Capítulo - 2 - Termodinâmica Aplicada - pág. - 30 Figura 2.5 - 3 - Diagrama Pressão versus Entalpia Específica As figuras 2.5-4 e 2.5-5 a seguir, são diagramas de Mollier para a água. Diagramas mais completos e diagramas T x s para a água podem ser encontrados na bibliografia citada. Para o estudo de sistemas de refrigeração é mais conveniente apresentar as propriedades em diagramas que tenham como ordenada a pressão absoluta e como abcissa a entalpia específica. A figura 2.5-6 é o diagrama para o refrigerante R-12, a Figura 2.5-7 é o diagrama para o refrigerante R-22, a figura 2.5-8 é o diagrama para o refrigerante R-134a e a figura 2.5-9 é o diagrama P x h para a amônia, que pela classificação da ASHRAE (American Society of Heating, Refrigerating, and Air-Conditioning Engineers.) é o refrigerante R-717. Capítulo - 2 - Termodinâmica Aplicada - Figura 2.5 - 4 - Diagrama de Mollier (h x s) para a água pág. - 31 Capítulo - 2 - Termodinâmica Aplicada - Figura 2.5-5 Parte do diagrama de Mollier para a água pág. - 32 Capítulo - 2 - Termodinâmica Aplicada - Figura 2.5-6 - Diagrama P x h para o refrigerante R-12 pág. - 33 Capítulo - 2 - Termodinâmica Aplicada - Figura 2.5-7 - Diagrama P x h para o refrigerante R-22 pág. - 34 Capítulo - 2 - Termodinâmica Aplicada - Figura 2.5 - 8 - Diagrama P x h para o refrigerante R-134a pág. - 35 Capítulo - 2 - Termodinâmica Aplicada - pág. - 36 Figura 2.5 - 9 Diagrama P x h (sem a parte central) para o refrigerante R-717 (Amônia) Capítulo - 2 - Termodinâmica Aplicada - pág. - 37 Exemplo 2.5-1 o Vapor de água inicialmente a 4,0 MPa e 300 C (estado 1) está contido em um conjunto êmbolo - cilindro. A água é então resfriada a volume constante até sua temperatura alcançar o 200 C (estado 2). A seguir a água é comprimida isotermicamente até um estado onde a pressão é de 2,5 MPa (estado 3). 3 a) Determine o volume específico nos estados 1, 2 e 3, em m / kg e o título no estado 2 se o estado 2 for de vapor úmido. b) Localize os estados 1, 2 e 3 e esquematize os processos em um diagrama T- v e P- v. Solução: - Hipóteses: - O vapor de água é o nosso sistema termodinâmico - Em cada estado o sistema está em equilíbrio termodinâmico Conhecido: o O estado inicial P= 40 bar e T= 300 C e os processos subseqüentes a-1) da tabela de vapor saturado para a água na pressão de 40 bar a correspondente o o temperatura de saturação é 250,4 C. Assim a água a 40 bar e 300 C está superaquecida. Da 3 tabela de vapor superaquecido temos v1 = 0,05884 m /kg a-2) Para determinarmos o estado 2 temos o volume específico que é igual ao volume 3 o específico do estado 1, v2 = 0,05884 m /kg e a temperatura de 200 C o da tabela de vapor saturado, para a temperatura de 200 C, a respectiva pressão de 3 saturação é 15,54 bar. O volume específico do líquido saturado vale; v2L = 0,0011565 m /kg e 3 do vapor saturado seco, v2v = 0,1274 m /kg. Como o volume específico do estado 2 está entre o volume específico do líquido e do vapor saturado, então inferimos que o estado 2 é de vapor úmido. Nos dois diagramas, o processo de 1→ 2 é indicado através de uma linha o vertical desde o estado 1 até o estado 2 cuja temperatura é de 200 C e a pressão é de 15,54 bar, na região de vapor úmido. a-3) O estado 3 cuja pressão é de 25 bar a temperatura é a mesma do estado 2, 200 o C. Como a pressão, 25 bar é maior que a pressão de saturação correspondente podemos facilmente inferir do diagrama T x v que o estado é de líquido comprimido. O processo de 2 → 3 está indicado nas figuras do item b). a-4) O volume do estado 1 e 2 são iguais, e seu valor lido da tabela de vapor 3 superaquecido, é 0,05884 m /kg. O volume específico do estado 3 deve ser obtido em uma 3 tabela de líquido comprimido, cujo valor é, v3 = 0,0011555 m /kg ou de forma aproximada, de o uma tabela de saturação na temperatura de 200 C, independentemente da pressão de 3 saturação correspondente, que é v3 = 0,0011565 m /kg. a-5) O título no estado 2 é obtido usando as relações matemáticas entre título e volume específico, como já mostrado anteriormente, assim: x2 = v 2 − v 2L 0,05884 − 0,0011565 = = 0,457 ou 45,7 % 0,1274 − 0,0011565 v 2 v − v 2L b) Representação dos estados e dos processos nos planos T x v e P x v Capítulo - 2 - Termodinâmica Aplicada - pág. - 38 Exemplo 2.5-2 Em um equipamento de refrigeração industrial, cujo fluido de trabalho é a amônia, (R-717) o dispositivo de expansão (válvula de expansão termostática) reduz a pressão do refrigerante de 15,850 kgf/cm2 e líquido saturado (estado1) para a pressão de 1,940 kgf/cm2 e título, X = 0,212 (estado 2). Determinar: a) O volume específico, a temperatura e a entalpia específica nos estados 1 e 2 b) Representar o processo de expansão na válvula nos diagramas h-s e P-h c) A que processo ideal mais se aproxima o processo de expansão na válvula de expansão termostática (isocórico, isotérmico, isentrópico, isentálpico, isobárico) Solução: a-1) da tabela de saturação para a amônia obtemos as propriedades do 2 líquido saturado na pressão de 15,850 kgf/cm (estado 1) 0 3 T1= 40 C, V1= 0,0017257 m /kg, h1=145,53 kcal/kg, S1=1,1539 kcal/kg-K a-2) As propriedades do estado 2 devem ser determinadas utilizando-se a 2 definição de título. Assim, para a pressão de 1,940 kgf/cm as proprieo dades de líquido e vapor saturado são: T = - 20 C V2 = V2L + X2 (V2V - V2L); 3 V2L = 0,0015037 m /kg, 3 V2V = 0,6237 m /kg 3 V2 = 0,0015037 + 0,212 (0,6237 - 0,0015037) → V2 = 0,1334 m /kg h2 = h2L + X2 (h2V - h2L); h2L= 78,17 kcal/kg, h2V = 395,67 kcal/kg h2 = 78,17 + 0,212 (395,67 - 78,17) S2 = S2L + X2 (S2V - S2L); → h2 = 145,48 kcal/kg S2L = 0,9173 kcal/kg-k, S2V = 2,1717 kcal/kg-K S2 = 0,9173 + 0,212 (2,1717 - 0,9173) → S2 = 1,1832 kcal/kg-K b) Representação do processo e dos estados termodinâmicos 1 e 2 c) O processo ideal mais próximo é o processo ISENTÁLPICO. (em qualquer processo de estrangulamento o processo ideal é o processo a entalpia constate, o fluido neste caso é acelerado, de forma que, o tempo de contato entre o fluido e a superfície envolvente é extremamente pequeno não havendo tempo suficiente para a troca de calor, então, h1 ≅ h2). Capítulo - 2 - Termodinâmica Aplicada - pág. - 39 Exemplo 2.5-3 Uma turbina a vapor pode ser operada em condições de carga parcial estrangulando-se o vapor que entra na turbina através de uma válvula. (o processo de estrangulamento é um processo isentálpico) . As condições do vapor de água na linha de alimentação são P1=10 bar e T1=300 OC. O vapor deixa a turbina com pressão, P3 = 0,1 bar. Como hipótese simplificadora adotemos que a turbina é uma máquina adiabática reversível. (processo de expansão isentrópico). Pede-se indicar os processos em um diagrama h x S e obter os dados de h, s, x, T, para: a) Turbina operando a plena carga b) Turbina operando em carga parcial com pressão saindo da válvula de estrangulamento (V.R.P), P2 = 5,0 bar SOLUÇÃO - Valores lidos do próprio diagrama de MOLLIER , portanto, valores aproximados. Capítulo - 2 - Termodinâmica Aplicada - pág. - 40 Continuação do Exemplo 2.5-3 - Solução através das tabelas de propriedades. caso a) - Neste caso, turbina operando a plena carga, significa que a válvula controladora na entrada da turbina não opera (é o mesmo que não existir) estado 1, P1 = 10 bar e T1 = 300 oC como já sabemos, da solução anterior, este é um estado de vapor superaquecido, assim da tabela de vapor superaquecido, obtemos; h1 = 3051,2 kJ / kg v1 = 0,2579 m3 /kg S1 = 7,1229 kJ /kg-K Estado 3 Processo isentrópico do estado 1 ao estado 3, então, S3 = S1 = 7,1229 kJ/kg-K (da solução anterior, também sabemos que o estado 3 é de vapor úmido (se não tivéssemos a solução gráfica direta no diagrama de Mollier, teríamos que verificar esta condição !) e pressão de P3 = 0,1 bar . Assim obtemos das tabelas de saturação os valores para vapor saturado e para líquido saturado, e com a equação que relaciona título com as demais propriedades na região de vapor úmido podemos calcular o título pois sabemos o valor da entropia. Assim; hls = 191,83 kJ/kg, hvs = 2584,7 kJ/kg, vls = 0,0010102 m3/kg, vvs = 14,674 m3/kg Sls = 0,6493 kJ/kg-K, Svs = 8,1502 kJ/kg-K S3 = Sls + X3(Svs - Sls) → X 3 = S 3 − S ls 7,1229 − 0,6493 = = 0,863 ou 86, 3% S vs − S ls 8,1502 − 0,6494 logo: h3= 191,83 + 0,863 (2584,7 - 191,83) = 2 256,9 kJ/kg v3 = 0,0010102 + 0,863 (14,674 - 0,0010102) = 12, 664 m3/kg caso b) Aqui, antes de ocorrer a expansão na turbina, ocorre o estrangulamento na válvula controladora da pressão de 10 bar para 5 bar. Como o processo é isentálpico, a entalpia do estado 2 é igual à entalpia do estado 1, e como sabemos, o estado 2 é de vapor superaquecido. da tabela de vapor superaquecido para P2 = 5,0 bar e h2 = 3 051,2 kJ/kg, interpolando na tabela, obtemos: T2 = 293,6 oC , v2 = 0,5164 m3 /kg, S2 = 7,4344 kJ/kg-K O estado 3, como sabemos da solução anterior , é de vapor úmido, o procedimento para se obter os dados é o mesmo do item a) resultando: para P3 = 0,1 bar e S3 = S2 X3 = 90,46 %, h3 = 2356,35 kJ/kg, v3 = 13,2738 m3/kg Obs. Assim, concluímos que a solução gráfica é bem mais rápida e significativa
Documentos relacionados
Propriedades das Substâncias Puras
 magnéticos elétricos, gravitacionais e cinéticos, única forma de trabalho reversível é
a variação de volume (P.dV);
Princípio de estado : o número de propriedades independentes requerido para
espec...
magnéticos elétricos, gravitacionais e cinéticos, única forma de trabalho reversível é
a variação de volume (P.dV);
Princípio de estado : o número de propriedades independentes requerido para
espec...
apostila-termo
 em todas as fases. Assim água líquida e vapor d'água ou uma mistura de gelo e água líquida são todas substância puras, pois cada fase tem a mesma composição
química. Por outro lado uma mistura de a...
em todas as fases. Assim água líquida e vapor d'água ou uma mistura de gelo e água líquida são todas substância puras, pois cada fase tem a mesma composição
química. Por outro lado uma mistura de a...