Capitulo 03 - WordPress.com
Transcrição
Capitulo 03 - WordPress.com
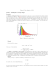
UFABC – NHZ3043 – NOÇÕES DE ASTRONOMIA E COSMOLOGIA – Curso 2016.2 Prof. Germán Lugones Capítulo 3: Noções de espectroscopia e fotometria Hubble Space Telescope como linha de base. t=0 Paralaxe A posição da Lua em relação às estrelas distantes é medida dua em lados opostos da Terraé usada e a paralaxe metade da v A paralaxe heliocêntrica para medircorresponde a distância dasàestrelas mais total na direção observada dos dois lados opostos Terra.medir Essa apa próximas. À medida que a Terra gira em torno do Sol,da podemos direção deparalaxe uma estrela em relaçãoeàsé estrelas de por: fundo quando a Terra está chamada geocêntrica expressa de um lado do Sol, e tornamos a fazer a medida seis meses mais tarde, RTerra Terra quando a Terra está do outro ladoRdo Sol. A metade do desvio total na p(rad) = °! d = posição da estrela corresponde à paralaxe que é expressa por: d heliocêntrica, p(rad) raio geocêntrica. da órbita da Terra 1 UA para p sendo p(rad) a paralaxe = °! d = d p(rad) para p sendo a paralaxeheliocêntrica heliocêntrica. 19.1.2 Paralaxe 19.2 19.2.1 Unidades de distâncias astronômicas Sol t=3 meses A unidade astronômica p r=1UA A unidade mais adequada para medir distâncias dentro do sistema solar é a d unidade astronômica (UA), que é a distância média da Terra ao Sol. Em 1 de t=0 19.2.3 O parsec Parsec Um parsec é a distância de um objeto tal, que um observador nesse objeto veria o raio da órbita da Terra com um tamanho angular de 100 , ou, em outras palavras, é a distância de um objeto que apresenta paralaxe heliocêntrica de 100 . 1 UA p = 1" d = 1 pc A distância de qualquer objeto, em unidades astronômicas, corresponde a: 1 d(UA) = p(rad) 169 Se a distância for 1 parsec, então a paralaxe será 100 . O ângulo de 100 , expresso em radianos, vale: µ ± ∂µ ∂ 1 2º rad 00 °6 1 = = 4, 848 £ 10 rad 3600 360± Logo: 1 pc = 1 UA = 206 265 U A °6 4, 848 £ 10 A distância de um objeto, expressa em parsecs, é dada por: d(pc) = 1 p(00 ) Um parsec, portanto, é igual a 206 265 UA, e é igual a 3,26 AL. Resumindo as três unidades, para uma estrela com paralaxe heliocêntrica qualquer, sua distância será: 1 206265 d(UA) = = p(rad) p(00 ) p(00 ) Um parsec, portanto, é igual a 206 265 UA, e é igual a 3,26 AL. Resumindo as três unidades, para uma estrela com paralaxe heliocêntrica qualquer, sua distância será: 1 206265 d(UA) = = p(rad) p(00 ) 1 d(pc) = 00 p( ) 3, 26 d(anos ° luz) = 00 p( ) A estrela mais próxima da Terra, Próxima Centauri, está a uma distância de 4,3 AL, que é maior do que 1 pc. Logo, mesmo para a estrela mais próxima, a paralaxe é menor do que 100 (na verdade é 0,7600 ). Até há poucos anos, com os telescópios de solo disponı́veis na Terra, a maior distância de estrelas que se podia medir com precisão melhor do que 10% era 20 pc, que corresponde a paralaxes ∏ 0, 0500 . O uso de CCDs e telescópios dedicados baixou a incerteza das observações feitas em solo para de 4,3 AL, que é maior do que 1 pc. Logo, mesmo para a estrela mais próxima, a paralaxe é menor do que 100 (na verdade é 0,7600 ). Até há poucos anos, com os telescópios de solo disponı́veis na Terra, a maior distância de estrelas que se podia medir com precisão melhor do que 10% era 20 pc, que corresponde a paralaxes ∏ 0, 0500 . O uso de CCDs e telescópios dedicados baixou a incerteza das observações feitas em solo para até 1 milisegundo de arco, similar à incerteza das observações com o satélite Hipparcos (HIgh-Precison PARallax COllecting Satellite), construı́do para medir com alta precisão a posição e paralaxe de 120 000 estrelas de nossa galáxia. É importante notar que 1 milisegundo de arco é o tamanho angular de uma pessoa na Lua vista da Terra. Para atingir essa precisão, foi necessário fazer a correcção pelo efeito relativı́stico do desvio da luz pelo Sol, que é de 1,7 segundos de arco na borda do Sol e 4 milisegundos de arco a 90± do Sol. 170 21.1 Intensidade Grandezas tı́picas do campo de radiação 21.1 Grandezas tı́picas do campo de radiação A grandeza mais caracterı́stica de um campo de radiação é uma constante chamada intensidade especı́fica monocromática I∫ , que é a energia uniA grandeza mais caracterı́stica de um campo de radiação é umapor constante dade de área e por unidade deespecı́fica tempo que está sendo Iemitida fonte, chamada intensidade monocromática a energia porem uni∫ , que é pela dade área e por unidade de tempo está sendo fonte, em um intervalo dede freqüências d∫, dentro de umque ângulo sólidoemitida d! = pela sen µdµd¡, um intervalo freqüências d∫,normal dentro de ângulo sólido d! = ou senseja: µdµd¡, o qual faz um ângulo µdecom a direção à um superfı́cie emissora, o qual faz um ângulo µ com a direção normal à superfı́cie emissora, ou seja: dE dE I∫ = I = ∫ cos µ d! d∫ dt dA dt dA cos µ d! d∫ S (21.1) (21.1) S I θ θ dA P dA dω I dω P A intensidade especı́fica, por sua definição, não depende da distância da fonte emissora, se não houverem fontes ou absorsores de radiação ao dA P longo da linha de visada. Geralmente, é medida em J m°2 s°1 sr°1 Hz°1 no sistema MKS, ou erg cm°2 s°1 sr°1 Hz°1 no sistema cgs. Um sr, chamado de A intensidade especı́fica, por sua definição, não depende da distância esferorradiano, é uma unidade de ângulo sólido (d! = sen µdµd¡). da fonte emissora, se não houverem fontes ou absorsores de radiação ao Podemos, também, definir a intensidade especı́fica monocromática por longo da linha de visada. Geralmente, é medida em J m°2 s°1 sr°1 Hz°1 no intervalo de comprimento de onda, notando que, por definição: sistema MKS, ou erg cm°2 s°1 sr°1 Hz°1 no sistema cgs. Um sr, chamado de esferorradiano, é uma unidadeIde|d∫| ângulo = I∏sólido |d∏|. (d! = sen µdµd¡). (21.2) ∫ Podemos, também, definir a intensidade especı́fica monocromática por intervalo de comprimento de integrada onda, notando que, opor definição: A intensidade especı́fica em todo espectro de freqüências é dada por: ZI 1|d∫| = I |d∏|. Z 1 (21.2) ∫ ∏ I= I∫ d∫ = I∏ d∏. (21.3) o o A intensidade especı́fica integrada em todo o espectro de freqüências é Outra interesse é o fluxo F, que é a energia por dada por: quantidade de grande Z 1 Z 1 unidade de área e por unidade de tempo que chega ao detector, e é o que I= I∫ d∫ = I∏ d∏. (21.3) se mede realmente. Formalmente, o fluxo em uma certa freqüência, em o o um Outra dado ponto e em uma dada interesse direção, éé ao quantidade de energia quantidade de grande fluxo F, quelı́quida é a energia por unidade de área e por unidade de tempo que chega ao detector, e é o que I= Z 1 Z 1 I∫Fluxo d∫ = o I∏ d∏. (21.3) o Outra quantidade de grande interesse é o fluxo F, que é a energia por unidade de área e por unidade de tempo que chega ao detector, e é o que se mede realmente. Formalmente, o fluxo em uma certa freqüência, em um dado ponto e em uma dada direção, é a quantidade lı́quida de energia radiante cruzando a unidade de área, por unidade de tempo, e por intervalo de freqüência, ou seja: 178 dF∫ = dE = I∫ cos µd! dAdtd∫ (21.4) que integrando nos dá o fluxo em uma freqüência (∫) F∫ = Z I∫ cos µd! = Z 0 2º Z º 2 I∫ cos µsen µdµd¡ (21.5) 0 O fluxo, portanto, significa potência através de uma superfı́cie, e é expresso em erg cm°2 s°1 , ou em watt m°2 . O fluxo integrado no espectro de freqüências será: O fluxo, portanto, significa potência através de uma superfı́cie, e é expresso em erg cm°2 s°1 , ou em watt m°2 . O fluxo integrado no espectro de freqüências será: Z 1 Z 1 F = F∫ d∫ = F∏ d∏. o o Ao contrário da intensidade especı́fica, o fluxo de radiação cai com o quadrado da distância (r), de forma que o fluxo que chega na Terra é muito menor do que o fluxo na superfı́cie do astro, estando diluı́do por um fator de r12 . Para uma estrela esférica de raio R, o fluxo na sua superfı́cie será: L F (R) = 4ºR2 (21.6) onde L é a luminosidade intrı́nseca, que é a energia total emitida por unidade de tempo em todas as direções. O fluxo a uma distância r da estrela será: F (r) = L 4ºr2 (21.7) m = °2, 5aparente log F + (21.8 expresso em termos da magnitude m,const. que por definição é dada por: Magnitude aparente mastro = °2,é5grego log F + const. (21.8) que oanos brilho deoum medido em magnitudes? 2000 ano MaisPor de 2000 atrás, astrônomo Hiparco inventou um Há sistema para atrás, o grego Hiparcovisíveis (160-125 estrelasno visı́veis olho nu d classificar as estrelas pora.C.) seudividiu brilho asaparente céu, aatribuindo Por que o brilho de um astro é medido em magnitudes? Há 2000 anos acordo com aparente, atribuindo magnitude 1 à seu maisbrilho brilhante e 6 às mais fracas. magnitude 1 à mais brilhante e 6 atrás, o grego Hiparco (160-125 a.C.) dividiu as estrelas visı́veis a olho nu de às mais fracas. Em 1856, Norman Robert Pogson (1829-1891) verificou qu acordo com seu brilho aparente, atribuindo magnitude 1 à mais brilhante e 6 Em 1856, Norman Pogson (1829-1891) verificou que o sistema, baseado o sistema, baseado na1856, percepção deRobert brilhoPogson do olho humano, é logarı́tmico, às mais fracas.Robert Em Norman (1829-1891) verificou que na debaseado brilho do humano, logarítmico, emagnitude o fluxo écorrespondente a o percepção fluxo correspondente apercepção uma estrela de primeira (m=1) erae 100 o sistema, naolho de ébrilho do olho humano, logarı́tmico, uma estrela primeira que magnitude (m=1)de eraprimeira 100 vezes mais que100 uma vezes maisde brilhante de magnitude 6, debrilhante modo o fluxo correspondente auma uma estrela estrela magnitude (m=1)que: era estrelavezes de magnitude 6, de que modo que: mais brilhante uma estrela de magnitude 6, deµmodo ∂ que: F1 µ F ∂1 m1 ° m2 = K log F1 °! 1 ° 6 = K log F1 F F 2 2 m1 ° m2 = K log °! 1 ° 6 = K log F2 F2 °5 = K log(100) °! K = °2, 5 °5 = K log(100) °! K = °2, 5 como na definição anterior. Portanto, como na definição anterior.Logo: Logo: FF 22 mm2 2°°m = °2, 5 log m11 = °2, 5 log FF 11 (21.9 (21.9) Normalmente, utiliza-se a magnitude aparente 180 da estrela Vega como m = 0. 180 Para comparação: • Sol: -26.74 • Lua: -2.50 a -12.74 • Vênus: -3.82 a -4.89 • Júpiter: -1.61 a -2.94 • Marte: 1.84 a -2.91 • Mercúrio: 5.73 a -2.45 • Sirius (estrela mais brilhante tirando o Sol): -1.44 • Saturno: 1.47 a -0.49 • objeto mais fraco já observado: ~36 A pupila do olho humano, quando adaptada ao escuro, tem aproximadamente 7 mm. Um telescópio com 7 cm de diâmetro, tem uma área (70 mm / 7 mm)2=100 vezes maior e portanto capta 100 vezes mais fótons. Desta maneira este telescópio de 7 cm de abertura permite observar 5 magnitudes mais fracas do que o olho humano, ou seja, até magnitude 6+5=11. Exercício: Duas estrelas A e B têm luminosidades 6,4 e 0,4 L⊙, respectivamente. Ambas são observadas com o mesmo brilho (magnitude) aparente. Qual é a estrela mais distante? m = C − 2,5 log F L F= 4π d 2 LA= 6,4 L⊙ e LB= 0,4 L⊙ ; mA=mB LA m A = C − 2,5 log 4π d A2 LB mB = C − 2,5 log 4π d B2 LA LB = 2 4π d A 4π d B2 2 6,4 ⎛ d A ⎞ d ⎟⎟ ⇒ A = 16 = ⎜⎜ 0,4 ⎝ d B ⎠ dB d A = 4d B absoluta A magnitude aparente de Magnitude uma estrela mede seu brilho aparente, que depen de sua distância. Por exemplo, será Sı́rius, com m=-1,42, intrinsicamen A magnitude aparente de uma estrela mede seu brilho aparente, que depende de mais brilhantePara do podermos que Vega,comparar com m=0? Para podermos os brilh sua distância. os brilhos intrínsecos comparar de duas estrelas, intrı́nsecos de duas estrelas, usar uma brilho precisamos usar uma medida de precisamos brilho que independa da medida distância.de Para isso, q independa da distância. isso,(M) definimos como magnitude absoluta definimos como magnitude Para absoluta a magnitude teórica que a estrela teria (M estivesse a 10 parsecsque de nós. asemagnitude teórica a estrela teria se estivesse a 10 parsecs de nós. M = °2, 5 log[F (10 pc)] + const. (21.1 A diferença entre a magnitude aparente e a183 absoluta é dada por: A diferença entre a magnitude aparente e a absoluta é dada por: m ° M = °2, 5 log[F (r)] + 2, 5 log[F (10 pc)] = °2, 5 log Como F (r) = F (10 pc) F (R)4ºR2 4ºr 2 F (R)4ºR2 4º(10 pc)2 F (r) (21.13 F (10 pc) (10 pc)2 100 pc2 = = r2 r2 (21.14 mM° = M °2, = °2, 5 log[F (r)]++2,2,55log[F log[F (10 pc)] ==°2, 5 log (21.13) m ° 5 log[F (r)] (10 pc)] °2, 5 log (21.13) F (10 pc) A diferença entre a magnitude aparente e a absoluta é dada por: F (10 pc) Calculemos: Como Como Como m°M = Como F (R)4ºR22 2 2 F (r) F (R)4ºR F (r) (10 pc) 100 pc 2 2 2 4ºr °2, 5 log[F +F2, 54ºrlog[F pc)] 5 log (21.13) F (r)(r)] (10 pc)= °2, 100 pc 2 2 (10 == = = (21.14) (R)4ºR 2 F (10 pc) 2 2 = = (21.14) 2 2 FF(R)4ºR 2 F (r) (10 pc) 100 pc 2 2 2 F (10 pc) r r (R)4ºR 4ºr F (10 pc)= r r = (21.14) 22 = 4º(10 pc) 4º(10 pc) 2 2 2 F (R)4ºR F (10 pc) r r 4º(10 pc)22 onde R é o raio da estrela, ou seja, F (R)4ºR onde R ééooraio raiodada estrela, ou seja, onde R estrela. Temos então: F (r) (10 pc)2 100 pc2 2 4ºr onde R é o raio da estrela,=ou seja, 2 = = 2 pc2 2 (R)4ºR 100 F (10 pc) m °FM r r 2 2 °2, 5 log 100 pc 4º(10=pc) 2 r m ° M = °2, 5 log100 pc2 ou m °ou Mseja, = °2, 5 log onde ouR é o raio da estrela, ou r2 r2 m ° M = 5 log r ° 5 pc2 (21.14) (21.15) (21.15) (21.15) (21.16) 100 m ° M = °2, 5 log (21.15) m ° M = 5 log r ° 5 o chamado módulo de distância. Nesta fórmula a distância da estrela, r, (21.16) 2 m ° M = 5 log r ° r5 (21.16) tem que ser medida em parsecs. o chamado módulo Nestafórmula fórmulaa distância a distância estrela, Logo, oouchamado módulo de de distância. distância. Nesta da da estrela, r, r, m°M +5 A tem grandeza (m − M) é denominada módulo de distância. Nesta fórmula(21.16) a distância tem que ser medida em parsecs. m ° M = 5 log r °5 5 r(pc) = 10 que ser medida em parsecs. da estrela, Logo, r, tem que ser medida em parsecs. Logo, o chamado módulo de distância. Nestam°M fórmula a distância da estrela, r, +5+5 m°M 21.2.4 Magnitude bolométrica r(pc) r(pc)==10 10 5 5 tem que ser medida em parsecs. Logo, Se tivéssemos um equipamento que tivesse 100% de sensibilidade em todos Logo, m°M +5 os comprimentos de onda, teoricamente poderı́amos obter o fluxo em todo 5 21.2.4 Magnitude bolométrica r(pc) = 10 21.2.4 Magnitude bolométrica o intervalo espectral. A magnitude correspondente ao fluxo em todos os comprimentos onda é a magnitude bolométrica Se tivéssemos umdeequipamento que tivesse 100%mde bol .sensibilidade em todos Se tivéssemos um equipamento que tivesse 100% de sensibilidade em todos Índice de cor As magnitudes aparentes e absolutas introduzidas antes, são medidas considerando todos os comprimentos de onda emitidos pela estrela. Elas se denominam magnitudes bolométricas e serão designadas como mbol e Mbol. Porém, na prática, os detectores medem o fluxo de uma estrela apenas dentro de um certo intervalo de comprimentos de onda, definido pela sensibilidade espectral do do conjunto telescópio + filtro + detector. A cor de uma estrela pode ser determinada de forma precisa usando filtros que transmitem a luz da estrela apenas dentro de uma certa banda estreita de comprimentos de onda. No sistema fotométrico UBV, a magnitude aparente da estrela é medida através de três filtros. Temos então três magnitudes: • U (ultraviolet) medida com um filtro centrado em λ=365 nm com largura de banda de 68 nm. • B (blue) medida com um filtro centrado em λ=440 nm com largura de banda de 98 nm. • V (visible) medida com um filtro centrado em λ=550 nm com largura de banda de 89 nm. • U, B e V representam os brilhos ou magnitudes aparentes (mU, mB , mV) nas bandas do ultravioleta, azul e visível. • Os sistemas fotométricos também se estendem para outras faixas espectrais como o vermelho (R,I) e o infravermelho (J, H, K, L, M..) Em qualquer sistema de magnitudes multicor define-se os índices de cor como a razão entre os fluxos em duas bandas diferentes, ou equivalentemente, como a diferença entre duas magnitudes do sistema: • subtraindo a magnitude V da magnitude B temos o índice de cor B−V, o qual é dado por: B−V = mB− mV = −2.5 log (FB / FV) • subtraindo a magnitude B da magnitude U temos o índice de cor U−B, etc. • Por convenção, fazemos: banda mais azul – banda mais vermelha Como veremos adiante, os índices de cor são importantes para determinar a temperatura das estrelas. Os índices de cor têm valores típicos de décimos ou centésimos de magnitudes. Exemplo: O índice de cor depende da temperatura da estrela. Para ver isso, consideremos três estrelas a, b, c tais que Ta > Tb > Tc . (a) Estrela quente (30.000 K): sua intensidade (e fluxo) na banda azul (B) > banda visível (V): FB > FV ⇒ B < V ⇒ [B-V] < 0 ⇒ é mais azulada. (b) T=10.000 K: intensidades em B e V são iguais. (c) Estrela fria (3.000 K): intensidade em B < V. FB < FV ⇒ B > V ⇒ [B-V] > 0 ⇒ é mais avermelhada. As cores das estrelas estão relacionadas com a sua temperatura na superfície. Por exemplo, na constelação de Orion: • Rigel (β) é azul (T=15000K) • Betelgeuse (α) é vermelha (T=3000K) Extinção atmosférica Embora a atmosfera seja praticamente transparente na faixa visível (350 nm a 650 nm), ela absorve fortemente no ultravioleta (100 a 350 nm) e em várias bandas do infravermelho (1 µm a 1 mm), de modo que não podemos medir ultravioleta do solo, e infravermelho somente acima de 2000 m de altura. Janelas na Atmosfera Terrestre: na superfície, somente pode ser detectada radiação das janelas no óptico, em partes do infravermelho e em rádio. Astronomia Espacial: para os casos em que atmosfera é opaca (raios-gama, raios-X e UV): detectados com equipamentos em aviões, balões e satélites. Fig. 3.2. The transparency of the atmosphere at different wavelengths. 100% transmission means that all radiation reaches the surface of the Earth. The radiation is also absorbed by inter- stellar gas, as shown in the lowermost very schematic figure. The interstellar absorption also varies very much depending on the direction (Chap. 15) to 1.3 µm. There are some absorption belts caused by At optical wavelengths (300–800 nm), light is scat- A transparência da atmosfera em diferentes comprimentos de onda. transmissão 100% significa que toda a radiação atinge a superfície da Terra. A radiação também é absorvida pelo gás interestelar, como mostrado na figura mais inferior (muito esquemática). Na atmosfera, existem vários componentes que difundem a luz em todas as direções (moléculas, partículas sólidas de poeira e fumaça), causando uma extinção contínua, em todos os comprimentos de onda. A extinção é tanto maior quanto maior for a quantidade de ar atravessada pela luz. É por esse motivo que podemos olhar diretamente para o Sol quando ele está no horizonte. Como a atmosfera da Terra afeta as medidas, devemos ajustar as magnitudes observadas aos valores que teríamos se as observações fossem feitas fora da atmosfera. O efeito da atmosfera é o de absorver e espalhar a radiação em outras direções, processos esses que são descritos por um coeficiente de absorção k, usualmente medido em cm-1. por um coeficiente de absorção k, usualmente medido em cm°1 . observadas devemem seroutras ajustadas aos valores que terı́amos se assão observações espalhar a radiação direções, processos esses que descritos fossem feitas fora da atmosfera. O efeito da atmosfera de. absorver e ❈ é o°1 por um coeficiente de absorção k, usualmente medido I oem cm Z espalhar a radiação em outras direções, processos esses que são descritos °1 ❈ por um coeficiente de absorção k, I o em cm . Z usualmente medido ❈ Io Z x dx z ds x x+dx x dx dx z I ds z ds (x + dx)Ipróximas = F (x) °dakF (x)ds, Consideremos o fluxo em duasFcamadas atmosfera: x+dx dF = F (x + dx)I° F (x) = °kF (x)ds F (x + dx) = F (x) ° kF (x)ds, Para distâncias zenitais F pequenas, podemos aproximar (x + dx) = F (x) ° kF (x)ds, a atmosfera por uma dFespessura = F (x + constante dx) ° F (x) =então, °kF (x)ds camada plana de escrever dx = dF = F (x + dx) ° F e, (x) = °kFpodemos (x)ds dsdistâncias cos z !zenitais dszenitais = secpequenas, zdx, ondepodemos z épodemos a distância zenital, Para pequenas, aproximar a atmosfera por camada uma Para distâncias aproximar a atmosfera por uma Para distâncias zenitais pequenas, podemos aproximar a atmosfera por uma plana de espessura constante e, então, podemos dx=cos(z)ds ⇒ ds=sec(z)dx, camada plana de espessura constante e, escrever então, podemos escrever dx = = camada plana de espessuradF constante e, então, podemos escrever dx = °k sec z zenital, dx onde z é za distância zenital, ds cos ! ds = sec zdx, onde z é a distância ds cos z ! ds = sec zdx, ondeFz é a distância zenital, dF dF Fo o fluxo no topo da atmosfera e F o Sendo H a altura da atmosfera, = °k secsec z dx = °k z dx que chega ao observador. Então: F F Z Z x+dx = °k sec z dx F Seja H a altura da atmosfera, Fo o fluxo no topo da atmosfera e F o que chega ao Sendoentão: H a altura da atmosfera, Fo o fluxo no topo da atmosfera e F o observador, que chega ao observador. Então: Z F Z H dF = °k sec z dx Fo F o e ln F = °k sec zH °! F = Fo e°k sec z H . Fo 186 A grandeza k sec(z)H é denominada espessura ótica 𝜏. Temos, assim,k sec a espessura expressa da assim, distância zenital z. Supondo O termo z H é a ótica espessura óticaemø .função Temos, a espessura ótica queexpressa a atmosfera formadadapor camadas zenital plano-paralelas, ela pode seraexpressa em éfunção distância z e, supondo que camadapor at-𝜏 = 𝜏o mosférica sec(z), ondeé 𝜏formada a espessura na direção do ela zênite. o = kH épor camadasótica plano-paralelas, pode ser expressa por ø = øoosec z, será: onde øo = kH é a espessura ótica na direção do zênite, e o Portanto, fluxo fluxo será: F = Fo e°ø = Fo e°øo sec z (21.19) Em magnitudes, essa equação fica: m = °2, 5 log Fo + (2, 5 log e) øo sec z = mo + K · X F = Fo e°ø = Fo e°øo sec z Na expressão anterior, aplicamos −2,5 log(…) em ambos lados da equação: Em magnitudes, essa equação fica: (21.19) m = °2, 5 log Fo + (2, 5 log e) øo sec z = mo + K · X m = mo + 1, 086 øo sec z = mo + 1, 086 ø = mo + K · X (21.20) onde K = 1, 086øo é o coeficiente de extinção, e X = sec z é a massa de ar. exemplo aplicaçãodedeste conceito considerarmos umamassa estrela onde KUm = 1,086 𝜏o é odecoeficiente extinção, e X =é sec(z) é denominado observada a uma distância zenital de 45o . Como sec 45o = 1, 41 e usando um de ar. coeficiente kH = 0, 46, tı́pico de observações óticas, obtemos F = 0, 52 Fo ou seja, a atmosfera terrestre absorve 48% da luz da estrela ao observarmos a 45o do zênite. o A diferença (m ° moestrela ) é a extinção em zenital magnitudes Exemplo: consideremos uma observadaatmosférica a uma distância de 45 .e é deter minada através de estrelas padrões para as quais mo é conhecido. o Como sec 45 = 1,41 e usando um coeficiente kH = 0,46, típico de observações A constante K é caracterı́stica do meio e depende do comprimento de óticas, obtemos F = 0, 52 Fo, ou seja, a atmosfera terrestre absorve 48% da luz da onda, sendo mais correto escrever o estrela ao observarmos a 45 do zênite. m(∏) = mo (∏) + K(∏) · X. Para o sistema UBV, e para locais situados acima de 1500 m de altitude os valores dos coeficientes de extinção são: K(U ) ' 1, 48, K(B) ' 0, 56 e observada a uma distância zenital de 45 . Como sec 45 = 1, 41 e usando um observada a uma zenitaldedeobservações 45o . Como óticas, sec 45o obtemos = 1, 41 e Fusando um coeficiente kH distância = 0, 46, tı́pico = 0, 52 Fo , A diferença (m m ) é a extinção atmosférica em magnitudes. Ela o terrestre coeficiente = 0, 46, tı́pico deabsorve observações óticas, F observarmos = 0, 52 Fo , é ou seja, akH atmosfera 48% da luz daobtemos estrela ao determinada através de estrelasabsorve padrões48% para da as quais o é conhecido. ouaseja, a atmosfera terrestre luz damestrela ao observarmos 45o do zênite. a 45o A dodiferença zênite. (m ° mo ) é a extinção atmosférica em magnitudes e é deter A diferença °m atmosférica e é detero ) é a extinção através de estrelas padrões para as quaisem m é conhecido. A minada constante K é(mcaracterística do meio e depende doomagnitudes comprimento de onda. minada através de estrelas padrões para as quais m é conhecido. o A constante K é caracterı́stica do meio e depende do comprimento de Portanto, é mais correto escrever A constante K écorreto caracterı́stica onda, sendo mais escrever do meio e depende do comprimento de onda, sendo mais correto escrever m(∏) = mo (∏) + K(∏) · X. m(∏) = mo (∏) + K(∏) · X. Para o sistema UBV, e para locais situados acima de 1500 m de altitude, o sistema UBV, e para situados acima de1,1500 de altitude, osPara valores dos coeficientes de locais extinção são: K(U )' 48, m K(B) ' 0, 56 e osK(V valores ) ' dos 0, 40.coeficientes de extinção são: K(U ) ' 1, 48, K(B) ' 0, 56 e K(V )No ' 0, 40. exemplo de observarmos uma estrela a 45o do zênite, vemos nosso o doo zênite, vemos Noa nosso exemplo de observarmos estrela a 45 que extinção atmosférica neste caso uma equivale a 1, 46 sec 45 = 2, 09 mag em o = 2, 09 mag em o = 0, 79 mag que neste equivale a o1,= 460,sec U,a0,extinção 56 sec 45atmosférica em caso B e 0, 40 sec 45 5745 mag em V. o = 0, 79 mag em B e 0, 40 sec 45o = 0, 57 mag em V. U, 0, 56 sec 45 Como vemos, os coeficientes de extinção decrescem de U para V, indiComoque vemos, os coeficientesdedeonda extinção decrescem deabsorvidos U para V, eindicando os comprimentos menores são mais espacando que comprimentos onda menores sãoé mais lhados doosque os maiores, edeportanto a luz azul mais absorvidos extinguida edoespaque a lhados do que os maiores, e portanto a luz azul é mais do que a vermelha. Portanto, a extinção torna as estrelas maisextinguida avermelhadas. vermelha. Portanto, a extinção torna as estrelas mais avermelhadas. propagar em de quanta discretos, ou fótons, cada um com energia E = h∫. Radiação corpo negro essa quantização da energia, ele pode deduzir teoricamente a intensida um campo de radiação, como demonstrado a seguir. A radiação de corpo negro é o tipo de radiação eletromagnética emitida por um corpo em equilíbrio termodinâmico (radiação em equilíbrio com a matéria) a uma temperatura T. A radiação tem um espectro e intensidade específica que depende apenas da temperatura do corpo. Em 1900, Planck postulou que a energia eletromagnética só pode se propagar em quanta discretos, ou fótons, cada um com energia E=h𝜈. Com essa quantização da energia, ele deduziu teoricamente a intensidade de um campo de radiação. Lei de Planck T=10 000K 30 20 T=9000K 10 T=7000K T=5500K 0 2000 4000 6000 8000 2000 4000 6000 8000 A intensidade especı́fica monocromática (energia unidade de compri- de A intensidade específica monocromática (energia por por unidade de comprimento mento onda,de portempo, unidade tempo,depor unidade de área, de e por unidade onda, por de unidade porde unidade área, e por unidade ângulo sólido) de ângulo detemperatura um corpo que tem uma temperatura uniforme T que umde corpo que sólido) tem uma uniforme T que está em equilíbrio termodinâmico A equilı́brio intensidade especı́fica monocromática (energia por unidade de compriestá com seu B próprio campo de radiação, isto com seuem próprio campotermodinâmico de radiação, é chamada 𝜆(T) e é dada pela Lei de Planck: por B unidade tempo, porLei unidade de área, e por unidade é, émento opaco,deé onda, chamada é dada pela de Planck: ∏ (T ) e de de ângulo sólido) de um corpo que tem uma temperatura uniforme T que cE está em equilı́brio termodinâmico com campo de radiação, isto B∏ (T )d∏ = ° seudnpróprio b (p), é, é opaco, é chamada B∏ (T ) e é dada4º pela Lei de Planck: onde E é a energia da partı́cula, c é a velocidade da luz, e dnb (p) é o número cE dnb (p), ∏ (T )d∏ =à° de fótons com momentum p, B associado energia E, e é dado pela distribuição 4º onde E é a energia da partícula, c é a velocidade da luz. de momentum p de Bose-Einstein de um gás de bósons de spin s [veja seção onde E é a energia da partı́cula, c é a velocidade da luz, e dnb (p) é o número (24.1)]: A grandeza dnb(p) o número dep,fótons comàmomentum e é dado distribuição de fótons comé momentum associado energia E, ep, é2 dado pelapela distribuição (2s +de1)bósons 4ºpspin dpde de momentum de Bose-Einstein s=1: de momentum pdn deb (p) Bose-Einstein de um gás de de bósons = de um gás , spin s [veja seção 3 exp[(E ° µ)/kT ] ° 1 h (24.1)]: (2s + 1) 4ºp2 dp dnb (p) = , exp[(E191 ° µ)/kT ] ° 1 h3 sendo µ o potencial químico. 191 resenta odo número de de partı́culas independenproduto volume espaço e(estados de momentum. 2 o produto do volume espaço ezero de momentum. 2hc 1 esma energia E, eque o termo h°3deé de necessário devido Para um fóton, é um bóson massa e spin 1, E = h∫, p = h∫/c, B (T ) = Para um fóton, que é um bóson de massa zero e spin 1, E = h𝜈, p = h𝜈/c, 𝜆p==c/𝜈 eµ= ∏ e spin 1,5 E hc/∏kT Para um fóton, que é um bóson de massa zero = h∫, h∫/c, eza de Heisenberg, proposto em 1927 por Werner Karl ∏ e ° 1 = c/∫ e µ = 0. Com esses valores se pode obter: Com valores pode obter:da 6), 0. que define o menor tamanho possı́vel célula se para ∏ =esses c/∫ eµ= 0.seCom esses valores pode obter: de espaço e de momentum. onde2hc h 2é a constante de Planck, e k = 1, 38 £ 10°16 ergs/K é a 1 2 B∏e(T )Boltzmann. =1, E 5= h∫, (21.21) e é um bóson de massa zero spin p =2hc h∫/c, 1 hc/∏kT ∏ e ° 1 B∏ (T ) = 5 hc/∏kT (21.21) m esses valores se pode obter: Para escrever a lei de Planck em termos de freqüência, preci ∏ e °1 a equação (21.2), e ergs/K é a constante de de h é a constante de Planck, e k = 1, 38 £ 10°16 2 2hc 1 d∫ B∏ (Tonde ) = h5 é ahc/∏kT constante de Planck, e (21.21) k = 1, 38 £ 10°16 ergs/K éca constante de oltzmann. = ° ∏ e °1 -16 ergs/K é a constante 2 Boltzmann. ondeescrever h é a constante de Planck, e k=1,38×10 d∏ utilizar ∏de Para a lei de Planck em termos de freqüência, precisamos Boltzmann. -2 Hz-1 sr-1 tem de°16 mde obtendo equação aWlei Planck em termos utilizar 𝜆(T) (21.2), de B Planck, ePara kunidades = e1,escrever 38 £ 10 ergs/K é a constante de de freqüência, precisamos 2 ∏ a equação (21.2), e d∫ = ° c B = B ∫ ∏ Para escrever a lei de Planckd∏ em termos de frequência, fazemos: c ∏2 d∫ de Planck em termos de freqüência, precisamos utilizar c =° 2 ou tendo d∏ ∏ 2 d∫ c ∏ 2h∫ 3 1 =° 2 B∫ = B∏ obtendo B (T ) = ∫ d∏ ∏ c c2 eh∫/kT ° 1 ∏2 B∫ = B∏ 2 onde, em do csistema internacional: ∏ 3 unidades 2h∫ 1 ouB∫ = B∏ c B∫ (T ) = 2 (21.22) °34 c eh∫/kT ° 1 3 h =2h∫constante Js, 1 de Planck = 6, 63 £ 10 8 °1 Essa intensidade específica nãoBdepende qualquer propriedade do10corpo a, não ser (21.22) ∫ (T )c ==de2velocidade da luz = 3 £ m s 2h∫ 3 do sistema 1 h∫/kT de, em unidades internacional: c e termodinâmico °1 B∫ (T ) = 2 h∫/kT (21.22) sua temperatura. Qualquer corpo em equilíbrio emitirá fótons comJ K k = constante de Boltzmann = 1, 38 £ 10°23 c e °1 °34 pela Lei de Planck. Esta radiação, uma onde, distribuição de comprimentos onda unidades sistema internacional: h = emconstante dedoPlanck = de 6, 63 £ 10dada Js, sistema internacional: 8 °1 chamada de radiação de da corpo negro, ou m radiação térmica,não não depende depende da de pr Essa de direção qualquer c = velocidade luz = 3 intensidade £ 10 s , especı́fica °34 °23£ 10°1 eJs, h 63= constante de Planck 6, °34 emissão e=nãoconstante corpo ser1, sua Boltzmann 38 = £temperatura, 1063 J K . B∫ tem unidades de W m stante de kPlanck =é6,polarizada. £ 10de Js, a não = 8 c 8 = °1 velocidade da luz = 3 £ 10 m s°1 , 21.3.2 Lei de Wien Lei de Wien Como podemos ver da figura com a Lei de Planck, a freqüência em que a intensidade é máxima varia com a temperatura. O máximo (e o mı́nimo) de qualquer função é dado para o ponto em que a derivada é nula. Derivando a Lei de Planck B∏ (T ) e igualando a derivada a zero, logo dB∏ (T ) 10hc2 2hc2 ∏2hckT ehc/∏kT ¢+ 5 ° = ° 6 ° hc/∏kT ¢2 = 0 hc/∏kT d∏ ∏ ∏ e °1 e °1 hc ehc/∏kT ° ¢ =5 hc/∏kT ∏kT e °1 hc Fazendo-se a substituição de variáveis x ¥ ∏kT , obtém-se uma equação transcendental: 1 e°x + x ° 1 = 0 5 que pode ser resolvida numericamente, obtendo-se: ∏max T = 0, 0028978 K m (21.23) e o máximo de B∫ (T ) ocorre em h∫max = 2, 821 k T (21.24) h∫max = 2, 821 k T (21.24) Note que ∏max não é igual a c/∫max pois B∏ não é igual a B∫ . Essa relação, encontrada empiricamente por Wilhelm Wien, mostra que, à medida que T aumenta, ∫max aumenta, ou ∏max diminui. Dessa maneira, se explica porque quando se aquece uma barra de ferro, ela torna-se primeiro vermelha e depois esverdeada e azulada. 21.3.3 Lei de Stefan-Boltzmann Em 1884, o matemático austrı́aco Josef Stefan (1835-1893) e seu aluno na época, o também austrı́aco Ludwig Boltzmann (1844-1906), descobriram 193 Lei de Stefan-Boltzmann Em 1884, Stefan e seu aluno na época, Boltzmann, descobriram empiricamente que que oo fluxo fluxo (energia (energia por por unidade unidade de de área, área, por por unidade unidade de de empiricamente tempo) de T éTdado por por: tempo) de um umcorpo corponegro negrodedetemperatura temperatura é dado Z º/2 Z 1 empiricamente que fluxo (energia pordµ unidade área, F =o 2º cos µ senµ B∫de (T )d∫ = por æT 4 unidade de tempo) de um corpo negro0 de temperatura T0 é dado por: Z ergs Z 1 °5 °2 K°4 s°1 º/2 onde æ = 5, 67 £ 10 cm = 5, 67Stefan-Boltzmann. £ 10°8 W4m°2 K°4 é a cons−8 −2 −4 onde 𝜎 = 5,67 ×10 Wm K é a constante de F = 2º cos µEssa senµ dµ B∫ser (T )d∫ = æT tante de Stefan-Boltzmann. lei pode demonstrada considerando 0 0 que: Z K1°4 s°1 = 5, 67Z£110°8 3W m°2 K°4 é a consonde æ = 5, 67 £ 10°5 ergs cm°2 2h que: ∫ d∫ EssadeleiStefan-Boltzmann. pode ser demonstrada considerando tante pode ser demonstrada considerando B(T ) ¥ Essa Blei d∫ = ∫ h∫ 2 c 0 0 e kT ° 1 que: Z 1 Z h∫ 2h 1 ∫ 3 d∫ e definindo-se Æ ¥ kT , B(T ) ¥ B∫ d∫ = 2 h∫ µ ∂ c 4 Z 01 e kT 0 1 2h kT Æ°3 dÆ h∫ B(T e definindo-se Æ ¥ kT , ) = c2 h eÆ (1 ° e°Æ ) 0 " 1 3 # µ µ ∂4 ∂ Z 1 4 2h 2hkT Æ dÆ X kT 1 B(T ) = = 2 6 Æ °Æ c c2 h h 0 e (1 ° )4 (ne+ 1) " # µ ∂4 X 1 n=0 µ ∂ 2h kT 1 4 4 = 6 2h kT º æ 44 (n +T1) =c2 2 h = n=0 cµ ∂ h 15 º 4 e definindo-se Æ ¥ B(T ) ¥ h∫ kT , e definindo-se Æ ¥ h∫ kT , Z 0 0 1 ∫ 2Z 1 0 c 2h B∫ d∫ = 2 c µ ∂4 Z 0 h∫ e∫ 3kTd∫° 1 h∫ e kT ° 1 2h µkT ∂ Z 1 Æ3 dÆ 4 1 3 dÆ B(T ) = 2h kT Æ 2 Æ e (1 ° e°Æ ) B(T ) = c 2 h 0 c µ h ∂4 "0 1 eÆ (1 ° e°Æ ) # X 2h µkT ∂4 " X 1 # 1 2h kT 1 = 6 4 = c2 2 h 6 (n + 1) 4 c h n=0(n + 1) n=0 µµ ∂ ∂4 4 2h 2h kT kT 4 ºº4 ææ 4 4 == 2 == TT c c2 hh 15 ºº 15 estrela é um corponegro, negro, pois pois suas externas, de onde UmaUma estrela nãonão é um corpo suascamadas camadas externas, de onde 2 provém a radiação, não estãoexatamente exatamente em térmico. 2 Escreveprovém a radiação, não estão emequilı́brio equilı́brio térmico.Escrevemos para o fluxo na fotosfera da estrela: mos para o fluxo na fotosfera da estrela: F ¥ æTef44 2 F ¥ æTef (21.25) (21.25) Se o gás frio está na frente da fonte luminosa, não tem uma hora em que depois ele na fica frente quente da e começa emitir luz não também? O quehora acontece com depois o Sedeobloquear gás frioluz está fonte aluminosa, tem uma em que equilı́brio termodinâmico nessee caso? de bloquear luz ele fica quente começa a emitir luz também? O que acontece com o Esse caso, que ocorrenesse na atmosfera equilı́brio termodinâmico caso? de uma estrela, é chamado equilı́brio termodinâmico local. É um conceito importante na teoria de interiores de estrelas e evolução estelar. Esse caso, que ocorre na atmosfera de uma estrela, é chamado equilı́brio termodinâmico As camadas mais internas das estrelas são mais quentes e emitem mais radiação que as local. camadas É um conceito importante interiores de estrelas evolução mais externas. Assim,naa teoria luz (ou de melhor, a radiação, pois a emaior parteestelar. não é As camadas mais internas das estrelas são mais quentes e emitem mais radiação que as visı́vel), sai de uma camada quente mais interna [chamemos de camada (n ° 1)], passa pela camadas maisconsiderada externas. (n) Assim, a luz melhor, a mais radiação, pois a 1). maior camada e atinge uma(ou camada FRIA externa (n + Paraparte havernão é 2 Espectroscopia Espectroscopia é o estudo da luz através de suas cores componentes, que aparecem quando a luz passa através de um prisma ou de uma rede de difração. A sequência de cores formada é chamada espectro. Quase toda informação sobre as propriedades físicas das estrelas são obtidas direta ou indiretamente de seus espectros, principalmente suas temperaturas, densidades e composições. SECTION 4.1 Spectral Lines Espectro contínuo e Interactive FIGURE 4.2 Continuous a espectro de emissão: Emission Spectra When passed through slit and split up by a prism, light from a source continuous radiation (a) gives rise to the famil rainbow of colors. By contrast, the light from excited hydrogen gas (b) consists of a series of distin bright spectral lines called emission lines. (The focus lenses have been omitted for clarity—see Section 5. (a) Quando passa através de um prisma, a luz de uma fonte de radiação contínua dá origem familiar arco- the p found in theao gaseous state. Sometimes írisofde cores (espectro tern lines was fairly simple, and sometim itcontínuo). was complex, but it was always unique to t Screen Prism Hot bulb (a) Emission lines R Screen Prism Heated hydrogen gas (b) GV element. Even though the origin of the li was not understood, researchers quickly re (b) that Recipiente de gás de ized the lines provided a one-of-a-ki hidrogênio. uma “fingerprint” of the Após substance under investi tion. They could detect thesobre presence of a p descarga elétrica ticular atom or molecule (a group of atoms h ele (similar a relâmpago together by chemical bonds—see Section 4 na atmosfera) o gás é solely through the study of the light it emitt aquecido emite luz. Scientists have e accumulated extensive catal ofObserva-se the specific wavelengths at which many d um espectro ferent gases emitlinhas radiation. The particu comhotpoucas pattern of light emitted by a gas of a given che brilhantes superpostas a ical composition is known as the emission sp fundo escuro trum of the gas. The (espectro emission spectra of so common substances are shown in Figure 4.3. de emissão). Hydrogen Sodium Helium Neon Mercury 650 ▲ 600 550 500 Wavelength (nm) 450 400 350 FIGURE 4.3 Elemental Emission The emission spectra of some well-known elements. In accordance with the convention adopted throughout this text, frequency increases to the right. Note that wavelengths Os espectros de emissão de alguns elementos conhecidos. Note-se que os shorter than approximately 400 nm, shown here in shades of purple, are actually in the ultraviolet part of the comprimentos de onda curtos queInstrument ~ 400 nm, spectrum and thus invisible to the mais human eye. (Wabash Corp.)mostrados em tons de roxo, estão na parte ultravioleta do espectro e são invisíveis ao olho humano. Espectro de absorção: Quando um gás frio é colocado entre uma fonte de radiação contínua e um detector/tela, o espectro de cor resultante é atravessado por uma série de linhas de absorção escuras. Estas linhas são formadas quando o gás frio absorve certos comprimentos de onda do feixe de luz original. As linhas de absorção aparecem precisamente no mesmo comprimento de onda que as linhas de emissão que seriam produzidas se o gás fosse aquecido a altas temperaturas. SELF-GUIDED TUTORIAL Absorption Spectra vapor em just two 589.0 nm of the sp ◀ FIGURE visible spe vertical da on a brigh high-resol a series of vertically; e of the ent The scale (red) at the (blue) at th chapter-o (AURA) Espectro solar: O espectro visível do Sol mostra centenas de linhas de absorção escuras verticais sobrepostas em um espectro contínuo Absorption brilhante. Este espectro de altaIn lines resolução mostra uma série de 48 faixas horizontais. Cada faixa cobre uma pequenaA parte do espectro (da esquerda para a direita). A escala estende de comprimentos deco so onda longos (vermelho) no canto superior esquerdo até comprimentos de onda curta(s (azul) no canto inferior direito. detector Screen 700 600 500 400 nm c so in (b) The a shows t wavelen emission (a) (b) In S 700 600 500 400 nm (a)O espectro emissão do sódio: linhas brilhantes emissão aparecem na T spectrum de is passed through someduas relatively cool sodium defaint emission lines is seen. parte amarela do espectro. vapor, two sharp, dark absorption lines appear at precisely lost by the forward beam. If th the same wavelengths. The emission and absorption spectra cence, it would produce stron (b)Espectro de absorção do sódio: as duas linhas escuras aparecem na mesma of sodium are compared in Figure 4.6, clearly showing the the same wavelengths. posição das linhas de emissão. relation between emission and absorption features. Kirchhoff’s Laws Identifying Starlight The analysis of the ways in which matter emits and absorbs radiation is called spectroscopy. One early spectroscopist, the German physicist Gustav Kirchhoff, summarized the observed relationships among the three types of spectra— By the late 19th century, sp a formidable arsenal of tech radiation received from spa that spectral lines were indi tion, they set about identifyi Leis de Kirchhoff Em 1814, Joseph von Fraunhofer obtém o espectro do Sol e descobre que é composto de um contínuo e de linhas. Durante o século 19, linhas de outros elementos químicos são descobertas nos laboratórios. Também são descobertas linhas do espectro solar desconhecidas nos laboratórios na Terra. Por exemplo, o elemento hélio (do grego = sol) foi descoberto no espectro solar. Detectado na Terra so em 1895! Nos anos 1860, Gustav Kirchhoff formula as leis que resumem as diferentes formas como matéria emite os 3 tipos de espectro possíveis. 1. Espectro contínuo: um corpo opaco quente, sólido, líquido ou gasoso, emite um espectro contínuo. Por exemplo, o filamento de uma lâmpada incandescente (sólido), a lava de um vulcão (líquido), uma estrela (gás denso). 2. Espectro de emissão: um gás transparente (isto é, pouco denso), produz um espectro de linhas brilhantes (de emissão). O número e a cor (posição) dessas linhas depende dos elementos químicos presentes no gás. Por exemplo, uma lâmpada fluorescente. 3. Espectro de absorção: se um espectro contínuo passar por um gás a temperatura mais baixa, o gás frio causa a presença de linhas escuras (absorção). O número e a posição dessas linhas depende dos elementos químicos presentes no gás. Por exemplo, o sol e sua atmosfera. (a) A fonte tem fótons de todas as energias (λs), i.e. tem um espectro continuo. (b) Quando a radiação da fonte passa pelo gás, este só pode absorver fótons com determinadas energias. Os fótons absorvidos causam transições atômicas no gás e são removidos do espectro causando linhas escuras de absorção superpostas ao espectro continuo (da fonte). As linhas escuras não significam ausência de luz, somente o contraste de menos luz. (c) Uma visão lateral da nuvem não permite ver claramente o espectro contínuo da fonte que a ilumina. No entanto, parte da radiação absorvida é reemitida em todas as direções, produzindo linhas de emissão observadas em uma linha de visada lateral. ntum number, as we will see, is related to the energy in the hydrogen atom. Aoforigem dasenergy linhas espectrais: e!luz nátomos ! 7-6. 1 If the !0 R10 ! -5 shows a sketch the potential function of Equation total s positive, the electron is not bound to the atom. We are interested here only início do os cientistas começaram estabelecer as bases para a -stateNo solutions, forséculo which XX, the values of E are negative. For athis case, the pon !in 2thecomeçaram ! !As0 a aprender R20 ! compreensão da formação espectros à medida que eles nergy function becomes greaterdos than E for large r, as shown figure. mais sobre a estrutura átomos e a natureza da luz. discussed previously, fordos bound systems only certain values of the energy E well-behaved solutions. These values are found by solving the radial equation, !!1 R21 ! formed by equating the left side of Equation 7-12 to the constant !(! % 1). of the hydrogen atom, by Equation 7-6,são theoradial equation is Hoje sabemos quegiven as linhas espectrais resultado de transições quânticas dos n !dos 3 átomos. !!0 R30 ! elétrons entrekZe níveis de 2 energia discretos 2 U $R(r) !(! % 1) U2 que $ acontecem % " a r2 b % c" d R(r) ! ER(r) 7-24 2 2 r 2#r $r $r 2#r !!1 R31 ! al equation can be solved using standard methods of differential equations Consideremos por exemplo o espectro de átomos hidrogenoides. Resolvendo a etails we will omit de here, except to note that (1) we expect a link to appear seguinte equação Schrödinger the principal quantum number n and the angular momentum quantum !!2 R32 ! ! (since the latter already appears in Equation 7-24) and (2) in order that tions of Equation 7-24 be well behaved, only certain values of the energy wed, just as we discovered for the square well and the harmonic oscillator. obtemos de energia: wed valuesos of autovalores E are given by Z2 E1 where E1 ! (1>2)(ke2>U)2& ! 13.6 eV a kZe 2 2 # En ! " a b ! " 2 on the values n ! 1, 2, 7-25 3, . . ., with the fu n= 1,2,3,…. U 2n2 n These energy values are identical to those zados, já que n=1,2,3,... só assume números inteiros, isso é, assumindo-se queOs as níveis órbitasdesão quantizadas, obtém-se os nı́veis de são quanenergia do hidrogênio sãoque quantizados, já energia que n =1,2,3,... só tizados.números Note que essa teoria só dá resultados corretos para o hidrogênio. assume inteiros. Para outros átomos, é preciso usar a mecânica quântica completa. Por conservação de energia, quando um átomo passa de um nı́vel de energia maior, n1 para outro de energia menor, n2 , há emissão de um fóton com energia: Ef óton = E(n1 ) ° E(n2 ) e hc Ef óton = h∫ = (22.7) ∏ de modo que para satisfazer a quantização dos estados, um átomo de hidrogênio só pode emitir fótons com energia: µ ∂ 1 1 h∫ = E(n1 ) ° E(n2 ) = 13, 6 eV ° (22.8) n21 n22 ou, em termos de comprimento de onda: 1 13, 6 eV = ∏ hc µ 1 1 ° n21 n22 ∂ 1 = 912 Å µ 1 1 ° n21 n22 ∂ (22.9) Portanto, um átomo de hidrogênio só pode emitir fótons com certas energias para que seus elétrons passem de um nível n1 para um nível n2, assim como só podem absorver fótons dessas energias para o processo inverso. O sistema é considerado ligado enquanto a energia do nível for En < 0. À medida que n→ ∞ temos que E → E∞= 0. Quando E > 0, o elétron não fica ligado ao núcleo, ele é livre. Além das linhas discretas, um átomo de H também é capaz de espalhar radiação e fazer a transição de um nível n para o contínuo (n = ∞), e vice-versa (ionização e recombinação), se o fóton tiver comprimento de onda menor que 912 Å. • Se um elétron tem uma transição para um nível com energia menor emite um fóton que contribui para a formação de uma linha de emissão. • Se um fóton é absorvido haverá transição do elétron para um nível com energia maior, o qual contribui para a formação de uma linha de absorção. • Um átomo também pode passar a um estado a outro absorvendo ou perdendo energia em colisões com outras partículas. Para átomos com mais de um elétron, é preciso, ainda, levar em conta o princípio da exclusão de Pauli, pois os elétrons são férmions, partículas com spin semiinteiro, e não podem ocupar o mesmo estado quântico, com o mesmo spin. Existem regras de seleção que prevêem as transições mais esperadas entre dois níveis de energia. As transições permitidas representam as transições que conservam o momento angular total do sistema. Outras transições são matematicamente possíveis, mas são consideradas proibidas porque, nas condições terrestres, antes que um átomo possa irradiar por uma transição proibida, uma colisão com outro átomo ou molécula irá ocorrer e desexcitar o átomo colisionalmente. Como no meio interestelar os átomos estão muito mais distantes entre si do que na Terra, as colisões são muito raras e, portanto, as transições proibidas são importantes em nuvens de gás e no meio interestelar. En = 13.6 a1 - b eV. transitions are labeled with Greek letters. An Hα photon (level 3 to level 2) has a wavelength of 656.3 nm, in the red part of the visible Séries de linhas do átomo de Hidrogênio ate (n 5 1) has energy E1 5 0 eV, the first excited spectrum; Hβ (level 4 to level 2) has a wavelength of 486.1 nm ergy E2 5 13.6 3 (1 2 1/4) eV 5 10.2 eV, the (green); Hγ (level 5 to level 2) has a wavelength of 434.1 nm átomo de3H, espectrais são dos(especially diferentes hasNo energy E3 5 13.6 (1 2as 1/9)linhas eV 5 12.1 eV, (blue); anddenominadas so on. We will use em thesefunção designations Hα re infinitely excited and Hβ) frequently in later chapters. The most energetic Balmer níveis many a partir dostates qualbetween se dáthea transição. Isto introduz as seguintes séries de e energy at which the atom is ionized, crowdseries photons have energies that place them just beyond the blue linhas: er together as n increases and En approaches end of the visible spectrum, in the near ultraviolet. Bohr’s formula for the energy of each electron • transições n = 1: série de erse his reasoning até and calculate the energy ransition between any two given states. Lyman, denominadas Lyα,To rom the first excited state to the second, an Lyβ Lyγ,…(linhas do UV). ied with E3 2 E2 5 12.1 eV 2 10.2 eV 5 1.9 eV 10−19 J. Now, from the formula E = hf prewe•find that this energy to a photransições atécorresponds n = 2: série de 14 cy of 4.6 3 10 Hz, having a wavelength of Balmer, denominadas Hα, in the red portion of the spectrum. (A more visível). givesHβ,…(espectro the value 656.3 nm reported in the text.) nying diagram summarizes the structure • transições até n = 3: série de atom. The increasing energy levels are denominadas s ofPaschen, circles of increasing radius. ThePα, elecbetween these levels (indicated by arrows) Pβ,…(infravermelho). grouped into families, named after their define the terminology used to identify nes. (Note that the spacings of the energy n=∞ n=4 Lyman series n=3 102.6 nm 97.3 nm n=2 g 121.6 nm b a n=1 13.6 eV 12.8 12.1 10.2 0 eV eV eV eV Gr ound stat e Fir st ex tat cited s Se co te nd excited sta Third excited stat Ionization 91.2 nm Balmer 656.3 nm series a 486.1 nm b e n2 e 364.8 nm 4 How does the structure of an atom determine the es nearly 800 of the Fraunhofer atom’s emission and absorption spectra? olar spectrum (Figure 4.4). ent such as iron can yield many irst, the 26 electrons of a normal rmous number of differthe clean orbitals shown here and in other atomic diagrams are really more like fuzzy ble energy levels. Átomos : Second, Remember, “clouds” of electron energy levels, as shown in Figure 4.9. d, with some of their 26 removal of electrons alters – – tructure, and the energy te different from those of – Espectros mais complexos Electron ++ Carbon (a) A helium atom ons within its lowest-energy ing two protons and two s ground state has six roton, six-neutron nucleus— orbital and the other four at a . 0.05 nm – Nucleus ++ + + – – – (a) – (b) Hélio Carbono identify a all others 8 light-years Intensity t t t Molecula spectral l example, simplest m different in part (b Frequency Helium, Hydrogen Oxygen Helium Neon Helium Hydrogen R I V electr ultrav DIBOH lines. DIBOH in th small U X G ▲ I V U X – G FIGURE 4.12 Emission Nebula The visible spectrum of hot – gases in the Omega Nebula (M17). (The word nebula means “gas cloud”—one of many places in our Galaxy where new stars are forming today.) Shining by the light of several very hot stars, the gas in the nebula produces a complex spectrum of bright and dark lines (bottom). That same spectrum can also be displayed, as shown here, as a white graph of intensity versus frequency, spanning the spectrum from red to blue. (Adapted from ESO) • transições de elétrons dentro de moléculas produzem linhas espectrais no visível e no ultravioleta (as maiores mudanças de 4.4 Molecules energia). A molecule is a tightly bound group of atoms held together by interactions among their orbiting electrons—interactions that welinhas call chemical bonds.espectrais Much like atoms, molecules can • vibrações produzem exist only in certain well-defined energy states, and again like atoms, molecules produce characteristic emission or infravermelhas. absorption spectral lines when they make a transition from one state to another. Because are more na molecules região decomplex • rotação produz linhas espectrais than individual atoms, the rules of molecular physics are also more complex. Nevertheless, as with atomic spectral rádio do espectro electromagnético (as lines, painstaking experimental work over many decades has determined the precise frequencies (or wavelengths) at which menores mudanças de millions energia). of molecules emit and absorb radiation. In addition to the lines resulting from electron transitions, molecular lines result from two other kinds of change not possible in atoms: Molecules can rotate, and they can vibrate. Figure 4.13 illustrates these basic molecular motions. Molecules rotate and vibrate in specific ways. Just as with atomic states, only certain spins and vibrations are allowed (a) by the rules of molecular physics. When a molecule changes its rotational or vibrational state, a photon is emitted or Spectral lines characteristic of the specific kind of The spectrum above is for molecular hydrogen, H 2 absorbed. c molecule result. Like their atomic counterparts, these lines are unique molecular fingerprints, enabling researchers to 92 CHAPTER 4 Spectroscopy ANIMATION/V Moléculas: um, rogen gen um n um rogen R Photon – – – – – + – – – + – – – – Carbon atom Oxygen atom (a) C C Slower vibration Faster vibration O Photon O (b) Photon C C Faster rotation O O Slower rotation (c) ▲ FIGURE 4.13 Molecular Emission Molecules can change in three ways while emitting or absorbing electromagnetic radiation. The colors and wavelengths of the emitted photons represent the relative energies involved. Sketched here is the molecule carbon monoxide (CO) undergoing (a) a change in which an electron in the outermost orbital of the oxygen atom drops to a lower energy state (emitting a photon of shortest wavelength, in the visible or ultraviolet range), (b) a change in vibrational state (of intermediate wavelength, in the infrared), and (c) a change inmuch rotational state (of in thehydrogen, radio range). cthe simpler onelongest belowwavelength, is for atomic H. (b) 650 600 550 500 Wavelength (nm) 450 400 350 Intensidade das linhas espectrais Intensidade (ou força) de uma linha: proporcional ao número de fótons emitidos (ou absorvidos) naquela transição. linha de emissão linhas de absorção que se superpõem ao continuo and subsequent figures to refer to emission lines, but realize that the ideas apply equally well to absorption features. Perfil da Linha Several processes can broaden spectral lines. The most important involve the Doppler effect. Imagine a hot cloud of gas atoms representa in random thermal motion da densidade de fluxo Ocontaining perfil deindividual uma linha a variação in every possible direction, as illustrated in Figure 4.17(a). com o comprimento de onda. Uma linha não é totalmente estreita. If an atom happens to be moving away from us as it emits (intensidade) A forma de uma linha espectral é chamada de perfil da linha. (a) Intensity Line center Width A forma verdadeira da linha reflete as propriedades da atmosfera da estrela: temperatura T, pressão P, gravidade superficial g, densidade ρ e velocidade das partículas v. Frequency (b) ▲ FIGURE 4.16 Line Profile By tracing the changing brightness Vários processos físicos podem alargar uma linha. Um perfil alargado pode fornecer características sobre fonte emissora da radiação. Vejamos a seguir. across a typical emission line (a) and expanding the scale, we obtain a graph of the line’s intensity versus its frequency (b). ount of the shift (0.1 percent here) tells us the ows the blueshift of the same set of lines from rcent), because the speed has doubled, and in Alargamento das linhas espectrais either side. Earlier, we stressed that photons are emitted and Alargamento Natural: Pelo princípio da incerteza de Heisenberg, a energia de um absorbed at very precise energies, or frequencies. Why, then, determinado nível narrow, atômico (estado) aren’t spectral lines extremely occurring only at spe-não pode ser determinada com precisão maior cific wavelengths? This line broadening is not the result of que ΔE = π/2 (h / Δt). some inadequacy of our experimental apparatus; rather, it is caused by the environment in which the emission or absorption occurs—the physical state of the gas or star in which the line is formed. For definiteness, we have drawn Figure 4.16 and subsequent figures to refer to emission lines, but realize that the ideas apply equally well to absorption features. Several processes can broaden spectral lines. The most important involve the Doppler effect. Imagine a hot cloud of gas containing individual atoms in random thermal motion in every possible direction, as illustrated in Figure 4.17(a). If an atom happens to be moving away from us as it emits • Energia do elétron (numa orbita) tem incerteza de: E ± ΔE • Δt tempo de vida daquele nível. Um grupo de átomos irá produzir uma linha de absorção ou emissão com uma variação mínima na freqüência ν dos fótons ν ±Δν, onde: ΔE 1 Δν = ∝ h Δt (a) Line center Intensity alargamento natural da linha Width Frequency (b) Alargamento colisional: Os níveis de energia de um átomo são também perturbados (ou seja, deslocados) por partículas vizinhas, principalmente as carregadas como íons e elétrons: por colisões. Em um gás, essas perturbações são aleatórias e causam alargamento das linhas espectrais. Quanto maior a densidade de partículas (e, portanto, a pressão) do gás, maior a largura das linhas espectrais. Esse é o processo mais importante no alargamento de linhas muito intensas como Hα, Hβ, ... (série de Balmer). 94 CHAPTER 4 Spectroscopy Alargamento Doppler térmico Blueshift No shift Redshift Blueshift Redshift Blueshift Redshift Observer Blueshift Along any line of sight, we see many emitting atoms—some coming, some going—that cause spectral lines to broaden. Intensity (a) Large redshift Large blueshift Line center (“natural” frequency) (b) Frequency their thermal motion would be to smear the lin O ofmovimento aleatório dasthe a range wavelengths. The hotter the gas, spread of Doppler do motions greater da the wi partículas gás and (porthecausa (More Precisely 3-1) By measuring a lin line. agitação térmica) faz com que astronomers can estimate the average speed of th l g uthemtemperature a s p a roft íthe c ugasl aproducing s s e it and a hence aproximem outras se afastem Other processes,e such as rotation and turbu produce similar effects. Consider an astronomi do observador. (a star or a gas cloud) that is spinning about as sketched in Figure 4.18 or that has some ot Por efeito as linhas nal motion, such asDoppler, turbulent eddies or vortices dasPhotons partículas afastam scales. emittedque from se regions that hap moving toward us are blueshifted by the Dopp se deslocam para o vermelho e photons emitted from regions moving away fro as linhas das partículas que se redshifted. Often the object under study is so sm se deslocam para o o awayaproximam that our equipment cannot distinguish, azul.parts from one another—all the emitt different blended together in our detector. In that case, is a net broadening of the observed spectral l Isto provoca um alargamento more rapid the internal motion, the more broad see. das Notelinhas. that this broadening has nothing to do temperature of the gas producing the lines and is superimposed on the thermal broadening just di Still other broadening mechanisms do not d the Doppler effect at all. For example, if electrons photons changes slightly, blurring the spectral lines. This mechanism, which occurs most often in dense gases where Alargamento Doppler rotacional al broadening. y the at the tomic onger hift is neous arly, if nstant short, e gas, erved those cloud have cases Only esult, more oduc- This side blueshifted Observer sees: Star’s rotation This side redshifted Intensity Observed line The more rapid a star’s rotation, the broader its observed lines. “Natural line” Frequency Receding Approaching side side Line center Alargamento Zeeman: Quando um átomo se desloca sob a ação de um campo magnético, cada nível atômico de energia se divide em três ou mais subníveis: efeito Zeeman. Se as separações (componentes Zeeman) entre subníveis não são resolvidas (são tão pequenas que não se pode distingui-las) nos espectros observados, vemos somente uma linha espectral alargada. Quando campo magnético B é forte (e.g. nas manchas solares), a separação entre as linhas è mensurável. É possível deduzir a intensidade de B pela separação das linhas. Intensidade das linhas espectrais A intensidade das linhas é proporcional ao número de átomos que estão no estado de energia a partir do qual ocorrem as transições As transições para um dado nível (espontâneas ou colisionais) dependem de T (pois energia cinética relaciona-se a T) Como determinar o n. de átomos que estão em dado nível de excitação? A equação de Boltzmann Os átomos de um gás ganham e perdem energia quando eles colidem. Como resultado, a distribuição das velocidades dos átomos que colidem produz uma distribuição definida dos elétrons entre nos orbitais atómicos. Esta distribuição de elétrons é regida por um resultado fundamental da mecânica estatística: Orbitais de maior energia tem menos probabilidade de serem ocupados pelos elétrons. Seja sa um conjunto de números quânticos que identifica um estado de energia Ea em um sistema de partículas. Da mesma forma, seja sb o conjunto de números quânticos que identifica um estado de energia Eb. Logo, a razão entre a probabilidade P(sb) de que o sistema se encontre no estado sb e a probabilidade P(sa) de que o sistema se encontre no estado de sa é dada por: A grandeza exp(-E/kT) é conhecida como fator de Boltzmann. Se os níveis de energia Ea e Eb. possuem degenerescências ga e gb respectivamente, então devemos reescrever a relação anterior na forma: Os sistemas astrofísicos (e.g. uma atmosfera estelar) contém um grande número de átomos, de modo que a razão entre das probabilidades é indistinguível da razão entre o número de átomos. Assim, para os átomos de um dado elemento num estado de ionização específico, a razão entre o número Nb de átomos com energia Eb e o número Na de átomos com energia Ea em um estado de excitação diferente, é dado pela equação de Boltzmann: Exemplo: equação de Boltzmann Para um gás de átomos de hidrogênio neutro, em que temperatura será igual número de átomos com elétrons no estado fundamental (n=1) e no primeiro estado excitado (n=2)? Lembrar de Física Quântica que a degenerescência do nível de energia de ordem n no átomo de hidrogénio é gn = 2n2. Portanto: N2 g2 (E2 E1 )/kT = e N1 g 1 2(2)2 [( 13.6eV /22 ) ( 13.6eV /12 )]/kT 1= e 2 2(1) 10.2eV = ln(4) kT 10.2eV T = = 8.54 ⇥ 104 K k ln(4) Altas temperaturas (~ 85000 K) são necessárias para que um número significativo de átomos de hidrogênio possuam elétrons no primeiro estado excitado. A fração de átomos de hidrogênio com elétrons no primeiro estado excitado em relação ao total, pode ser obtida por: N2 N2 /N1 = N1 + N2 1 + N2 /N1 onde o N2/N1 é dado por: N2 2(2)2 = e 2 N1 2(1) [( 13.6eV /22 ) ( 13.6eV /12 )]/kT Dessa forma obtemos a seguinte figura: j i = e(Ej Ei )/kT Njátomos /Ni no primeiro estado excitado é igual a 1% A que temperatura o número de Ej Ei do número de átomos no estado fundamental? T = k ln[(gj /gi )/(Nj /Ni )] N2/N1 = 0.01 ⇒ T ≈ 20000 K Subbing in the statistical weights and energy levels for n=1 (ground state) an A que temperatura o número de átomos no primeiro estado excitado é igual a excited state), (N2 /N1 ) = 0.01, and Boltzmann’s constant (k=8.617⇥10 5 eV K 10% do número de átomos no estado fundamental? = 1.97⇥104 K (⇠20,000K). N2/N1 = 0.1 ⇒ T ≈ 32000 K B) Following the same procedure with (N2 /N1 ) = 0.1 yields T= 3.21⇥104 K (⇠3 Quando T se aproxima do infinito, qual é a 2distribuição de elétrons em cada C) For N = N2 , Nj /Ni = 1, and gn = 2(n) and T=85,386 K (hot!). The ener orbital de1 acordo com a equação de Boltzmann? Essa distribuição pode to excite an electron from n=1 to n=2 is E2 - E1 = -3.4eV + 13.6eV = 10.2 eV. realmente ocorrer? Justificar. D) Consider the limit as T! 1; in this case, the exponential term approache Quando T → ∞, o termo exponencial na equação de Boltzmann fica e0 = 1, the population ratio approaches the ratio of the statistical weights, independent portanto temos: n2j Nj gj ! = 2 for Hydrogen Ni gi ni this distribuição will not be the that actually occurs as T!ficará 1 beca No However, entanto, esta nãodistribution pode realmente ocorrer porque o gás high temperatures all ofde the ionizado com o aumento T. hydrogen atoms will have ionized. A equação de Saha Imagine um átomo de imerso em um campo de radiação. A absorção de um fóton com energia maior que a energia de ionização deixa um íon e ejeta um elétron livre no gás. No processo inverso, de recombinação, um elétron é capturado por um íon, e o átomo retorna a um estado neutro ou com ionização inferior. Se o gás se encontra em equilíbrio termodinâmico, a fotoionização equilibra exactamente a recombinação. A reação química pode ser escrita na forma: Ai + ! Ai+1 + e Quando o equilíbrio químico é alcançado devemos ter: µi = µi+1 + µe onde 𝜇i e 𝜇i+1 e 𝜇e são os potenciais químicos dos ions Ai, Ai+1, e dos elétrons. A partir da condição de equilíbrio químico é possível obter (Saha 1921): equação de Saha onde: • 𝜒i é a energia de ionização necessária para remover um elétron de um átomo ou íon no estado fundamental, alterando a sua ionização de i para i+1. Por exemplo, a energia de ionização de hidrogénio, a energia necessária para convertê-lo de HI (hidrogênio atómico neutro) para HII (hidrogênio atómico ionizado), é 𝜒i = 13,6 eV. • Zi é a função de partição do íon Ai definida por onde (Ej - E1) é a energia do nível j em relação ao estado fundamental E1; e gj é a degenerescência do nível j. Às vezes, a pressão dos elétrons livres, Pe, é usada no lugar da densidade de número de elétrons. Ambas estão relacionados pela lei dos gases ideais Pe = ne k T Portanto, a equação de Saha adota a forma alternativa: A pressão dos elétrons varia aproximadamente de 0.1Nm-2 na atmosfera de estrelas frias até 100 Nm-2 na atmosfera de estrelas quentes. Exemplo: a intensidade das linhas de Balmer Problema: Analise o estado de ionização na atmosfera de uma estrela no intervalo de temperaturas entre 5000 e 25000 K. Suponha que a atmosfera é composta totalmente por hidrogênio. Por simplicidade considere que a pressão adota o valor constante 20 N m-2. • Vamos usar a equação de Saha para calcular a fracção de átomos que estão ionizados. • Para isso, devemos determinar antes as funções de partição ZI e ZII. Um íon hidrogênio é apenas um próton e portanto não tem degenerescência; i.e. ZI = 1. • A energia do primeiro estado excitado do hidrogênio é 10,2 eV acima da energia do estado fundamental. Por outro lado, T entre 5000 e 25000 K significa que kT ~ (0,5−2 eV). [1 eV ≈ 11600 K]. • Como 10,2 eV ≫ kT para o regime de temperatura sob consideração, o fator de Boltzmann exp[−(E2−E1)] / kT ≪1. • Quase todos os átomos HI estão, portanto, no estado fundamental (lembre-se do exemplo anterior), e a função de partição simplifica para ZI ≈ gl =2(1)2 = 2. Substituindo na equação de Saha e usando 𝜒i = 13,6 eV obtemos: NII kT = NI Pe ✓ 2⇡me kT h2 ◆3/2 exp ✓ 13.6 eV kT ◆ Esta expressão é usada para obter a fração de hidrogênio ionizado NII/Ntotal: Usando as expressões acima, podemos fazer uma figura de NII/Ntotal em função da temperatura. • • • • Quando T = 5000 K, quase nenhum átomo de hidrogênio está ionizado. A ~ 8300 K, aproximadamente 5% dos átomos estão ionizados. Metade do hidrogénio está ionizado a uma temperatura de 9600 K. Quando T ≈ 11,300 K, 95% do hidrogénio está na forma de HII. Assim, a ionização do H realiza-se dentro de um intervalo de temperatura de cerca de 3000 K. Esta faixa de T é bastante limitada em comparação com as temperaturas de dezenas de milhões de graus normalmente encontradas dentro das estrelas. A faixa estreita dentro de uma estrela na qual o hidrogênio está parcialmente ionizado é chamada de zona de ionização parcial do hidrogênio e tem uma temperatura característica de ~10000 K para uma vasta gama de parâmetros estelares. Por esse motivo se observa que as linhas de Balmer (transições até o primeiro estado excitado, n=2) atingem a sua máxima intensidade a T= 9520 K, em vez de a T = 85000 K requerida para excitar os elétrons até o nível de energia do hidrogênio com n=2. A intensidade das linhas de Balmer depende de N2 / Ntotal, i.e. a fração de átomos de hidrogênio no primeiro estado excitado em relação a todos os átomos (i.e. no denominador devem ser incluídos tanto os átomos ionizados quanto os não ionizados). Essa grandeza é encontrada combinando os resultados das equações de Boltzmann e de Saha. Como praticamente todos os átomos de hidrogênio neutro estão no estado fundamental ou no primeiro estado excitado, podemos usar a aproximação N 1 + N 2 = N I. Portanto: onde N2/N1 é dado pela equação de Boltzmann e NII/NI pela equação de Saha. • N2 / Ntotal para o hidrogênio considerando Pe = 20 N m-2. O gás produz as linhas de Balmer mais intensas à temperatura de 9900 K, em boa concordância com as observações. • A diminuição da intensidade das linhas de Balmer a temperaturas maiores é devida à rápida ionização do hidrogênio acima de 10,000 K. Para estrelas com temperaturas baixas (e.g. no Sol) o H da atmosfera está no estado fundamental (n=1) e poucas colisões são energéticas o suficiente para excitar o H até n=2. Para estrelas com temperaturas muito altas, o H está quase todo ionizado devido às frequentes colisões e poucos átomos podem ser excitados até n=2. As linhas de Balmer são fracas em estrelas muito quentes ou muito frias apesar do hidrogênio ser o elemento mais abundante nas estrelas ! emissão (fundamental) absorção (fundamental)