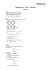1. Quantos mols de C9H8O4 estão contidos em um medicamento
Transcrição
1. Quantos mols de C9H8O4 estão contidos em um medicamento
1º Química B Lailson Aval. Subs. / Opt. EM 08/11/11 1. Quantos mols de C9H8O4 estão contidos em um medicamento que contém 0,09g da referida substância. Dados: H=1u; C=12u; O=16u 2. Determine o número de átomos de carbono (C) contidos em 2 mols deste elemento. Dado: Constante de Avogadro = 6,0×1023 3. Um éter, de massa molar 60g/mol, tem a seguinte composição centesimal: C = 60 %; H = 13,33 %; O = 26,67 %. (Massa molares, em g/mol: C=12; H=1; O=16) Determine a fórmula molecular do éter. 4. Considere que a cotação do ouro seja R$ 100,00 por grama. Que quantidade de átomos de ouro, em mols, pode ser adquirida com R$9.000,00? (Dado: Massa molar do Au = 197g/mol.) 5. O ácido oxálico (H2C2O4) é utilizado para tirar manchas de ferrugem em tecidos. A massa molecular do ácido oxálico é: Dados: H = 1u; C = 12u; O = 16u a) 30u. c) 90u. b) 60u. d) 120u. e) 150u. 6. Quantas vezes a massa da molécula de glicose, C6H12O6, é maior que a da molécula de água, H2O? a) 2. c) 6. b) 4. d) 8. e) 10. 7. No colesterol, cuja fórmula molecular é C27H46O, a porcentagem de hidrogênio é aproximadamente igual a: Dados: Massa molar (g/mol): C = 12 ; H = 1 ; O = 16 a) 46%. c) 12%. b) 34%. d) 1%. e) 62%. 8. A fórmula mínima de um composto orgânico é (CH2O)n. Sabendo-se que o peso molecular desse composto é 180, qual o valor de n? 9. A porcentagem em massa de carbono no clorofórmio, CHCl3, é (massas molares, em g/mol: H = 1; C = 12, Cl = 35,5): a) 1%. c) 12%. b) 10%. d) 24%. e) 50%. 10. A fórmula molecular da água é H2O. Determine sua fórmula percentual.
Documentos relacionados
Exercicios- TIPOS DE FORMULAS
 15) (FESP) 1,0g de uma amostra de ferro de massa total 8,0g, foi convenientemente analisada,
encontrando-se 7,525 x 1021 átomos de ferro. A pureza em ferro desta amostra é:
A) 70%
B) 30%
C) 90%
D) ...
15) (FESP) 1,0g de uma amostra de ferro de massa total 8,0g, foi convenientemente analisada,
encontrando-se 7,525 x 1021 átomos de ferro. A pureza em ferro desta amostra é:
A) 70%
B) 30%
C) 90%
D) ...