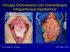
Pseudomixoma Peritoneal
Transcrição
Pseudomixoma Peritoneal
Este encarte é parte integrante da edição de nº 290 do Jornal da Imagem Reunião Clube Roentgen - setembro de 2002 Escola Responsável: Hospital Sírio Libanês Coordenador: Thiago D. R. Silva São Paulo, novembro de 2002 Caderno Dois CASO 1 - Dra. Carolina Ribeiro Soares Pseudomixoma Peritoneal História Clínica AS, 69 anos com dor abdominal intensa, progressiva, com piora noturna. Refere um episódio de vômito na noite anterior e alteração do hábito intestinal (está constipado). Antecedentes: DM insulino-dependente; DPOC; Dislipidemia; Arteriopatia em MMII; TVP ilíaco-femural pregressa; Deficiência de antitrombina III; Anticoagulação com cumarínico. Exame Físico: REG, corado, hidratado, taquipnéico. PA=180X80 P=126; MV+ diminuído bilateralmente BRNF 2T S/AS; Abdome globoso, doloroso à palpação em HD e FD; DB-, RH+ mas diminuídos; MMIIs sem sinais de TVP. Figuras 1, 2, 3, 4 e 5: Cortes axiais com contraste evidenciando tecido com densidade de líquido espesso acumulado no flanco esquerdo, peri-hepático e na fossa ilíaca direita. Nota-se acúmulo do mesmo tecido no espaço hepatofrênico exercendo discreta impressão e lobulação sobre o parênquima hepático. Opacidade nodular espiculada mesenterial no mesogástrio/flanco direito, medindo cerca de 2,5 cm nos seus maiores eixos axiais. Figuras 6, 7 e 8: Reconstituiçoes nos planos coronais mostrando o tecido com densidade de líquido espesso com efeito expansivo na cavidade peritoneal associado a opacidade mesenterial espiculada em hipogástrio/flanco direito. Exames: Hb=13; Ht=42,3; Leuco=7.980; Plaq=590.000; TGO=21; TGP=13; U=81; NA=135; TTPA=46,4; Atividade de protrombina=27,2%; (nl até 45); (nl acima de 70%) Diagnóstico Pseudomixoma Peritoneal Discussão O pseudomixoma peritoneal é uma doença rara que se caracteriza pelo implante de material mucinoso no peritôneo ou na superfície do omento, produzido por células neoplásicas mucosecretoras de baixo grau que se distribuem de maneira esparsa na cavidade peritoneal. As neoplasias produtoras de material mucinoso são tipicamente os cistadenocarcinomas de ovário e do apêndice. A doença é assintomática na maioria dos casos, sendo freqüentemente descoberta como achado acidental em laparotomias por apendicites ou tumores ovarianos. É encontrado em 2/10.000 laparotomias , sendo 2 a 3 vezes mais freqüente em mulheres. É uma doença incidiosa, podendo ocorrer depósito de material mucinoso antes mesmo da descoberta da neoplasia primária. Quando há sintomas, estes incluem dor abdominal, distensão, massas palpáveis, náuseas, vômitos e fadiga. As radiografias podem mostrar deslocamento central das alças intestinais, apagamento da linha do psoas e eventualmente calcificações. À tomografia o material mucinoso terá densidade similar ao da gordura do fígado e baço, podendo assumir dois aspectos: · Massas de baixa densidade, císticas, localizadas em vários espaços anatômicos; · O peritôneo pode estar completamente preenchido por fluido correspondente à ascite mucinosa, produzindo efeito de massa sobre os órgãos adjacentes; · Calcificações podem estar presentes após quimioterapia; O tratamento inclui cirurgia radical com apendicectomia e ooforectomia em mulheres, associado à quimioterapia adjuvante intraperitoneal e sistêmica. A recidiva é comum, ocorrendo em cerca de 76% dos casos e requer nova cirurgia, com ou sem quimioterapia adjuvante associada. As recorrências são mais comuns de ocorrer na superfície intestinal, com aderências, provocando obstrução. Quando há carcinomatose peritoneal mucinosa, as células peritoneais tem arquitetura e características estruturais de um carcinoma, sendo derivadas do adenocarcinoma mucinoso gastrointestinal e são associadas com um prognóstico significantemente pior. A taxa de sobrevida em cinco anos é de 53% e em dez anos de 32%. Referências Bibliográficas 1. Baradi H, Ponsky J.From the Departament of General Surgery,The Cleveland Clinic Foundation. Pseudomyxoma peritonei. Surgery 2000;131:230-31. 2. Mann WJ Jr, Wagner J, Chumas J, Charles E. The management of pseudomyxoma peritonei.Cancer 1990;66:1636-40. 3. Nawaz A, Karakurum A, Weltman D, Shehata A, Mohamed I, Hadjiyane C, Pellecchia C. Pseudomyxoma Peritonei Manifesting as Intestinal Obstrution.Southern Medical Journal .September 2000;93:891-93. 4. Sugarbaker PH, Kern K, Lack E.Malignant pseudomyxoma peritonei of colonic origin.Natural history and a presentation of a curative approach to treatment.Dis Colon Rectum 1987;30:772-9. 5. Sugarbaker PH. Peritonectomy procedures.Ann Surg 1995;221:29-42. 2 Caderno Dois São Paulo, novembro de 2002 Mesotelioma Cístico Peritoneal CASO 2 Cresio Flores Rolim História Clínica Figuras 1 e 2 Cortes axiais de TC sem contraste endovenoso. Formação cística multiloculada envolvendo a raiz do mesentério, deslocando a veia cava inferior para a direita. Paciente do sexo feminino, 35 anos, apresentando dor em hipocôndrio direito há 4 anos, com piora nos últimos seis meses, acompanhada de aumento de peso e do volume abdominal. Diagnóstico Mesotelioma Cístico Peritoneal Discussão Os mesoteliomas são neoplasias mesenquimais com origem na serosa da pleura, pericárdio ou peritôneo. Existem pouco mais de 100 casos descritos na literatura de mesoteliomas peritoneais multicísticos. São tumores benignos, mais prevalentes em mulheres (cerca de 80% dos casos descritos) jovens ou de meia idade. As vísceras pélvicas são as mais comumente afetadas. Em cerca de 50% dos casos os pacientes têm história de laparatomia pregressa o que pode representar uma origem reativa, porém a causa permanece desconhecida. Os sintomas clínicos usualmente encontrados são dor abdominal com distensão e massa palpável. Os exames de imagem para diagnóstico são o ultra-som, a tomografia computadorizada e a ressonância magnética. O achado típico ao ultra-som é de uma massa cística anecóica multiloculada. A tomografia computadorizada pode mostrar a presença de uma massa multiloculada de baixa densidade e é um bom método para demonstrar a extensão da neoplasia. Na ressonância magnética a massa apresenta hipointensidade em T1 e intensidade intermediária ou alta em T2. Através destes métodos de diagnóstico, raramente, também podem ser observados líquido livre no abdome e hemorragia. Calcificação nas paredes dos cistos foi relatado em apenas um paciente. A Figura 3 TC com contraste evidenciando discreto realce das finas septações. Fig. 4 - RM - corte axial ponderado em T1 revelando lesão hipointensa. Figs. 5 e 6 - RM - cortes axiais ponderados em T2 revelando alto sinal das lesões. Fig. 7, 8 e 9. Imagens sagitais (7 e 8) e coronal (9) ponderadas em T2 demonstrando o aspecto multilocular da lesão e sua extensão até a cavidade pélvica. invasão de órgãos nunca foi descrita nestas neoplasias, porém é comum dependendo do tamanho, a distorção de órgãos adjacentes. O diagnóstico diferencial inclui o linfangioma, cistoadenoma ou cistoadenocarcinoma ovariano, endometriose, pseudomixoma peritonei, leiomioma e leiomiossarcoma. O tratamento para as lesões é a exérese cirúrgica total. A recorrência é comum, mesmo após cirurgias agressivas. Referências Bibliográficas 1. O’Neil JD, Ros PR, Storm BL, Buck JL, Wilkinson EJ. Cystic mesothelioma of the peritoneum. Radiology 1989;170:333 –337. 2. Hasan AKH, Sinclair DJ. Case report: calcification in benign cystic peritoneal mesothelioma. Clin Radiol 1993;48:66 –67. 3. A. Özgen, D. Akata, O. Akhan, M. Tez, G. Gedikoglu, M. N. Özmen. Giant benign cystic peritoneal mesothelioma: US, CT,and MRI findings. Abdom Imaging 1998; 23:502-504. 4. Liem T. Bui-Mansfield, Gina Kim-Ahn and Larry K. O’Bryant. Multicystic Mesothelioma of the Peritoneum. AJR 2002; 178:402. Caderno Dois São Paulo, novembro de 2002 3 Tumor Carcinóide do Intestino Delgado CASO 3 Dra. Carolina Ribeiro Soares História Clínica Paciente do sexo masculino, 43 anos, com dor em hipocôndrio direito contínua há uma semana, associada a discreta distensão abdominal, náuseas e vômitos. Refere quadros semelhantes prévios, porém localizados no flanco direito e menos intensos que o atual. Diagnóstico Tumor Carcinóide do Intestino Delgado Discussão Os tumores carcinóides são neoplasias originadas de células neuroendócrinas, fazendo parte do sistema APUD (amine precursor uptake and decarboxylation). Portanto, são capazes de produzir substâncias metabolicamente ativas, destacando-se a serotonina, dopamina, histamina, ACTH, entre outras. São tumores de crescimento lento, cujo comportamento biológico (invasão local ou metástases) confere seu caráter maligno. A maioria dos tumores carcinóides localiza-se no trato gastrointestinal (70 a 90% dos casos), preferencialmente no íleo, reto e apêndice. Também podem ser encontrados nos pulmões, brônquios, estômago e cólon. O tumor carcinóide é a neoplasia primária mais comum do intestino delgado, sendo responsável por cerca de um terço de todos os casos de carcinóides do trato gastrointestinal. São freqüentemente multicêntricos e metastáticos para linfonodos ou fígado ao diagnóstico. Os pacientes são freqüentemente assintomáticos e sintomas vagos como dor abdominal podem ocorrer por até sete anos. Outros sintomas comuns incluem: náuseas, obstruções intestinais intermitentes, diarréia, hemorragia digestiva baixa e perda ponderal. A síndrome carcinóide é uma apresentação tardia e infreqüente que ocorre em apenas 5 a 7% dos casos, sendo caracterizada por episódios de rubor facial, associado a prurido, diarréia, palpitações e edema conjuntival. Pode ocorrer comprometimento valvular cardíaco (especialmente à direita), broncoconstrição, disfunção sexual, obstrução ureteral e alterações oculares. A síndrome carcinóide é causada pelos elevados níveis de serotonina que alcançam a circulação sistêmica. Nos carcinóides de delgado, a serotonina é liberada no sistema venoso portal e subseqüentemente inativada no fígado. Portanto, a síndrome carcinóide é pouco freqüente nos indivíduos com carcinóide de delgado, sendo vista quase exclusivamente naqueles pacientes com metástases hepáticas. O diagnóstico laboratorial pode ser estabelecido através da dosagem de serotonina na urina. Os métodos de imagem podem demonstrar aspectos característicos, praticamente encerrando o diagnóstico. No trânsito intestinal os carcinóides podem se apresentar como pequenas lesões submucosas ou mucosas, lisas, arredondadas e bem definidas, especialmente nos segmentos ileais distais, sendo múltiplas em cerca de 30% dos casos. Entretanto, a maioria cresce extra-luminarmente, infiltrando a parede da alça, linfáticos, linfonodos regionais e mesentério. A liberação local de serotonina causa espessamento e hipertrofia muscular, com estreitamento luminar difuso. Provoca também intensa resposta desmoplásica, resultando na aparência característica de separação, fixação e angulação das alças intestinais. Sinais de compressão extrínseca das alças intestinais podem ser causados pela presença de uma massa mesenterial. Na tomografia computadorizada (TC), a reação desmoplásica característica é vista classicamente como uma massa de tecidos moles no mesentério com irradiação estrelada, a qual representa feixes neurovasculares espessados provocando retração. A massa pode apresentar calcificações distróficas. Os aspectos típicos de fixação, angulação, separação e espessamento de alças delgadas, bem como o estreitamento luminal, também são observados à TC, e podem estar associados à volvo intestinal e obstrução de alça. A TC pode revelar metástases hepáticas Fig. 1 e 2 TC sem contraste revela massa solitária no mesentério com irradiação estrelada. Fig. 3 a 6 TC com contraste cortes axiais (3 e 4) e reconstruções coronais (5 e 6) evidenciando a reação desmoplásica clássica: massa mesenterial com irradiação estrelada e aspecto retrátil. hipervasculares. Quanto maior for a lesão no mesentério, maior a probabilidade do paciente apresentar metástases hepáticas (80% dos tumores maiores de 2cm terão metástases hepáticas). Os diagnósticos diferenciais incluem: mesenterite retrátil (usualmente sem massa central ou metástases hepáticas); linfoma (ausência de irradiação estrelada) e metástases (usualmente múltiplas lesões mesentéricas). Um estudo recente de Pantongrag-Brown estabeleceu que a tríade de massa mesentérica única calcificada (70%), radiação estrelada, e espessamento de parede de alça adjacente na TC deve ser considerada altamente sugestiva de tumor carcinóide. O tratamento de escolha para tumores carcinóides no intestino delgado consiste em enterectomia do segmento afetado, com ressecção do mesentério correspondente. Na presença de metástases unicamente hepáticas, a ressecção cirúrgica dos nódulos resultou em alívio sintomático e aumento da expectativa de vida em pacientes selecionados. Oclusão ou embolização da artéria hepática é uma alternativa, com duração de resposta mais curta, porém úteis naqueles sem indicação cirúrgica. Uma nova modalidade terapêutica, ainda em fase experimental, envolve o uso de octreotide, um análogo da somatostatina com efeito antiproliferativo. 4 Caderno Dois São Paulo, novembro de 2002 Mesotelioma Cístico Peritoneal CASO 4 Dr. Cresio Flores Rolim Nos casos em que há envolvimento secundário extra-hepático, a quimioterapia tem ação limitada, enquanto a radioterapia ainda não está bem estabelecida. A taxa de sobrevida em cinco anos para doença localizada ou regional é de cerca de 65%, e quando há envolvimento metastático à distância esta é reduzida para 36% . Referências Bibliográficas 1. Akerstrom G, Makridis C, Johansson H. Abdominal surgery in patients with midgut carcinoid tumors. Acta Oncol 1991;30:547-53. 2. Burke AP, Thomas RM, Elsayed AM, Sobin LH. Carcinoids of the jejunum and ileum : an immunohistochemical and clinicalpathologic study of 167 cases. Cancer 1997;79:1086-93. 3. Dahnert WF. Radiology Review Manual. 4th Edition. Lippincott, Williams & Wilkins. 1998. 4. Dousset B, Saint-Marc O, Pitre J, Soubrane O, Houssin D, Chapuis Y. Metastatic neuroendocrine tumors: medical treatment, surgical ressection or liver transplantation. World J Surg 1996;20:908-15. 5. Goldwin J. Carcinoid tumors: na analysis of 2837 cases. Cancer 1975;36:560-9. 6. Gore RM, Levine MS, Laufer I. Textbook of Gastrointestinal Radiology. WB Saunders 1994. 7. Kulke MH, Mayer RJ. Carcinoid Tumors. NEJM 1999;340:858-868. 8. Modlin IM, Sandor A. Na analysis of 8305 cases of carcinoid tumors. Cancer 1997;79:813-29. 9. Pantongrag-Brown L, Buetow PC, et al. Calcification and Fibrosis in Mesenteric Carcinoid Tumor: CT Findings and Pathologic Correlation. AJR 1995;164:387-391. 10. Pelage JP, Soyer P, Boudiaf M, BrocheriouSpelle I, Dufresne AC, Coumbaras J, Rymer R. Carcinoid tumors of the abdomen: CT features. Abdom Imaging. 1999;24(3):240-5. 11. Que FG, Nagorney DM, Batts KP, Linz LJ, Kvols JLK. Hepatic ressection for metastatic neuroendocrines carcinomas. Am J Surg 1995;169:36-43. 12. Weissleder et al. Primer of Diagnostic Imaging. 2nd Edition. Mosby. 1997. 13. Wisenberg RL. Gastrointestinal Radiology A Pattern Approach, Second Edition. Lippincott 1990. Leucoencefalopatia Anóxico-Isquêmica Dr. Nelson Fortes Ferreira A substância cinzenta é considerada mais vulnerável à injúria isquêmica difusa. Este envolvimento preferencial é explicado pelo princípio da vulnerabilidade seletiva, comprometendo por exemplo os hipocampos, substância cinzenta cortical e profunda, dentre outras, dependendo da duração da injúria anóxico-isquêmica. Recentemente tem-se detectado lesões secundárias a esta etiologia (anóxia) na substância branca, demonstrando a vulnerabilidade da mesma neste tipo de dano. Estas lesões de substância branca são mais comumente detectadas no período subagudo (14 a 20 dias após a injúria), embora alguns casos apresentem estas lesões mais precocemente(1 a 6 dias). A hipótese que tenta explicar a fisiopatologia destas lesões sugere que esta desmielinização pós anóxia ocorre como resultado da necrose da glia produtora de mielina. A necrose da bainha de mielina segue a necrose celular, por ser sua meia vida mais longa. A RM sugere uma mielinopatia aguda com edema citotóxico secundário a falha de energia celular. Pacientes com injúria anóxica que apresentam comprometimento da substância branca tem pior prognóstico que aqueles com lesões restritas à substância cinzenta. Caso Clínico – Paciente do sexo masculino com parada cardíaca no pós-operatório de revascularização miocárdica. A primeira RM (Foto 1) foi realizada no terceiro dia pós parada e evidencia restrição à difusão no córtex cerebral e núcleos da base, enquanto a substância branca tem aspecto normal. O exame de controle realizado dez dias após o primeiro (Foto 2) mostra que a restrição à difusão agora se faz na substância branca (leucoencefalopatia anóxico-isquêmica subaguda) e que a substância cinzenta encontra-se em fase pseudo normal . Conclusão É fundamental o conhecimento do comprometimento da substância branca nos casos de anóxia cerebral, por ser esta lesão pouco descrita até pouco tempo atrás e pelo pior prognóstico que a mesma acarreta. Não se pode esquecer que muitas vezes a RM só é realizada alguns dias após a injúria e que o envolvimento isolado da substância branca nesta fase não deve afastar a etiologia isquêmica da lesão. Leituras sugeridas: 1. Sanches, M; Lubetzki, C. MRI identification of early white matter injury in anoxic-ischemic encephalopathy. Neurology 2001; 57: 745. 2. Chalela, JA; Wolf, RL; Maldjian, JA; Kasner, SE. MRI identification of early white matter injury in anoxic-ischemic encephalopathy. Neurology 2001; 56: 481-485. 3. Pantoni L, Garcia JH, Gutierres JA. Cerebral white matter is highly vulnerable to ischemia. Stroke 1999; 27: 1641-1647. O artigo acima foi enviado à redação pelo Dr. Nelson Fortes Ferreira, neurorradiologista da MedImagem, SP
Documentos relacionados
Cisto Epidermóide
 Este encarte é parte integrante da edição de nº 304 do Jornal da Imagem
Reunião do Clube Roentgen - Outubro de 2003
Escola Responsável: Hospital Nove de Julho
Coordenadores: Dr. Fernando A. Moreira...
Este encarte é parte integrante da edição de nº 304 do Jornal da Imagem
Reunião do Clube Roentgen - Outubro de 2003
Escola Responsável: Hospital Nove de Julho
Coordenadores: Dr. Fernando A. Moreira...