microgastria
Transcrição
microgastria
CENTRO DE ESTUDO ESPECIALIZADO EM MEDICINA FETAL FETUS Pós-Graduação em Medicina Fetal sensu lato JANAÍNA ALENCAR DE MENEZES ANOMALIAS CONGÊNITAS DO FÍGADO E DAS VIAS BILIARES São Paulo 2011 CENTRO DE ESTUDO ESPECIALIZADO EM MEDICINA FETAL FETUS Pós-Graduação em Medicina Fetal sensu lato JANAÍNA ALENCAR DE MENEZES ANOMALIAS CONGÊNITAS DO FÍGADO E DAS VIAS BILIARES Monografia de conclusão do curso de Especialização e Pós-graduação “latu-sensu” em Medicina Fetal do Centro de Diagnóstico PréNatal e Medicina Fetal – FETUS. Orientadora: Profª. Laís Guimarães Vieira São Paulo 2011 AGRADECIMENTOS A Deus que me guia sempre e transforma meus sofrimentos em experiência e aprendizado. Aos meus pais e irmãos que sempre estiveram ao meu lado, nos momentos alegres e tristes e que suportaram minha ausência pacientemente. Ao meu marido Jean Fabrício que me apóia diante das dificuldades com amor e paciência. Ao meu filho Jean Carlos que apesar de ainda estar em formação desde já é muito amado. Ao Dr. Eduardo Isfer, preceptores, companheiros de curso e em especial a minha amiga Thaysa, e enfim, a todas as pessoas que direta ou indiretamente contribuíram para a realização deste estudo. Agradeço especialmente a minha Orientadora Profª. Laís Guimarães Vieira cuja colaboração foi imprescidível à confecção deste trabalho. RESUMO Há mais de 200 anos, as anomalias congênitas do fígado e da vesícula biliar têm sido investigadas em material de necropsia fetal. O desenvolvimento tecnológico dos exames de imagem ultrassonográfica e, posteriormente, a ultrassonografia de alta resolução combinada com Doppler colorido, a ressonância magnética e a tomografia computadorizada permitiram diagnóstico intra-útero, maior detalhamento das malformações, prognóstico para os pais e planejamento terapêutico mais adequado. Mais recentemente, as cirurgias minimamente invasivas somaram-se ao arsenal terapêutico, que pode ser individualizado a cada caso, reduzindo as taxas de mortalidade no período pós-natal. Os métodos de imagem ensejaram também melhor compreensão das modificações morfológicas no desenvolvimento anormal intra-útero, o que facilitou ainda mais o diagnóstico das anomalias congênitas. Apesar desses avanços, as anomalias congênitas hepáticas e biliares são de difícil diagnóstico, por serem raras, cujos estudos se restringem a series de casos e, mais raramente, a estudos retrospectivos, o que reforça a necessidade de realizar revisões para análise das evidências acumuladas. O objetivo deste estudo foi descrever o diagnóstico, o prognóstico e as condutas terapêuticas para as anomalias congênitas hepáticas e de vias biliares, associando-as ao desenvolvimento embriológico das estruturas envolvidas. Dentre as anomalias congênitas hepáticas, foram detalhadas as calcificações, tumores císticos e sólidos, assim como as vasculares, identificando-se que ainda se constituem em desafio para o diagnóstico ultrassonográfico, algumas ainda com mau prognóstico. O cisto de colédoco, a litíase e a atresia biliar foram incluídos nas anomalias biliares. A análise dos dados publicados entre 1959 e 2010 permitiu identificar que pouco se sabe ainda sobre a incidência dessas anomalias, mas é consensual a necessidade do conhecimento detalhado da embriologia de formação do fígado, de suas estruturas vasculares e da vesícula biliar, para propiciar o diagnóstico mais seguro por imagem. No futuro, a inclusão das Ciências da Computação permitindo a reconstrução tridimensional de estruturas embriológicas, a criação de bancos de dados sobre essas anomalias para análise das evidências, o aprimoramento dos exames de imagem e de equipamentos de cirurgia minimamente invasiva com tamanho adequado ao feto e ao neonato, poderão dar melhores condições para salvar maior número de vidas. Descritores: Anormalidades Congênitas; Fígado; Vias biliares; Desenvolvimento embrionário e fetal; Ultrassonografia pré-natal ABSTRACT For over 200 years, the congenital abnormalities of the liver and gallbladder have been investigated in fetal autopsy material. The technological development of ultrasound imaging and, later, the high-resolution ultrasound combined with color Doppler, the magnetic resonance imaging and the computed tomography allowed diagnosis intra-uterus, greater detail of malformations, prognosis for the parents and most appropriate therapeutic planning. More recently, minimally invasive surgeries were added to the therapeutic armamentarium, that can be individualized to each case, reducing mortality rates in the postnatal period. Imaging methods also gave rise to better understanding the morphological changes in the abnormal development intra-uterus, which has further facilitated the diagnosis of congenital anomalies. Despite these advances, liver and billiary congenital anomalies are difficult to diagnose because they are rare, whose studies are restricted to series of cases and, more rarely, retrospective studies, which reinforces the need for revisions to the analysis of accumulated evidence. The aim of this study was to describe diagnosis, prognosis and treatments for hepatic and billiary congenital abnormalities, as related to the embryological development of the structures involved. Among the congenital abnormalities, liver calcifications, cystic and solid tumors, as well as vascular abnormalities were detailed, identifying that they still constitute a challenge to the ultrasound diagnosis, some still having a bad prognosis. Choledochal cyst, gallstones and billiary atresia were included in the billiary abnormalities. The analysis of data, published from 1959 to 2010, identified that yet little is known about the incidence of these anomalies, but there is consensus on the need of a detailed knowledge of embryologic development of liver, its vascular structures, and gallbladder, to provide the safest diagnostic imaging. In the future, the inclusion of Computer Science allowing three-dimensional reconstruction of embryological structures, the creation of databases on these anomalies for analysis of evidence, the improvement of imaging equipment and minimally invasive surgery with adequate size to fetus and neonate, will provide better conditions to save a greater number of lives. Descriptors: Congenital Abnormalities; Liver; Gallblader; Embryonic and fetal development; Ultrasonography, Pré-natal SUMÁRIO RESUMO ................................................................................................................. 4 ABSTRACT.............................................................................................................. 5 1 INTRODUÇÃO ................................................................................................... 11 1.1 2 FUNDAMENTOS EMBRIOLÓGICOS – BASE DAS ANOMALIAS .................... 13 2.1 3 Objetivo ........................................................................................................ 12 Desenvolvimento embriológico do sistema arterial e venoso do fígado ....... 16 ANOMALIAS DO FÍGADO ................................................................................. 19 3.1 Calcificações hepáticas ................................................................................ 19 3.1.1 Definição ................................................................................................ 19 3.1.2 Incidência .............................................................................................. 19 3.1.3 Classificação.......................................................................................... 20 3.1.4 Etiopatogenia ......................................................................................... 21 3.1.5 Anomalias associadas ........................................................................... 23 3.1.6 Diagnóstico pré-natal ............................................................................. 23 3.1.7 Conduta pré-natal .................................................................................. 23 3.2 Tumores císticos .......................................................................................... 24 3.2.1 Definição ................................................................................................ 24 3.2.2 Incidência .............................................................................................. 24 3.2.3 Classificação.......................................................................................... 24 3.2.4 Etiopatogenia ......................................................................................... 25 3.2.5 Anomalias associadas ........................................................................... 26 3.2.6 Diagnóstico pré-natal ............................................................................. 26 3.2.7 Diagnóstico diferencial........................................................................... 27 3.2.8 Conduta pré-natal .................................................................................. 28 3.2.9 Conduta obstétrica................................................................................. 29 3.2.10 3.3 Assistência neonatal........................................................................... 29 Tumores sólidos ........................................................................................... 30 3.3.1 Definição ................................................................................................ 30 3.3.2 Incidência .............................................................................................. 30 3.3.3 Classificação.......................................................................................... 30 3.3.4 Etiopatogenia ......................................................................................... 32 3.3.5 Anomalias associadas ........................................................................... 33 3.3.6 Diagnóstico pré-natal ............................................................................. 34 3.3.7 Diagnóstico diferencial........................................................................... 35 3.3.8 Assistência neonatal .............................................................................. 35 3.4 3.4.1 Definição ................................................................................................ 36 3.4.2 Incidência .............................................................................................. 38 3.4.3 Classificação.......................................................................................... 38 3.5 4 Anomalias vasculares .................................................................................. 36 Etiopatogenia ............................................................................................... 40 3.5.1 Anomalias associadas ........................................................................... 41 3.5.2 Diagnóstico ............................................................................................ 42 3.5.3 Assistência neonatal .............................................................................. 43 ANOMALIAS DAS VIAS BILIARES.................................................................... 45 4.1 Cisto de Colédoco ........................................................................................ 45 4.1.1 Definição ................................................................................................ 45 4.1.2 Incidência .............................................................................................. 45 4.1.3 Classificação.......................................................................................... 46 4.1.4 Etiopatogenia ......................................................................................... 48 4.1.5 Anomalias associadas ........................................................................... 49 4.1.6 Diagnóstico pré-natal ............................................................................. 50 4.1.7 Diagnóstico neonatal ............................................................................. 50 4.1.8 Assistência neonatal .............................................................................. 51 4.2 Atresia biliar ................................................................................................. 52 4.2.1 Definição ................................................................................................ 52 4.2.2 Incidência .............................................................................................. 53 4.2.3 Classificação.......................................................................................... 54 4.2.4 Etiopatogenia ......................................................................................... 55 4.2.5 Anomalias associadas ........................................................................... 57 4.2.6 Diagnóstico pré-natal ............................................................................. 58 4.2.7 Diagnóstico neonatal ............................................................................. 59 4.2.8 Assistência neonatal .............................................................................. 61 4.3 Litíase biliar .................................................................................................. 62 4.3.1 Definição ................................................................................................ 62 4.3.2 Incidência .............................................................................................. 62 4.3.3 Etiopatogenia ......................................................................................... 63 4.3.4 Anomalias associadas ........................................................................... 64 4.3.5 Diagnóstico pré e pós-natal ................................................................... 65 4.3.6 Assistência neonatal .............................................................................. 65 5 CONSIDERAÇÕES FINAIS ............................................................................... 66 6 REFERÊNCIAS BIBLIOGRÁFICAS ................................................................... 67 LISTA DE FIGURAS Figura 1 – Desenhos da formação embriológica do fígado ....................................... 14 Figura 2 – Desenhos da formação embriológica das vias biliares............................. 15 Figura 3 – Desenhos da formação embriológica de fígado e vias biliares ................ 16 Figura 4 – Esquema ilustrativo do desenvolvimento embriológico do sistema venoso hepático ..................................................................................................................... 17 Figura 5 – Calcificação hepática parenquimatosa ..................................................... 19 Figura 6 – Imagem de tumor cístico hepático por ultrassonografia ........................... 26 Figura 7 - Imagem de tumor cístico hepático por ressonância magnética ................ 27 Figura 8 – Esquema ilustrativo da disposição anômala com drenagem para o fígado ou a veia porta esquerda por um canal comum calibroso ......................................... 38 Figura 9 – Esquema do desenvolvimento do sistema portal extra-hepático normal e anômalo .................................................................................................................... 41 Figura 10 – Algoritmo para diagnóstico de shunts vasculares hepáticos congênitos, a partir de ultrassonografia com Doppler ..................................................................... 43 Figura 11 – Tipos de cisto de colédoco segundo classificação de Todani ................ 47 Figura 12 – Anomalia da junção entre ducto biliar comum e ducto pancreático........ 48 Figura 13 – Desenhos de atresia biliar fetal .............................................................. 53 Figura 14 – Representação esquemática dos tipos de atresia biliar ......................... 55 Figura 15 – Possíveis relações causais da atresia biliar ........................................... 56 Figura 16 – Resultados de sobrevida de neonatos com atresia biliar baseados no registro de atresia biliar do Reino Unido (1999 – 2008) ............................................ 61 Figura 17 – Ultrassom demonstrando feto com vesícula biliar repleta de cáculos...62 LISTA DE QUADROS Quadro 1 – Classificação dos tumores hepáticos neonatais e fetais e das condições tumor-like................................................................................................................... 31 Quadro 2 – Classificação das anomalias vasculares hepáticas venosas, segundo Achiron e Fasouliotis e respectivas incidências ........................................................ 39 Quadro 3 – Classificação das anomalias vasculares do fígado ................................ 40 Quadro 4 – Anomalias congênitas associadas a anomalias congênitas vasculares do fígado ........................................................................................................................ 42 Quadro 5 – Características diferenciais entre atresia fetal e perinatal ...................... 54 LISTA DE ABREVIATURAS cm – centímetros mm – milímetros µm - milimicra 11 1 INTRODUÇÃO Apesar das anomalias congênitas do fígado e da vesícula biliar serem descritas há mais de 200 anos, foram os desenvolvimentos na imagem ultrassonográfica, incluindo a ultrassonografia de alta resolução associada com a imagem com Doppler colorido, que facilitaram a compreensão e o diagnóstico prénatal dessas malformações (Faseoliotis et al., 2002). Esses avanços na imagem possibilitaram não apenas o diagnóstico intraútero como também o prognóstico para os pais, dependendo da anomalia identificada; o planejamento terapêutico possibilitou redução das taxas de mortalidade no período pós-natal e ampliou as condições para o estudo das modificações morfológicas no desenvolvimento anormal intra-útero (DeLeve et al., 2009). As anomalias congênitas hepáticas e biliares passaram a ter uma característica marcante no que se refere à decisão terapêutica, porque ela deve ser individualizada para a maior parte dos pacientes. É primordial identificar com exatidão a anatomia topográfica das estruturas anômalas para definir a conduta terapêutica, especialmente considerando o tamanho reduzido das estruturas no neonato (Fuchs et al., 2010). Além disso, as anomalias do fígado e das vias biliares são entidades raras, o que pode dificultar o diagnóstico, o qual tem como premissa básica um conhecimento sólido sobre a embriologia dessas estruturas, visto que a maior parte das anomalias congênitas deriva de alterações do desenvolvimento embriológico (Stringer, 2008). A abertura do que Kiserud e Acharya (2004) denominaram nova era fetal pelas técnicas de imagem, passou a desafiar radiologistas e cirurgiões pediátricos a 12 buscar explicações para essas anomalias congênitas, na tentativa de programar o melhor manejo. A literatura pertinente, na maior parte dos artigos, descreve séries de casos e resultados terapêuticos, nas quais a anatomia da anomalia congênita é pouco contemplada, o que restringe sua utilização clínica, dada a diversidade dessas anomalias (DeLeve et al., 2009; Stringer, 2008). 1.1 Objetivo O objetivo deste trabalho é descrever o diagnóstico, o prognóstico e as condutas terapêuticas para as anomalias congênitas hepáticas e de vias biliares, associando-as ao desenvolvimento embriológico das estruturas envolvidas. 13 2 FUNDAMENTOS EMBRIOLÓGICOS – BASE DAS ANOMALIAS As anomalias congênitas do fígado incluem as distorções de volume, as calcificações, os tumores císticos e os sólidos, bem como as anomalias vasculares. As anomalias de vias biliares consistem em cistos de colédoco, atresia e litíase biliar. Para que se possam compreender tais anomalias, faz-se necessário rever a embriologia do fígado e das vias biliares. O broto ou divertículo hepático aparece no meio da terceira semana gestacional, como evaginação do epitélio endodérmico do intestino anterior, e prolifera rapidamente (Figura 1A). Em seu extremo distal, forma cordões celulares que penetram no septo transverso, primórdio do diafragma e da lâmina mesodérmica entre o pericárdio e o pedúnculo vitelino, a partir da qual se formarão, na décima semana, as células hematopoiéticas, as células de Kupffer e as do tecido conjuntivo, quando o fígado representa cerca de 10% do peso corporal do feto (Figura 1B). Esse peso se deve ao grande número de sinusóides das veias vitelinas e umbilicais e, em parte, à proliferação dos ninhos de células hematopoiéticas, função que é gradualmente perdida nos últimos dois meses intra-uterinos, com a maturação da medula óssea, que passa a ser o centro hematopoiético de polimorfonucleares e plaquetas. 14 Figura 1 – Desenhos da formação embriológica do fígado Legenda: A – embrião de aproximadamente 25 dias, mostrando tubo gastrointestinal e formação do divertículo hepático, derivado do revestimento epitelial endodérmico do intestino anterior. B – Embrião de aproximadamente 32 dias no qual se vêem os cordões epiteliais hepáticos penetrando no mesênquima do septo transverso Fonte: Langman (1985) Concomitantemente a essa proliferação acentuada no septo transverso, a conexão entre o divertículo hepático e o intestino anterior (duodeno) estreita-se e forma o ducto colédoco, do qual se originarão o ducto cístico e a vesícula biliar, inicialmente maciça, por proliferação de seu epitélio interno (Figura 2). Gradativamente, ocorre vacuolização do epitélio intrabiliar e a vesícula se torna oca. Os cordões hepáticos mesclam-se aos seios sanguíneos das veias vitelínicas e umbilicais, que formam os seios sinusoidais; diferenciam-se em parênquima hepático e revestem as vias biliares. Aproximadamente na décima segunda semana, as células hepáticas iniciam a síntese de bile, que já pode fluir pelos ductos hepático, cístico e colédoco (Langman, 1985). 15 Figura 2 – Desenhos da formação embriológica das vias biliares Legenda: A – embrião de aproximadamente 30 dias, mostrando a formação da vesícula biliar. B – Embrião de aproximadamente 35 dias no qual se vêem os ductos hepático, cístico e colédoco, antecedendo a rotação intestinal Fonte: Langman (1985) Dado seu crescimento pronunciado e rápido, no meio da quinta semana, o fígado torna-se muito volumoso para se confinar no interior do septo transverso e passa a salientar-se na cavidade abdominal, entre as duas lâminas peritoneais do mesogástrio ventral. Na face situada entre o fígado e a parede anterior do intestino, estirada e adelgaçada com a descida do fígado, forma-se a prega ou ligamento falciforme, em cuja margem livre, caudal, desce também a veia umbilical, anteriormente situada no mesoderma do septo transverso (Langman, 1985). Esse mesoderma, igualmente estirado e adelgaçado entre o fígado e o intestino anterior (estômago e duodeno), forma o omento menor (ligamento gastrohepático e hepato-duodenal), bem como a porção gastro-hepática do mesogástrio ventral. Na margem livre caudal do omento menor, estão situados o ducto colédoco, a artéria hepática e a veia porta, entre as duas lâminas peritoneais, formando o pedículo hepático. Em resumo, com a protrusão do fígado na parede abdominal, o mesoderma do septo transverso forma: a) o omento menor, localizado entre o fígado e intestino anterior; b) o ligamento falciforme, entre o fígado e a parede ventral do 16 abdome; c) o mesogástrio ventral, conexão peritoneal entre o intestino anterior e a parede abdominal ventral (Langman, 1985) (Figura 3). O mesoderma superficial do fígado diferencia-se em peritônio visceral, exceto na superfície póstero-superior, na qual se prende ao septo transverso primitivo, que passa a formar a parte tendínea do diafragma e constitui a área nua do fígado (Figura 3). Figura 3 – Desenhos da formação embriológica de fígado e vias biliares Legenda: A – embrião de aproximadamente 36 dias, mostrando fígado expandido na cavidade abdominal e condensação do mesênquima entre ele e o pericárdio, primórdio do diafragma. B – Ligamento falciforme (entre o fígado e a parede abdominal anterior) e omento menor (entre o fígado e o intestino anterior, ou seja, estômago e duodeno). Observar que o fígado está todo envolto pelo peritônio, exceto na “área nua”, pela qual se prende ao diafragma Fonte: Langman (1985) 2.1 Desenvolvimento embriológico do sistema arterial e venoso do fígado O sistema venoso hepático tem início a partir da quinta semana gestacional. O par de veias vitelínicas entra no embrião com o saco vitelínico e se anastomosa ao redor do duodeno em desenvolvimento, passando através do septo transverso do fígado primitivo para o seio venoso. No septo transverso, elas se dividem em 17 sinusóides e rapidamente proliferam entre os cordões de células hepáticas. A veia vitelínica esquerda involui e todo o sangue, proveniente da parte esquerda do fígado primitivo, é redistribuído para a veia vitelínica direita, que aumenta em diâmetro. Derivações das veias vitelínicas formam a parte terminal da veia cava inferior, das veias hepáticas e da veia porta (Figura 4). Figura 4 – Esquema ilustrativo do desenvolvimento embriológico do sistema venoso hepático Legenda: 1 – anastomose das veias vitelínicas em volta do duodeno, 2 – duodeno, 3 – septo transverso do fígado, 4 – seio venoso, 5 – veias umbilicais, 6 – ducto venoso, 7 – veia cava inferior, 8 – sistema venoso portal Fonte: Gallego et al., 2004 O par de veias umbilicais traz sangue oxigenado para o embrião; caminha pelos dois lados do fígado e termina no seio venoso. Quando entram em contato com os sinusóides hepáticos, transformam-se de tal forma que toda a veia umbilical direita e a porção da veia umbilical esquerda entre o fígado e o seio venoso degeneram. A porção persistente da veia umbilical esquerda passa a levar todo o sangue da placenta o feto, perfundindo o lobo esquerdo do fígado e dando origem ao ducto venoso, um vaso de grande diâmetro que se conecta a veia cava inferior, independente da circulação sinusal do fígado, ligando-se diretamente ao coração fetal (Gallego et al., 2004). O lobo direito do fígado é irrigado por sangue pobre em 18 oxigênio proveniente da veia porta direita, perfundida pelas veias esplênica e mesentérica fetal (Achiron et al., 2009; Stringer, 2008). Quanto ao suprimento arterial, que tem início a partir da oitava semana gestacional, portanto mais tardiamente que os vasos venosos, origina-se do tronco celíaco junto do hilo hepático, perto da veia porta extra-hepática fetal. Na décima semana gestacional, são visíveis os primórdios arteriais intra-hepáticos no parênquima, ao longo dos ramos intra-hepáticos do sistema portal, com distribuição restrita às regiões centrais. Acompanhando os ramos intra-hepáticos do sistema portal, os primórdios arteriais estendem-se até a periferia do fígado, que passam a irrigar a partir da décima quinta semana gestacional, progredindo seu crescimento até que o fígado atinja seu tamanho definitivo (Collardeau-Frachon, Scoazec, 2008). O desenvolvimento da circulação arterial do fígado, portanto, é intimamente dependente daquele do sistema portal intra-hepático, que se comporta como um guia para o desenvolvimento do suprimento arterial. Esse suprimento depende também do desenvolvimento do sistema biliar para a formação das respectivas artérias, de tal forma que investiga-se a hipótese de as células biliares sintetizarem substâncias sinalizadoras da arteriogênese (Lu et al., 2004). 19 3 ANOMALIAS DO FÍGADO 3.1 Calcificações hepáticas 3.1.1 DEFINIÇÃO Consistem na presença de concreções sólidas localizadas na superfície do fígado, no parênquima ou na região subcapsular da veia porta (Bronshtein, Blazer, 1995; Nguyen, Leonard, 1986; Wax et al., 2001) (Figura 5). Figura 5 – Calcificação hepática parenquimatosa Fonte: Hawass et al. (1990) 3.1.2 INCIDÊNCIA É uma condição rara cuja incidência não é referida na literatura, porque a maior parte da informação deriva de séries de fetos espontaneamente abortados, autópsia de recém-nascidos ou neonatos com estado gera muito comprometido. Os primeiros relatos de detecção pré-natal de calcificação no fígado surgiram em 20 meados de 1980 e apenas poucos casos têm sido publicados (Bronshtein, Blazer, 1995; Wax et al., 2001). Hawass et al. (1991) justificam a falta de informação sobre incidência dessa anomalia congênita no fato dela se acompanhar de outras anomalias mais graves, para as quais o observador dedica mais atenção, o que aumenta a possibilidade de seu subdiagnóstico. Bronshtein e Blazer (1995), analisando 24.600 gestações consecutivas de nuligestas por ultrassonografia endovaginal, entre a 14ª e a 16ª semana gestacional ou abdominal, entre a 18ª e a 26ª semana gestacional, determinaram incidência de 1:1.750 nascidos vivos e alertaram que calcificações hepáticas fetais detectadas por ultrassonografia, durante o segundo trimestre de gravidez, não são uma entidade rara e sinalizam para a necessidade da investigação de infecções por testes sorológicos e cariotipagem por amniocentese. Se esses exames estiverem normais, então as calcificações usualmente não são prejudiciais e têm bom prognóstico. 3.1.3 CLASSIFICAÇÃO As calcificações hepáticas são classificadas em três categorias principais, conforme sua localização: peritoneal, parenquimatosa ou vascular. As calcificações hepáticas peritoneais são a causa mais frequente de calcificação abdominal e consistem em concreções presentes na superfície do fígado (Bronshtein, Blazer, 1995; Hawass et al., 1990; Nguyen, Leonard, 1986; Wax et al., 2001). Parenquimatosas que apresentam-se como uma massa complexa que podem conter áreas de ecogenicidade aumentada, com ou sem sombra acústica, sugerindo 21 calcificação usualmente no quadrante superior direito (Hawass et al., 1990; Nguyen, Leonard, 1986). As vasculares são visualizadas no tromboembolismo de veia porta e na insuficiência vascular com infartos isquêmicos. As calcificações por tromboembolismo da veia porta são subcapsulares e estão confinadas no lobo direito ou no esquerdo, frequentemente associadas a ouras anormalidades (Bronshtein, Blazer, 1995; Hawass et al., 1990; Nguyen, Leonard, 1986; Wax et al., 2001). 3.1.4 ETIOPATOGENIA As peritoneais têm como principal causa a peritonite por mecônio e a peritonite plástica, devido à ruptura do hidrometrocolpo (Nguyen, Leonard, 1986). A peritonite por mecônio é secundária a uma obstrução, mecânica ou funcional, acarretando inspissação do mecônio e subsequente calcificação (Hawass et al., 1990). As parenquimatosas têm como etiologia infecções intra-útero por varicela, toxoplasmose, rubéola, citomegalovírus, sífilis e Herpes simplex vírus. Essas infecções transplacentárias se manifestam como áreas nodulares difusas de ecogenicidade aumentada e frequentemente se associam a múltiplas anormalidades congênitas e calcificação em outros órgãos (Bronshtein, Blazer, 1995; Hawass et al., 1990; Nguyen, Leonard, 1986; Wax et al., 2001). Hawass et al. (1990) referem que tais calcificações podem ser complicações secundárias de um feto gravemente enfermo, cuja imobilidade ou uma torção de 22 cordão umbilical, sem movimento reverso, podem ser fatores predisponentes. Outras causas incluem tumores hepáticos primários, incluindo hemangioma, hemangioendotelioma, hamartoma, hepatoblastoma, teratoma e neuroblastoma metastático, bem como distrofias idiopáticas parenquimatosas (Bronshtein, Blazer, 1995). As vasculares provavelmente são secundárias à necrose em topografia distal, a uma obstrução ou perifericamente a um trombo ou êmbolo em sistema vascular de fluxo sanguíneo centrífugo (veia porta e veia hepática). Os infartos isquêmicos, entretanto, são distribuídos no fígado, não apresentando predileção pela região periférica ou lobar, uma vez que o insulto vascular é generalizado a todo o sistema portal sem que se possa identificar uma anormalidade intravascular. O mecanismo de calcificação hepática isquêmica não está totalmente esclarecido, mas tem sido associado ao choque anêmico no feto, acarretando infarto sem trombose venosa secundária. O prognóstico da necrose hepática isquêmica no feto não é conhecido. Em exames de imagem as áreas envolvidas acompanham o arranjo centrolobular do sistema portal, de sorte que as calcificações podem se dispor uni ou bilateralmente. No entanto, quando a localização sonográfica da calcificação é periférica sugere o processo na veia porta, enquanto que o envolvimento difuso parece estar mais relacionado ao infarto isquêmico (Beluffi et al., 2004; Bronshtein, Blazer, 1995). Outra causa de calcificação hepática vascular é o hematoma subcapsular (Bronshtein, Blazer, 1995). 23 3.1.5 ANOMALIAS ASSOCIADAS As calcificações hepáticas fetais frequentemente se associam a múltiplas anormalidades, dentre as quais estão: higroma cístico, coarptação do arco aórtico, rins em ferradura, hipoplasia da aorta ascendente, má rotação intestinal, microgastria, hipoplasia vesical, das artérias umbilicais, destrocardia, persistência da veia cava esquerda superior, microcólon, hipoplasia segmentar múltipla intestinal, hérnia diafragmática, cardiomegalia hipertrófica e volvo do íleo (Hawass et al., 1990; Wax et al., 2001). 3.1.6 DIAGNÓSTICO PRÉ-NATAL O diagnostico pré-natal das calcificações hepáticas fetais é ultrassonográfico e se constitui em um achado do exame pré-natal (Bronshtein, Blazer, 1995; Hawass et al., 1990; Nguyen, Leonard, 1986; Wax et al., 2001). 3.1.7 CONDUTA PRÉ-NATAL Na maioria dos casos, são diagnóstico com mau prognóstico e indicativa da possibilidade de interrupção da gravidez. Wax et al. (2001), ao relatarem um caso de calcificação hepática vascular, referem que esse diagnóstico tem como principal benefício o aconselhamento adequado aos pais para que tenham tempo de tomar sua decisão. 24 3.2 Tumores císticos 3.2.1 DEFINIÇÃO São formações raras, geralmente benignas e visualizadas no terceiro trimestre gestacional, de conteúdo líquido ou semi-sólido (Hackmon-Ram et al., 2000; Saxena, van Tuil, 2006; Wax et al., 2009). 3.2.2 INCIDÊNCIA Na literatura, os autores afirmam que os tumores císticos hepáticos congênitos são raros, mas a incidência é desconhecida. Foley et al. (2003), em estudo retrospectivo de 10 anos, em um centro australiano de cuidados pré-natais, com 22.000 nascimentos por ano, identificaram incidência de 1:7.300. Nos países em que a ultrassonografia pré-natal não integra a assistência como rotina, Charlesworth et al. (2007) ressaltam a necessidade da divulgação dessa anomalia, dado que o diagnóstico por imagem pode representar um problema prático para decisão da estratégia de manejo. 3.2.3 CLASSIFICAÇÃO Os tumores císticos congênitos, originados no parênquima hepático, podem ser classificados morfologicamente (unilocular ou multilocular), histologicamente, com base na natureza do epitélio e na presença ou ausência de músculo liso na parede (hamartoma mesenquimal ou parenquimal simples) (Mittermayer et al., 2002), ou com base no conteúdo (com ou sem bile). Os cistos contendo bile, por 25 indicarem presença de malformação colédoco intra-hepática, são classificados como tipo V no critério de Todani et al. (1977). 3.2.4 ETIOPATOGENIA A etiologia dos tumores císticos hepáticos é desconhecida. As hipóteses sugerem obstrução dos ductos biliares aberrantes ou ainda a inclusão de um resto de epitélio celômico no fígado em desenvolvimento, com base na similaridade do epitélio delineante com o mesotélio. Independente da etiopatogenia, os autores sugerem que a acumulação fluida, que acarreta a dilatação cística, ocorre predominantemente no terceiro trimestre da gravidez (Macken et al., 2000). Hackmon-Ram et al. (2000) sugerem que esses tumores císticos, embriologicamente, podem representar interrupções no desenvolvimento da árvore biliar intra-hepática, mas essa hipótese precisa ser confirmada. Rogers et al. (2007) apresentam como causas de tumor cístico solitário: hamartoma mesenquimal, cisto colédoco intra-hepático, cisto epidermóide e linfangioma. 26 3.2.5 ANOMALIAS ASSOCIADAS Há referências da associação de tumores císticos hepáticos com hiperplasia do vilus placentário (Kitano et al., 2000), hidropsia por dilatação aneurismática das veias placentárias atribuída à compressão intra-útero da veia umbilical (Tsao et al., 2002) ou hipoplasia pulmonar (Hackmon-Ram et al., 2000). 3.2.6 DIAGNÓSTICO PRÉ-NATAL O diagnóstico pré-natal de tumores císticos hepáticos é predominantemente descrito como ultrassonográfico, bi ou tridimensional, mas há referência do emprego de tomografia computadorizada ou imagem por ressonância magnética para os casos de cistos grandes ou que geram dúvida diagnóstica (Charlesworth et al., 2007; Rogers et al., 2007) (Figuras 6 e 7). Figura 6 – Imagem de tumor cístico hepático por ultrassonografia Fonte: Adaptado de Wax et al. (2009) 27 Figura 7 - Imagem de tumor cístico hepático por ressonância magnética Fonte: Adaptado de Rogers et al. (2007) Devido à necessidade de diferenciar tumor cístico hepático de malformação vascular, pode ser necessária a ultrassonografia com Doppler, por ter maior sensibilidade, especialmente quando o tumor estiver adjacente a vasos portais e à artéria hepática (Hackmon-Ram et al., 2000). 3.2.7 DIAGNÓSTICO DIFERENCIAL O diagnóstico diferencial do tumor cístico unilocular inclui: duplicação cística, cisto mesentérico, linfangioma cístico, cisto do úraco, cisto do colédoco e, em feto do sexo feminino, cisto ovariano (Macken et al., 2000). Tumores císticos, em geral, devem ser diferenciados de cistos biliares, hepatoblastoma, hamartoma mesenquimal e malformações vasculares (HackmonRam et al., 2000). 28 Os tumores císticos hepáticos múltiplos devem ser diferenciados da doença policística congênita, fibrose hepática congênita e dilatação dos ductos biliares intrahepáticos. Se a origem hepática do cisto não puder ser demonstrada, o diagnóstico diferencial inclui cistos renais, adrenais e intestinais (Bronshtein et al., 2009). 3.2.8 CONDUTA PRÉ-NATAL A presença de tumores císticos hepáticos requer acompanhamento com exames de imagem para identificação do aumento do volume, que pode causar compressão das estruturas adjacentes, bem como para decisão do tipo de parto (Hackmon-Ram et al., 2000). Os cistos volumosos (maiores que 10 cm de diâmetro) podem ser puncionados e aspirados, usando ultrassonografia por guia. A análise do conteúdo cístico tem ainda a vantagem de permitir um diagnóstico mais acurado e, consequentemente, melhor planejamento da assistência pós-natal (Hackmon-Ram et al., 2000). Os tumores císticos simples, aspirados intra-útero, podem ter regressão espontânea pós-natal, mas os multiloculares exigem investigação pós-natal da origem do cisto, porque sua etiopatogenia não é conhecida e eles apresentam positividade para marcadores imunoistoquímicos de proliferação celular (Fujishiro et al., 2005; Mittermayer et al., 2002). 29 3.2.9 CONDUTA OBSTÉTRICA Tumores císticos volumosos podem dificultar o parto vaginal por favorecerem distócia. Por isso, em alguns casos, o parto cesáreo está indicado. No entanto, essa avaliação deve ser cuidadosa devido ao relato de partos transvaginais, sem complicação, em presença de cistos volumosos (Hackmon-Ram et al., 2000; Mittermayer et al., 2002; Wax et al., 2009). 3.2.10 ASSISTÊNCIA NEONATAL Mais recentemente, além da aspiração percutânea do conteúdo cístico e da cirurgia a céu aberto, para retirada da membrana cística, a cirurgia laparoscópica, minimamente invasiva, tem sido empregada com sucesso, embora ainda exija cuidado redobrado, quando comparada à técnica em crianças, dada as dificuldades das pequenas dimensões das estruturas e de uma parede abdominal relativamente fina que restringe a fixação e diminui a segurança das portas de trabalho. É possível que o desenvolvimento de instrumental menor viabilize maior número de cirurgias (Saxena, van Tuil, 2006). O tratamento cirúrgico está indicado nos casos de cistos grandes associados a deslocamento diafragmático e dificuldade respiratória, bem como compressão gastrintestinal e dificuldade de aleitamento (Wax et al., 2009). 30 3.3 Tumores sólidos 3.3.1 DEFINIÇÃO São uma massa detectada por ultrassonografia pré-natal ou exame físico no período neonatal que se caracterizam como processos neoplásicos, benignos ou não, usualmente grandes. Incluem uma vasta gama de doenças e são potencialmente perigosos (Isaacs Jr. 2007; Keslar et al., 1993). 3.3.2 INCIDÊNCIA Correspondem de 1% a 4% dos tumores em criança e 5% do total de neoplasias de vários tipos em fetos e neonatos (Chan et al., 2007; Isaacs Jr. 2007). 3.3.3 CLASSIFICAÇÃO No Quadro 1, está a classificação dos tumores sólidos hepáticos neonatais e fetais e as condições de tumor-like, dentre os quais os mais frequentes são o hemangioma (taxa de incidência de 4% a 5% em crianças brancas), o hamartoma mesenquimal e hepatoblastoma, os três com apresentação clínica como massa abdominal diagnosticada por ultrassonografia pré-natal. Os demais tumores sólidos hepáticos são metastáticos mais que primários (Isaacs Jr, 2007). Nesta monografia são detalhados esses três tumores mais frequentes, dado que seu diagnóstico é firmado no período pré-natal. 31 Tipos tumorais Hemangioma infantil Focal ou solitário Multifocal Hemangioendotelioma tipo I Hemangioendotelioma tipo II (angiosarcoma) Hamartoma mesenquimal Cisto unilocular solitário Adenoma Hiperplasia nodular focal Hepatoblastoma Epitelial Fetal Embrionário Misto: epitelial e mesenquimal Anaplásico Tipos tumorais Carcinoma hepatocelular Tumor de células germinativas Teratoma Tumor de saco vitelínico Coriocarcinoma Tumor rabdóide Sarcoma hepático Sarcoma indiferenciado (embrionário) Rabdomiosarcoma Neoplasia metastática Neuroblastoma Leucemia Tumores renais (Wilms) Tumor de saco vitelínico Tumor rabdóide Coriocarcinoma Quadro 1 – Classificação dos tumores hepáticos neonatais e fetais e das condições tumor-like Fonte: Adaptado de Isaacs Jr (2007) Histologicamente há dois subtipos de hemangioma: tipo I, mais frequente, que consiste de camada simples ou ocasionalmente múltipla de agrupamentos de células endoteliais, com raras figuras de mitose; tipo II, no qual as células são pleomórficas, grandes, mais hipercromáticas do que do tipo I, com células endoteliais mais ramificadas dando a impressão de estarem livres no interior dos espaços vasculares (Keslar et al., 1993). Em 2007, Christison-Lagay et al. propuseram um critério classificatório para os hemangiomas em lesões focais, lesões multifocais e lesões difusas. As lesões focais são assintomáticas e raramente se acompanham por hemangiomas cutâneos; são detectáveis à ultrassonografia pré-natal e parecem ser a forma hepática do hemangioma congênito cutâneo de involução rápida. O hemangioma de lesões multifocais acompanha-se de alargamento das artérias e veias hepáticas e da presença de shunts arteriovenosos. Também são assintomáticos, porém, detectados apenas no período pós-natal associado à insuficiência cardíaca de alto débito, secundária a shunts arteriovenosos ou portovenosos. As lesões difusas são 32 extensas, envolvendo quase todo parênquima hepático e o substituindo por um inumerável conjunto de lesões dispostas centripetamente. 3.3.4 ETIOPATOGENIA Os tumores sólidos do fígado derivam de alteração mitótica que se inicia no período embrionário, mas evolui rapidamente no período pós-natal, podendo involuir lentamente durante a infância (Christison-Lagay et al., 2007). Hemangioma, também denominado hemangioendotelioma, deriva do aumento das anastomoses vasculares, do tipo capilar e sinusoidal, entremeadas de grandes espaços, do tipo cavernoso, possivelmente originadas do processo de maturação ou de regressão da lesão. Os espaços vasculares podem conter células hematopoiéticas extra-medulares ou trombos e pequenos ductos biliares podem estar presentes, demonstrando o processo mitótico desordenado (Keslar et al., 1993). Para o hamartoma mesenquimal há quatro hipóteses etiopatogênicas: de desenvolvimento, vascular, por insulto tóxico e neoplásica. De acordo com a hipótese de desenvolvimento, essa neoplasia se originaria de uma má formação da placa ductal, desenvolvendo-se tardiamente na embriogênese, a partir do mesênquima do trato portal, crescendo nas ilhas de parênquima hepático. Dessa forma, seriam explicadas suas semelhanças com as anormalidades ductulares biliares observadas na doença de Caroli e na fibrose hepática congênita. Okeda (1976) sugeriu que um insulto vascular localizado no fígado fetal em desenvolvimento provocaria defeito de desenvolvimento biliar focal e formação cística, como consequência de modificações reativas à isquemia regional (Mascarello, Krous, 1992; Rakheja et al., 2004). 33 Estudos imunoistoquímicos demonstraram que as células estromais no tumor podem expressar proteínas encontradas nas células sinusoidais de armazenamento de lipídeos do fígado normal. Daí a hipótese tóxica advoga a possibilidade de um insulto tóxico desencadear as modificações neoplásicas (Mascarello, Krous, 1992; Rakheja et al., 2004). Na hipótese neoplásica, admite-se que haveria uma desorganização celular benigna, cuja proliferação estaria limitada a células maduras normalmente encontradas no sítio de crescimento, portanto um hamartoma, mas atualmente se advoga que essa neoplasia seja classificada como neoplasia verdadeira. Estudos mais recentes de citogenética têm demonstrado translocação gênica com aneoploidia típica de tumores malignos (Mascarello, Krous, 1992; Rakheja et al., 2004). Os hepatoblastomas se originam de células imaturas precursoras do fígado com características morfológicas anormais, que mimetizam o desenvolvimento hepático normal, possivelmente devido a uma transdução gênica aberrante da catenina-Wntbeta, hipótese que vem sendo testada (Willert, Dahl, 2010). 3.3.5 ANOMALIAS ASSOCIADAS Podem se associar ao hemangioma uma cardiomegalia, alargamento da aorta proximal e da artéria hepática, bem como das veias hepáticas e shunt arteriovenoso (Keslar et al., 1993). O hamartoma mesenquimal do fígado se associa a anormalidades placentárias, como trombose vascular ou sangramento, provavelmente por 34 obliteração da veia umbilical pelo tumor. Pode haver também hiperplasia vilosa mesenquimal da placenta causada pela expansão edematosa difusa dos vile placentários. No entanto, não há consenso se essa alteração é uma anomalia associada ou derivada da obstrução da veia umbilical pelo tumor (Gow et al., 2009; Laberge et al., 2005). No hepatoblastoma, várias anomalias congênitas e síndromes de malformação ocorrem, dentre elas, a hemi-hipertrofia, a síndrome de BeckwithWiedemann e a síndrome da polipose adenomatosa intestinal (Isaac Jr, 2007). 3.3.6 DIAGNÓSTICO PRÉ-NATAL No feto, a apresentação mais comum do hemangioma é uma massa hepática, detectável por ultrassonografia, que se acompanha por anemia, hidropsia, poliidrâmnio, insuficiência cardíaca congestiva, trombocitopenia e coagulação intravascular disseminada, que contribuem para o óbito Os tumores sólidos do fígado derivam de alteração mitótica que se inicia no período embrionário, mas evolui rapidamente no período pós-natal, podendo involuir lentamente durante a infância (Isaacs Jr., 2007). No neonato, a hepatomegalia é o achado mais marcante. Podem estar presentes insuficiência cardíaca congestiva, hemangioma cutâneo, dispnéia, cardiomegalia, trombocitopenia e aumento da concentração da alfa-feto proteína. Note-se que essa proteína, em neonatos normais, está muito elevada nos primeiros dois meses de vida (Isaacs Jr., 2007). 35 3.3.7 DIAGNÓSTICO DIFERENCIAL Tomando o hemangioma como parâmetro de comparação, o hepatoblastoma ocorre mais tardiamente, ao primeiro ano de vida ou após e apresenta concentração de alfa-feto proteína maior, bem como na imagem por tomografia computadorizada é mais heterogêneo, especialmente após injeção de contraste (Keslar et al., 1993). O hamartoma mesenquimal ocorre em infantes e tal como o hemangioma não se associa ao aumento da concentração da alfa-feto proteína. Pode, em exame de imagem, ocasionalmente assemelhar-se ao hemangioma por apresentar características histológicas que se superpõem. A principal diferença é que o hamartoma mesenquimal aparece com massa cística multilocular e raramente como lesão sólida, como o hemangioma. Quando o hamartoma mesenquimal é sólido apresenta hipovascularização ou avascularização (Keslar et al., 1993). 3.3.8 ASSISTÊNCIA NEONATAL A terapêutica dos tumores sólidos hepáticos pode ser limitada devido à idade gestacional e à maturidade do feto. Os hemangiomas podem involuir espontaneamente, por isso, são tratados com corticoterpia, conservadoramente, especialmente se assintomáticos. Após ter sido localizado, e em presença de sintomas a excisão cirúrgica está recomendada. Pode ser feita ligação ou embolização da artéria hepática exclusivamente nos casos de insuficiência cardíaca não responsiva à terapêutica ou coagulopatia de consumo (Isaacs Jr, 2007). O harmatoma mesenquimal, uma lesão benigna, tipicamente assintomática, quando tratado cirurgicamente, oferece ótimo prognóstico (Isaacs Jr, 2007). 36 O hepatoblastoma é o principal tumor maligno do feto e do neonato e, se não tratado por excisão, é fatal em dois anos (Isaacs Jr, 2007). 3.4 Anomalias vasculares 3.4.1 DEFINIÇÃO As anomalias vasculares do fígado, do ponto de vista embriológico, consistem na persistência de vasos que, no desenvolvimento embriológico, deveriam involuir, na duplicação de vasos únicos e na formação de interligações anômalas (Yagel et al., 2010). Do ponto de vista da hemodinâmica, consistem em shunt anormal dos vasos sanguíneos dentro e ao redor do fígado, que têm sido mais bem estudadas, recentemente, em exames de imagem. Incluem shunt da artéria hepática à veia hepática (shunt arteriovenoso ou arterioepático), da artéria hepática para a veia porta (shunt arterioportal) e da veia porta para a circulação sistêmica (shunt portossistêmico ou portoepático). Esses três tipos podem coexistir na presença de telangiectasia hemorrágica hereditária, condição rara cuja manifestação clínica ocorre em adultos, apesar de ser anomalia congênita (Deleve, Valla, Gracia-Tsao, 2009). O Consenso da Associação Americana para Estudo das Doenças Hepáticas, em 2008, considerou malformações congênitas vasculares isoladas apenas aquelas não associadas à telangiectasia hereditária familiar e usualmente diagnosticada em neonatos ou crianças, por serem raras e terem diagnóstico e manejo menos referidos na literatura (Deleve, Valla, Gracia-Tsao, 2009). 37 Pelo fato de as anomalias vasculares do fígado serem diversificadas, é preciso definir cada uma delas: a) Malformações arteriovenosas – anormalidades congênitas na formação dos vasos sanguíneos que misturam o sangue por meio de conexões arteriovenosas diretas, sem tecido neoplásico anormal entre os vasos anômalos, usualmente localizadas em um lobo do fígado; b) Fístulas arterioportais – consistem em canais intra ou extra-hepáticos comunicando artérias ao sistema porta e podem se associar à atresia biliar, síndrome de Ehlers-Danlos e telangectasia hemorrágica hereditária; c) Shunt portossistêmico – consiste na formação de interligação congênita do sistema porta à circulação sistêmica, derivada de anomalia do desenvolvimento da veia cava inferior intra e extra-hepática e das veias vitelínicas; d) Shunts portovenosos – consistem na persistência do ducto arterioso; e) Retorno venoso total pulmonar anômalo – consiste na formação cardíaca anormal na qual as veias pulmonares não se conectam ao átrio esquerdo, mas drenam o sangue para o sistema porta ou para o ducto venoso (Figura 8). 38 Figura 8 – Esquema ilustrativo da disposição anômala com drenagem para o fígado ou a veia porta esquerda por um canal comum calibroso Fonte: Adaptado de Gallego et al. (2004) 3.4.2 INCIDÊNCIA Embora as anomalias congênitas vasculares do fígado sejam tema de diversos trabalhos, devido a sua raridade, estes consistem descrições de séries de casos, habitualmente com pequeno número de pacientes, para apresentar a técnica cirúrgica ou relatar a sobrevida. Por isso, as informações sobre incidência são escassas, como se percebe nas lacunas do Quadro 2, para as quais após consulta em 26 trabalhos não foi possível identificar. 3.4.3 CLASSIFICAÇÃO Considerada a embriologia da circulação hepática, cujas características são complexas, as anomalias vasculares podem ser classificadas em duas categorias: 39 venosas e arteriais. As anomalias venosas apresentam quatro subtipos, segundo a veia embriológica comprometida (Quadro 2). Veia fetal comprometida Anomalia vascular venosa Malformações complexas Cardinal Malformações isoladas Umbilicais Falha primária da formação de anastomoses críticas Persistência da veia umbilical direita (1:250 a 1:570) com ou sem veia umbilical esquerda ou ducto venoso Variações da veia umbilical (1:1.000) Vitelínicas Falha primária da formação de anastomoses críticas Exemplos Síndromes heterotáxicas ou erro de lateralização incompleta (1:1.000) Persistência da veia cava superior (9% dos fetos com anomalia cardíaca) ou inferior esquerda, persistência da veia cava esquerda superior ou inferior; duplicação da veia cava superior ou inferior e interrupção da veia cava inferior Conexão anormal das veias umbilicais com agenesia do ducto venoso (6:1.000) Agenesia completa do sistema porta (shunt portossistêmico) Agenesia parcial dos ramos portais direito, esquerdo ou bilateral (shunt portoepatossistêmico) Conexão anômala Total (1:17.000) pulmonar venosa Parcial (6,8:100.000) Quadro 2 – Classificação das anomalias vasculares hepáticas venosas, segundo Achiron e Fasouliotis e respectivas incidências Fonte: Adaptado de Achiron et al. (2009), Fasouliotis et al. (2002) e Yagel et al. (2010) Segundo a classificação de Mullicken e Glowacki, as anomalias vasculares hepáticas são subdivididas em: fluxo rápido (fístula arterioportal), fluxo lento (shunt portossistêmico e fístula portossistêmica) e forma combinada. No Quadro 3, estão apresentadas as anomalias vasculares hepáticas para as quais há classificação em subtipos. 40 Shunt portossistêmico Tipo Extra-hepático Intra-hepático Formação de um vaso calibroso, único, que conecta a veia portal direita à veia cava inferior I Ausência das veias porta intra-hepáticas I-A veias esplênica e mesentérica superior drenam separadamente para a veia cava inferior I-B Veias esplênica e mesentérica superior formam um tronco comum antes de drenar para a veia cava inferior II O sistema porta está intacto, mas parte do fluxo portal é desviado para a veia cava através da comunicação extra-hepática para um lado ou para outro Shunt periférico em que há uma ou mais comunicações no segmento hepático único III Conexão aneurismal entre as veias porta e hepática O shunt consiste de um aneurisma IV Múltiplas conexões entre as veias hepática e porta, difusamente em ambos os lobos Presença de comunicações múltiplas entre as veias portais periféricas e as veias hepáticas, em diversos segmentos Quadro 3 – Classificação das anomalias vasculares do fígado Fonte: Adaptado de Witters et al. (2008) e Gallego et al. (2004) 3.5 Etiopatogenia A etiopatogenia das anomalias congênitas vasculares do fígado é a presença de alterações no processo de desenvolvimento embrionário e, de certa forma, se confunde com a própria classificação dessas anomalias. Embora o Quadro 1 seja elucidativo, optou-se por descrever mais detalhadamente alguns dos mecanismos do desenvolvimento vascular hepático. No shunt portossistêmico extra-hepático tipo 1, a ausência congênita da veia porta tem sido atribuída a uma involução excessiva da alça venosa vitelínica perintestinal ou à total falha de as veias vitelínicas estabelecerem anastomose crítica com os sinusóides hepáticos ou com as veias umbilicais. Outra hipótese é que esses shunts têm origem devido à persistência da anastomose subcardinoepática com as veias vitelínicas. Nesse tipo, a anomalia vascular é subdividida em um grupo no qual as veias esplênica e mesentérica superior terminam separadas das veias sistêmicas e, em outro, em que as veias esplênica e mesentérica superior se unem para formar 41 um tronco comum que desemboca na veia cava inferior, no átrio direito ou nas veias ilíacas (Figura 9). Canal cárdiohepático direito Plexo vitelínico invadido pelo fígado Proliferação de células hepáticas Veia umbilical direita atrófica Veia umbilical esquerda Veia vitelínica direita (cranial) Seio venoso Veia vitelínica esquerda (cranial) Comunicação dorsal Veia esplênica Veia vitelínica direita (caudal) Veia vitelínica esquerda (caudal) Veia mesentérica superior Veia umbilical esquerda Veia vitelínica direita persistente Veia esplênica Veia porta principal Veias vitelínicas préhepáticas atróficas Veia mesentérica superior Figura 9 – Esquema do desenvolvimento do sistema portal extra-hepático normal e anômalo Fonte: Florio et al. (1998) Admite-se que a origem dos shunts portossistêmicos intra-hepáticos é a persistência da comunicação entre as veias vitelínicas do sistema onfalomesentérico e o venoso sinusal, devido à ausência focal de formação dos sinusóides 3.5.1 ANOMALIAS ASSOCIADAS Tal como se verificou nas definições, nas classificações e nas incidências, as anomalias associadas mantêm características comuns ao tipo de malformação vascular embriológica (Quadro 4). 42 Anomalia congênita vascular Shunt intra-hepático Anomalias congênitas associadas Dismorfismo Testa proeminente Rebaixamento da posição das orelhas Defeito septal atrial menor Fibrose cística Shunt portocava tipo I Poliesplenia Destrocardia Hepatoblastoma Coarctação da aorta Anormalidades cardíacas Shunt portocava tipo II Síndrome de Down Shunt extra-hepático Atresia biliar Má rotação intestinal Poliesplenia anormal Veia cava inferior intra-hepática anormal Shunt portossistêmico Galactosemia Persistência do ducto venoso patente Defeito ventrículo-septal Patência do ducto arteriosos Agenesia de veia porta Hidrotórax Fístula arteriovenosa Cardiomegalia Quadro 4 – Anomalias congênitas associadas a anomalias congênitas vasculares do fígado Fonte: Stringer (2008), Sakura et al. (2001), Ono et al. (1998) 3.5.2 DIAGNÓSTICO Pode ser feito, com segurança, empregando exame ultrassonográfico com Doppler colorido, imagem por ressonância magnética, angiografia, tomografia computadorizada e ecocardiograma, obedecendo a um algoritmo de decisão, conforme apresentado na Figura 10. 43 Ultrassonografia com doppler Veia vertical? Sim Não Artéria hepática Aumento do índice de resistividade Índice de resistividade normal Veia porta Veia porta? Hepatocentrípeto Hepatocentrífugo Cintilografia de glóbulos vermelhos Angiografia, MR Fístula arterioportal Ausente Ausência congênita da veia porta Malformação arteriovenosa Ecocardiograma Ligações intra-hepáticas? TC e IRM IRM Hemangioma Presente Ausente TC e IRM Desvio portossistêmico extra-hepático Presente Infra-diafragmática Derivação portossistêmica intra-hepática Figura 10 – Algoritmo para diagnóstico de shunts vasculares hepáticos congênitos, a partir de ultrassonografia com Doppler Fonte: Adaptado de Gallego et al. (2004) Recentemente o aprimoramento da ressonância magnética e tomografia computadorizada, associadas a programas de informática médica para construção de modelo anatômico tridimensional, permite análise e planejamento cirúrgico mais preciso e mais seguro (Fuchs et al., 2010). 3.5.3 ASSISTÊNCIA NEONATAL A conduta terapêutica para as anomalias vasculares do fígado deve ser cuidadosamente planejada, considerando o tipo de anomalia, a condição do nascimento, a idade do neonato e as condições anatômicas do sítio cirúrgico, dada a 44 complexidade da circulação hepática e as possibilidades da existência de variantes, evitando a hipertensão portal e a encefalopatia hepática causadas pela oclusão do shunt (Stringer, 2008). Nem todas as anomalias vasculares do fígado devem ser tratadas com terapêutica cirúrgica, porque o manejo clínico e a expectação podem permitir sobrevida em boas condições de saúde, bem como atualmente é possível o emprego da cirurgia laparoscópica minimamente invasiva com sucesso. Em casos extremos, pode ser necessário transplante hepático (Lee et al., 2010). 45 4 ANOMALIAS DAS VIAS BILIARES 4.1 Cisto de Colédoco 4.1.1 DEFINIÇÃO Cisto de colédoco, também denominado cisto congênito do ducto biliar, é uma lesão relativamente rara que consiste na dilatação cística do ducto biliar comum, descrito pioneiramente por Vater e Ezler, em 1723, mas publicado por Douglas, em 1853, com a descrição clínica completa do caso e a hipótese da origem congênita (Besner et al., 2008). Outros autores referem-se a cisto congênito de colédoco como a dilatação do ducto biliar extrapancreático ou dos ductos biliares intra-hepáticos e extra-hepáticos (Kamisawa et al., 2009). 4.1.2 INCIDÊNCIA Estima-se que os cistos de colédoco apresentem uma incidência variando de 1:13.500 a 1:2.000.000 nascidos vivos nos países orientais, sendo a doença mais frequente na Ásia (Besner et al., 2008; Mabrut et al., 2010; Roquete, 2000). Quanto à prevalência, 25% dos casos são diagnosticados no período antenatal ou no primeiro ano de vida; 60%, durante a primeira década de vida e aproximadamente 20%, permanecem não diagnosticados até a idade adulta. Essa variação de prevalência tem sido atribuída tanto à falta de atenção para a doença em regiões 46 com baixa prevalência como a melhor acurácia dos estudos de imagem não invasivos (Mabrut et al., 2010). 4.1.3 CLASSIFICAÇÃO O cisto de colédoco foi classificado por Alonso Lej (1959) em três categorias, com base no tamanho do ducto biliar dilatado: tipo cístico (tipo I), diverticular (tipo II) e cístico no duodeno (tipo III), sendo o tipo I frequentemente associado à anomalia congênita da junção pancreatobiliar, raramente presente nos tipos II e III. Em 1997, Todani modificou a classificação de Alonso Lej, gerando uma padronização internacional. Na classificação de Todani, há cinco tipos de cisto de colédoco, classificados de acordo com a localização (extra-hepático e intrahepático), extensão (segmentar ou completa) e forma (cística ou sacular e fusiforme) (Besner et al., 2008; Haller, 1991; Mabrut et al., 2010; Roquete, 2000) (Figura 11): a) tipo I – dilatação da árvore biliar extra-hepática, classificada como I-A cística (encontrada em 70% a 90% dos casos), I-B segmentar, I-C fusiforme; b) tipo II – divertículo da árvore biliar extra-hepática supraduodenal, presente em 2% a 5% dos casos; c) tipo III – dilatação da porção intraduodenal da árvore biliar extra-hepática, também denominada coledococele (encontrada em 4% dos casos); d) tipo IV – também denominado forma frusta, consiste em múltiplas dilatações, integradas por dilatação cística ou fusiforme do ducto biliar comum associada à dilatação dos ductos biliares intra-hepáticos. Seus subtipos são: IV-A (encontrada 47 a 10% a 20% dos casos), quando há dilatação intra e extra-hepática da árvore biliar e IV-B, na presença de dilatações múltiplas e segmentares da árvore biliar extra-hepática; e) tipo V – dilatação segmentar, múltipla, cística, fusiforme ou sacular, estritamente limitada à árvore biliar intra-hepática, sem componente extra-hepático, correspondendo a 1% dos casos. Quando associada à fibrose hepática, é denominada doença de Caroli, que se associa também a doença de rins policísticos e ectasia tubular renal (Haller, 1991). I -C IV - A II IV - B Figura 11 – Tipos de cisto de colédoco segundo classificação de Todani Fonte: Adaptado de Besner et al. (2008) e Mabrut et al. (2010) III V 48 4.1.4 ETIOPATOGENIA Não há uma etiologia universalmente aceita para a formação dos cistos de colédoco. Para os tipos I a IV, diversas hipóteses têm sido propostas, admitindo derivar de fraqueza do ducto biliar comum nos estágios de desenvolvimento que possibilitaria a dilatação, em resposta a uma obstrução distal. Essa hipótese tem por base a alta associação entre cistos colédocos e atresia biliar em neonatos (Haller, 1991). A hipótese mais aceita denomina-se teoria do canal comum longo de Babbitt, Starshak e Clement (1973), baseada na detecção de altas concentrações de enzimas pancreáticas na bile desses pacientes. A teoria admite que a presença de uma junção pancreático-biliar com um canal comum longo, maior que 10 mm a 15 mm, e a junção pancreático-biliar mais proximal do que o usual ao esfíncter de Oddi, devido a falha da separação normal, podem permitir o refluxo do suco pancreático para o canal biliar comum, resultando em colangite com inflamação, enfraquecimento das paredes do ducto biliar comum e aumento da pressão intraductal que acarreta dilatação ductal secundária (Figura 13) (Babbitt, Starshak, Clement, 1973). Figura 12 – Anomalia da junção entre ducto biliar comum e ducto pancreático Nota: Observar que em condição normal, o canal colédoco e o ducto pancreático dispõem de esfíncteres distintos, o que não ocorre na condição anômala, permitindo refluxo do suco pancreático Fonte: Haller (1991) 49 Outras hipóteses etiopatogênicas para cisto de colédoco dos tipos I a IV incluem obstrução anatômica ou funcional da parte distal da árvore biliar extrahepática; oligoganglionose da parte distal da árvore biliar extra-hepática resultante de uma inervação autonômica inadequada do ducto biliar, que promoveria alteração na motilidade e obstrução funcional do ducto biliar comum, raciocínio idêntico ao que se emprega para explicar a acalásia esofágica e a doença de Hirschsprung (Mabrut et al., 2010). Para o tipo V da classificação de Todani, admite-se ser resultante de malformação embriológica da placa ductal. Essa anormalidade é responsável pela proliferação ductular biliar na configuração da placa ductal, que pode ser macroscópica e microscopicamente identificada. Se os ductos biliares intrahepáticos largos são afetados, resulta na doença de Caroli, enquanto que ductos biliares interlobulares pequenos resultam em fibrose hepática congênita. Quando todos os níveis da árvore biliar são afetados, estão presentes tanto a fibrose hepática congênita quanto a doença de Caroli, condição denominada Síndrome de Caroli, a qual pode estar associada a doenças renais desde ectasia tubular até rins policísticos (Kamisawa et al., 2009; Nagorney,2000). 4.1.5 ANOMALIAS ASSOCIADAS Não se encontrou na literatura referência a anomalias associadas ao cisto de colédoco, possivelmente porque as anomalias, nesse caso, confundem-se com a própria etiopatogenia. Alguns autores referem a obstrução gástrica incompleta consequente ao cisto de colédoco grande, como complicação, não como anomalia associada (Besner et al., 2008). 50 No entanto, parece importante ressaltar que esta entidade nosológica se associa a adenocarcinoma no ducto biliar comum induzido pela presença de anomalia na junção pancreatobiliar, que promove refluxo de enzimas proteolíticas pancreáticas, cuja estagnação causaria injúria no epitélio biliar induzindo hiperplasia e metaplasia, condições de promoção da progressão da neoplasia (Kamisawa et al., 2009). 4.1.6 DIAGNÓSTICO PRÉ-NATAL O diagnóstico pode ser firmado por ultrassonografia, a partir da 15ª semana gestacional, que corresponde ao tempo da formação das enzimas pancreáticas, como uma estrutura cística abaixo do fígado (Besner et al., 2008). Outros autores referem que o cisto de colédoco pode se apresentar como uma estrutura cística na porta hepatis, distinta da vesícula biliar. O exame pode evidenciar comunicação direta entre o ducto hepático comum e o ducto cístico. Por outro lado, se a estrutura cística apresenta-se à ultrassonografia em uma imagem inicial, devem ser realizados exames com medicina nuclear, no período neonatal, para verificar se a estrutura cística comunica-se com a árvore biliar e determinar a presença de obstrução distal (Haller, 1991). 4.1.7 DIAGNÓSTICO NEONATAL O diagnóstico pode ser firmado por ultrassonografia ou por cintigrafia hepatobiliar, tanto para cistos de colédoco isolados como para aqueles associados à 51 atresia biliar extra-hepática. A visualização da radioatividade no intestino exclui atresia biliar enquanto que a não visualização significa estase biliar ou ausência de comunicação da árvore biliar com o trato intestinal (Haller, 1991). Atualmente, o padrão-ouro para diagnóstico e estadiamento do cisto de colédoco é a colangeopancreatografia por ressonância magnética, método não invasivo que possibilita identificar com segurança anatomia, tamanho, localização e forma da dilatação do ducto biliar, detectar junção pancreatobiliar sem risco de pancreatite ou colangite que pode ocorrer na colangeopancreatografia endoscópica retrógrada (Mabrut et al., 2010). Clinicamente, os sintomas e sinais são indistinguíveis daqueles encontrados na atresia biliar, exceto pela possibilidade de palpação de uma massa no lado direito do abdômen, sugestiva de cisto de colédoco. Outros sintomas como vômito, febre e dor abdominal com hiperamilasemia, são infrequentes e a icterícia não se manifesta antes da primeira a terceira semana de vida (Besner, et al., 2008). 4.1.8 ASSISTÊNCIA NEONATAL O tratamento cirúrgico do cisto de colédoco deve ser feito logo após o nascimento, porque o retardo pode resultar em cirrose com hipertensão portal, colangite, litíase hepático-colédoco, cirrose biliar e pancreatite na criança, bem como adenocarcinoma no adulto (Haller, 1991). Embora seja considerado muito raro, há relato de perfuração espontânea de cisto de colédoco, com peritonite biliar secundária, cuja etiologia é obscura na maioria dos casos, ocorrendo antes dos quatro anos de idade e, em média, aos 22 52 meses de idade (Besner et al., 2008). Nyamannawar e Das (2007) consideram que a descompressão cística intra-útero não é um procedimento seguro, dada a possibilidade de peritonite biliar. Recomendam o procedimento cirúrgico após estabilização do quadro clínico do neonato. 4.2 Atresia biliar 4.2.1 DEFINIÇÃO A atresia biliar é uma colangiopatia obliterativa, inflamatória, destrutiva, que afeta extensões variáveis dos ductos biliares extra e intra-hepáticos, exclusivamente em neonatos, já que em adultos e crianças não há processo patológico análogo (Nakanuma et al., 1997). A obliteração, não associada a cálculo, neoplasia ou ruptura, promove obliteração extra-hepática fibrosa, ductopenia dos ductos biliares intra-hepáticos e cirrose biliar (Kahn, 2004), levando a óbito à idade de dois anos, se o tratamento não for instituído a tempo (Hartley, Davenport, Kelly, 2009) (Figura 14). Essa anomalia se constitui na principal causa de transplante hepático e responde por 75% desse procedimento em menores de dois anos de idade (Hartley, Davenport, Kelly, 2009; Kahn, 2004). 53 Figura 13 – Desenhos de atresia biliar fetal Legenda: A – obliteração do ducto colédoco, com dilatação, a jusante, dos ductos hepáticos e da vesícula biliar. B – presença de duplicação da vesícula biliar Fonte: Langman (1985) 4.2.2 INCIDÊNCIA A incidência da atresia biliar sofre grandes variações na literatura. Kahn (2004) refere ser uma anomalia rara com taxa de incidência de 1 para 8.000 a 18.000 nascidos vivos, sem predominância por sexo em indivíduos da raça branca, mas com maior incidência no sexo feminino, na raça amarela. Hartley, Davenport e Kelly (2009), em revisão da literatura do período de 1948 a 2009, referem taxa de incidência de 1:17.000 a 19.000 nascidos vivos, na França e no Reino Unido; 1:15.000, no sudeste dos Estados Unidos da América; 1:19.000, na Holanda, e 1:5.000, nos países do leste asiático. Embora a anomalia possa ocorrer em indivíduos de todas as raças, esses autores referem que pesquisa realizada nos Estados Unidos permitiu concluir que mulheres negras têm chance duas a cinco vezes maior de parir neonatos atrésicos, quando comparadas a mães brancas. 54 4.2.3 CLASSIFICAÇÃO Kahn (2004) e Chardot (2005) referem o critério classificatório relativo ao período em que a anomalia ocorreu, cujas características estão apresentadas no Quadro 5. Características diferenciais Incidência Época do insulto Icterícia Período de ocorrência da anomalia Perinatal ou não Fetal ou síndrômica síndrômica 10% a 25% Comum antenatal perinatal precoce, sem interrupção após icterícia neonatal tardia, após a segunda semana de vida Infecção Apoptose ou necrose Fatores patogênicos celular fibrose Quadro 5 – Características diferenciais entre atresia biliar fetal e perinatal Fonte: Adaptado de Kahn (2004) e Chardot (2005) Alterações genéticas Mal formação da placa ductal Atualmente, a atresia biliar é classificada morfologicamente em três graus, com incidências variáveis. O tipo I corresponde a 5% dos casos e consiste na patência luminal até o ducto biliar comum e o ducto biliar cístico, podendo estar associado a um elemento cístico proximal; o tipo II, presente em aproximadamente 2% dos casos, tem patência até o ducto hepático comum, e o tipo III, identificado em mais de 90% dos casos, apresenta a parte mais proximal do trato biliar, junto à porta hepática, completamente sólida, não havendo qualquer visualização de ductos à ultrassonografia (Figura 15) (Sinhá ,Davenport, 2008). 55 Tipo I Obstrução ao nível do ducto biliar comum Tipo II Obstrução ao nível do ducto hepático comum Tipo III Obstrução ao nível da porta hepatis Figura 14 – Representação esquemática dos tipos de atresia biliar Fonte: Adaptado de Sinhá e Davenport (2008) Chardot (2005), membro do Comitê Inglês de Estudo de Atresia Biliar, explica que essa gradação é empregada no Japão, Estados Unidos da América e Reino Unido, mas, na França, há um sistema no qual se admitem quatro graus anatômicos, porque o grau III é subdividido em tipo 3, com incidência de 19%, no qual estão patentes a vesícula biliar e os ductos cístico e biliar comum, e tipo 4, identificado em 72% dos casos, no qual há atresia biliar extra-hepática completa. 4.2.4 ETIOPATOGENIA A etiopatogenia da atresia biliar tem se modificado ao longo do tempo. Inicialmente foi considerada uma malformação congênita, para, posteriormente, ser considerada uma anomalia adquirida, mas, atualmente, se admite não ser uma entidade única e, sim, a expressão fenotípica de diferentes insultos (Kahn, 2004). 56 Parece ser de natureza multifatorial, tendo por resultado final comum a colangiopatia obliterativa (Hartley, Davenport, Kelly, 2009). Embora não se possam precisar as causas da atresia biliar, admitem-se diversos fatores possíveis, genéticos, infecciosos, inflamatórios e mesmo tóxicos, como ilustrado na Figura 6, os quais podem variar conforme a fase embriológica em que a atresia ocorre (Figura 16). Anomalia do desenvolvimento do ducto biliar Precoce (1º trimestre) Tardio (2º trimestre) Síndrome de atresia biliar com malformação esplênica Atresia biliar isolada Possibilidade de ação de fatores genéticos Fatores maternos predisponentes (diabetes) Anomalia com ductos biliares extra-hepáticos normais Possível desregulação imunológica Possível susceptibilidade genética Hiperfunção de genes próinflamatórios Virose hepatotrófica perinatal Figura 15 – Possíveis relações causais da atresia biliar Fonte: Adaptado de Hartley, Davenport e Kelly (2009) Alguns autores afirmam que nas anomalias fetais, já se têm identificados casos com associação de atresia biliar e mutações gênicas, como por exemplo: no gene Kartagener (associado ao situs inversus), no gene CFC1 (responsável pela regulação axial direita-esquerda na embriogênese, podendo promover poliesplenia, isomerismo pulmonar e topografia gástrica à direita), bem como no gene JAG1 (responsável pela diferenciação celular e pela morfogênese). A mutação no gene 57 JAG1 é aquela para a qual se tem maior número de evidências: está presente na Síndrome de Alagille; tem sido comprovada por reação de cadeia de polimerase, como também por imunoistoquímica no epitélio de ductos biliares e em hepatócitos de recém-nascidos atrésicos (Kahn, 2004). O papel das viroses na atresia biliar tem sido exaustivamente estudado, incluindo citomegalovírus, vírus sincicial respiratório, vírus Epstein-Barr, papiloma vírus humano, vírus da hepatite, reovírus tipo 3 e rotavírus tipos A e C, mas sua ação é controversa, apesar de a presença viral poder atuar facilitando mau prognóstico (Sinhá, Davenport, 2008). Quanto à desregulação de genes pró-inflamatórios ou desregulação do sistema imunológico, as pesquisas indicam a possibilidade da superexpressão da interferona gama e da expressão de gens imunorreguladores no início da obstrução do ducto biliar, mas não há evidências suficientes para conclusão (Chardot, 2005; Hartley, Davenport, Kelly, 2009). 4.2.5 ANOMALIAS ASSOCIADAS A atresia biliar, em 20% dos casos está associada a outras anormalidades anatômicas congênitas, sendo a mais comum a síndrome da má formação esplênica (por poliesplenia, asplenia ou duplicação esplênica, presente em 100% dos casos), associada a situs inversus, em 37% dos casos, veia porta pré-duodenal, acometendo 40% dos neonatos, má rotação intestinal, em 60% dos casos, ausência de veia cava inferior (incidindo em 70%), defeitos septais atriais e ventriculares, bem como hipoplasia do coração esquerdo e pâncreas anular (Hartley, Davenport, Kelly, 58 2009). Além dessas malformações, outros autores referem a trissomia dos cromossomos 18 ou 21 e a Síndrome de Turner, anormalidades renais e do trato urinário em 59% dos casos. 4.2.6 DIAGNÓSTICO PRÉ-NATAL O diagnóstico pré-natal permanece uma condição excepcional. Nas atresias dos tipos I e II, que são raras, pode se suspeitar nas imagens ultrassonográficas, quando é visualizada uma estrutura cística no hilo hepático. Nesses casos, o exame pós-natal deve ser feito com brevidade já que a forma cística da atresia biliar é uma urgência cirúrgica, enquanto que para o cisto de colédoco, o procedimento pode ser postergado (Chardot, 2005). No início da gravidez, ou seja, até 16ª semana gestacional, a não visualização da vesícula biliar fetal pode estar associada a anomalias fetais severas, incluindo síndromes de polimalformação, aberrações cromossômicas e fibrose cística, exigindo investigação por amniocentese. Pode também a vesícula biliar ser visualizada tardiamente na gravidez, o que sugere um retardo em seu processo de recanalização. Nesses casos, se a vesícula permanecer indetectável por imagem após o nascimento, a hipótese diagnóstica de atresia biliar deve ser cuidadosamente investigada (Sinhá, Davenport, 2008; Roskams, Desmet, 2008;). A síndrome da malformação esplênica associada à atresia biliar deve ser investigada, porque pode ser diagnosticada à ultrassonografia antenatal. Essa recomendação é importante dada sua associação a cardiopatias e malformação de veia cava inferior, a qual pode ser uma entidade isolada e benigna (Chardot, 2005). 59 4.2.7 DIAGNÓSTICO NEONATAL A atresia biliar, logo após o nascimento, apresenta-se tipicamente com icterícia persistente, acolia fecal e hiperbilirrubinúria, em neonatos com peso ao nascer normal. Todos os recém-nascidos a termo que permanecem ictéricos após 14 dias e os pré-termos, após 21 dias, devem ser investigados para doença hepática, inicialmente com a avaliação da bilirrubinemia total e conjugada. Aqueles com icterícia fisiológica ou derivada do aleitamento apresentam aumento da concentração sérica da bilirrubina não conjugada, enquanto que a forma conjugada aumenta na icterícia secundária à maior parte das doenças hepáticas. Se houver esplenomegalia de apresentação tardia, é um indicativo de hipertensão portal (Maisels, 2006). Outros exames laboratoriais podem ser solicitados, como a gamaglutamiltransferase sérica, cuja concentração é maior na atresia biliar do que em outras causas de colestase neonatal, especialmente quando correlacionada com a idade. Além disso, nesses casos a trigliceridemia estará normal, mas associada à hipercolesterolemia (Hartley, Davenport, Kelly, 2009; Sinhá, Davenport, 2008). Além dos dados laboratoriais, os seguintes métodos diagnósticos podem ser utilizados (de Bruyne et al., 2010): a) ultrassonografia hepática, após 12 horas de jejum com infusão endovenosa de dextrose – suspeita-se de atresia biliar quando a vesícula está contraída, apesar do jejum, quando o hilo hepático mostra-se hiperecóico ou quando há um cisto no hilo hepático. Nos casos de atresia biliar fetal, o recém-nascido 60 pode apresentar outras anomalias, como: poliesplenia, ausência de veia cava retro- hepática ou situs inversus abdominal; b) colangiografia – indicada para análise de morfologia e patência da árvore biliar, quando a vesícula biliar parece normal na imagem por ultrassonografia. Pode ser realizada via percutânea por punção da vesícula biliar, endoscopicamente ou a céu aberto; c) biópsia hepática – os achados histológicos sugestivos de atresia biliar são proliferação ductular, obstrução biliar, edema ou fibrose portal, bem como pode estar presente a transformação de células gigantes, como em qualquer causa de colestase neonatal; d) uso de sonda nasoduodenal – muito empregada nos centros japoneses e chineses, alcançando o terço superior do duodeno, o que possibilita aspiração contínua para identificação de bile, cuja simples presença indica não ser necessária cirurgia. Aspirado claro e secreção intestinal não corada por bile, colhida por mais de 24 horas, é sugestiva de atresia biliar (Hartley, Davenport, Kelly, 2009). Esses exames devem ser solicitados com prudência para que permitam diagnóstico diferencial, especialmente com Síndrome de Alagille, colangite esclerosante de início neonatal, deficiência de alfa-1-antitripsina, fibrose cística e, mais raramente, colestase intra-hepática familiar progressiva (Chardot, 2005). 61 4.2.8 ASSISTÊNCIA NEONATAL Atualmente não se dispõe de conduta pré-natal para atresia biliar, envolvendo o manejo terapêutico cirúrgico, em dois passos. Em primeiro lugar faz-se uma portoenterostomia, tal como descrita por Kasai, em 1950, no período neonatal, na tentativa de restaurar o fluxo biliar. Em crianças para as quais não se obteve sucesso com a cirurgia de Kasai, e para aquelas com complicações de cirrose biliar, está indicado o transplante de fígado. Apesar disso, os estudos publicados entre 1999 e 2008 apresentam resultados pouco alentadores, conforme se apresenta na Figura 18. Atresia biliar isolada (± 90%) Síndrome de má formação esplênica com atresia biliar (± 10%) ± 2% Portoenterostomia > 90% ± 5% Transplante primário de Kasai de fígado (± 5%) Morte sem intervenção atribuída a outras anormalidades 5 % -10% Morte pós-operatória 50% Morre aguardando transplante 5% Transplante secundário de fígado Vivos sem transplante (± 50%) 5 % -10% Vivos com transplante (> 90%) Figura 16 – Resultados de sobrevida de neonatos com atresia biliar baseados no registro de atresia biliar do Reino Unido (1999 – 2008) Fonte: Hartley, Davenport e Kelly (2009) 62 4.3 Litíase biliar 4.3.1 DEFINIÇÃO A litíase biliar ou colelitíase consiste na presença de cálculos no interior da vesícula biliar ou nos ductos biliares (Stringer et al., 1996) (Figura 17). Figura 17 – Ultrassom demonstrando feto com vesícula biliar repleta de cáculos. Fonte: Portal São Francisco (2011) 4.3.2 INCIDÊNCIA Antes de 1980, poucos casos eram relatados de colelitíase em neonatos ou crianças e estavam associados à anemia hemolítica. Com o aumento do uso do ultrassom abdominal, esses diagnósticos tornaram-se mais frequentes, com prevalência em crianças entre 0,13% e 0,5% (Boëchat et al., 2007). A incidência da colelitíase em recém-nascidos tem sido atribuída a prematuridade, nutrição parenteral, jejum prolongado, ressecção ileal, desidratação, fototerapia, anomalias congênitas do trato biliar, sepses, doenças hemolíticas, 63 terapia com furosemida, pseudo-hipoaldoesteronismo e antibioticoterapia, particularmente com ceftriaxona. Apesar disso, um percentual significante de recémnascidos com litíase biliar não apresenta fatores predisponentes e, no mínimo em alguns casos, os cálculos biliares têm origem fetal (Bor et al., 2004). Uma pesquisa sobre colelitíase apontou incidência de 0,39%, incluindo fetos sem fator predisponente, associado à ausência de fatores obstétricos (Agnifili et al., 1998). Friesen e Roberts (1989) analisaram 693 casos de colelitíase sintomática, publicados na literatura, bem como 35 casos por ele operados no período de sete anos e declararam incidência de 1:1000 nascidos vivos e chamaram a atenção para a raridade dessa ocorrência. Boëchat et al. (2007), investigando, por ultrassonografia abdominal, 547 crianças com síndrome de Down, com idade entre um e três dias de vida, referiram incidência de 9,1% e recomendaram esse exame para neonatos com Síndrome de Down, mesmo em ausência de outro fator de risco associado. 4.3.3 ETIOPATOGENIA A formação de cálculos biliares no período pré-natal tem sido pouco referida na literatura e os poucos casos estão associados a anemia hemolítica e anormalidades estruturais do trato biliar, os quais predispõem à formação de cálculos devido a estase. Nos casos em que a anomalia do trato biliar leva à redução do lúmen dos ductos, pode ocorrer a formação de rolha biliar, que consiste na obstrução mecânica do ducto biliar comum bloqueando as secreções biliares, mas tendem à resolução espontânea (Haller, 1991). 64 Outro fator que pode levar à formação de cálculo biliar é a doença de Caroli, que consiste na má formação biliar associada a uma dilatação cística generalizada dos ductos intra-hepáticos (classificada como forma pura ou tipo I), mas não à fibrose hepática congênita, classificada como tipo II (Haller, 1991). A infecção da vesícula biliar por Escherichia coli tem sido associada à formação de cálculos biliares devido à produção de beta-glicuronidase pela bactéria, resultando no aumento da saturação da bile por hidrólise do diglicuronato de bilirrubina à forma não conjugada ou monoconjugada, o que favorece a formação de bilirrubinato de cálcio (Citak et al., 2001). Tal como na infecção por Escherichia coli, a infecção por Streptococcus B pode causar edema do canal hepático comum e do cístico, gerando retardo do débito biliar (Alissa et al., 1996). 4.3.4 ANOMALIAS ASSOCIADAS A litíase biliar pode estar associada à atresia biliar tipos I e II, doença de Caroli dos tipos I e II, como também à síndrome de Down, conforme demonstrado em diversas séries, para a qual tem sido sugerida como causa uma hipercolesterolemia durante a vida intrauterina (Boëchat et al., 2007; Bocconi et al., 1997), mas há relatos de fetos sem alterações da árvore biliar e com presença de lama biliar ou mesmo cálculos biliares em ausência de fatores predisponentes (Stringer et al., 1996). A presença de colelitíase tem sido implicada na formação de cisto de colédoco, perfuração, dano hepático ou pancreatite (Haller, 1991). 65 4.3.5 DIAGNÓSTICO PRÉ E PÓS-NATAL É feito por exame ultrassonográfico no qual se observa material ecogênico no interior da vesícula biliar, predominantemente após a trigésima semana gestacional, independente da história de litíase biliar materna (Haller, 1991; Stringer et al., 1996). Gertner e Farmer (2004) relataram um caso de litíase biliar em um neonato de 16 dias de vida, diagnosticado por imagem ultrassonográfica que não evidenciava estenose pilórica ou colelitíase. O diagnóstico foi firmado após dois exames ultrassonográficos quando observaram dilatação ductal intra-hepática, dificuldade de visualização do ducto comum e presença de cálculos pequenos, múltiplos em vesícula biliar, descrição comum a outros trabalhos (Alissa et al., 1996; Citak et al., 2001; Haller, 1991). 4.3.6 ASSISTÊNCIA NEONATAL A litíase biliar neonatal frequentemente é assintomática e, por esse motivo, quando diagnostica no período intra-útero exige monitoramento do neonato porque os cálculos biliares podem ter resolução espontânea durante um período de semanas a meses. Em ausência de sintomas, a conduta mais indicada é o acompanhamento, não devendo haver procedimento agressivo apenas baseado no diagnóstico da presença de litos biliares (Alissa et al., 1996; Citak et al., 2001). 66 5 CONSIDERAÇÕES FINAIS Ao final dessa revisão da literatura, que incluiu trabalhos clássicos bem como aqueles recentemente publicados, dois aspectos merecem destaque. O primeiro é a necessidade do conhecimento detalhado da embriologia de formação do fígado, de suas estruturas vasculares e da vesícula biliar, para propiciar o diagnóstico mais seguro por imagem. O segundo aspecto, extremamente relevante, é a importância que esses exames de imagem vêm ganhando ao longo do tempo pela evolução tecnológica, e mais recentemente, das Ciências da Computação. Considerando que o tratamento das anomalias congênitas de fígado e vesícula biliar depende primordialmente de uma visualização segura, é de se esperar no futuro que a reconstrução gráfica tridimensional permita o avanço do tratamento, bem como a compreensão dessas injúrias. Espera-se também, no futuro, que iniciativas como as referidas em Boston, sejam incentivadas para a criação de bancos de dados sobre anomalias congênitas, permitindo avaliar aspectos como detalhes de topografia, incidência e prevalência. 67 6 REFERÊNCIAS BIBLIOGRÁFICAS ACHIRON, R.; GINDES, L.; KIVILEVITCH, Z.; KUINT, J.; KIDRON, D.; BOYANOVERJ; Y; et al. Prenatal diagnosis of congenital agenesis of the fetal portal venous system. Ultras Obstet Gynecol, v. 34, p. 643-652, 2009. AGNIFILI, A.; GOLA, P.; MARINO, M.; MANCINI, E; VERZARO, R; LOTTI, R; et al. Billiary lithiasis in childhood. A spectrum of diseases with different clinical significance during featal life, childhood and adolescence. Minerva Pediatr, v. 50, p 127-136, 1998. ALISSA, K.; SAUNIER, P.; RUSSO, M.; VEDRENNE, J. Lithiase cholestatique néonatale associée à une infection à colibacilles. Arch Pédiatr Paris, v. 3, p. 144146, 1996. ALONSO-LEJ, F.; REVER, W. B. PESSAGNO, D. J. Congenital choledochal cyst, with a report of 2, and an analysis of 94 cases. Int Abstr Surg, v. 108, n. 1, p. 1-29, p. 1-30, 1959. BABBITT, D. P.; STARSHAK, R. J.; CLEMENT, A. R. Choledochal cyst: a concept of etiology. AJR, v. 199, p. 57-62, 1973. BELUFFI, G.; VIVARELLI, M.; MONGINI, M. E.; CHIARA, A. Hepatic calcification following umbilical vein catheterization in a premature baby. Eur Radiol, v. 14, p. 1320–1321, 2004. BESNER, G. E.; PADDOCK, H. N.; NGUYEN, L. T.; KAY, S. M. Choledochal cyst, surgical treatment. Emedicine, sep 30, 2008. Disponível em: http://emedicine.medscape.com/article/934267-print. Acesso em: 24/01/2011. 68 BOCCONI, L.; NAVA, S.; FOGLIANI, R.; NICOLINI, U. Trisomy 21 is associated with hypercholesterolemia during intrauterine life. Am J Obstet Ginecol, v. 176, n. 3, p. 540-543, 1997. BOËCHAT, M. C.; SILVA, K. S.; LLERENA JR, J. C.; BOËCHAT, P. R. M. Cholelithiasis and billiary sludge in Down’s syndrome patients. São Paulo Med J, v. 125, n. 6, p. 329-332, 2007. BOR, O.; DINLEYICI, E. C.; KEBAPCI, M.; AYDOGDU, S. D. Ceftriaxone-associated biliary sludge and pseudocholelithiasis during childhood: a prospective study. Pediatr Int, v. 46, p. 322-324, 2004. BRONSHTEIN, M.; BLAZER, S. Prenatal diagnosis of liver calcifications. Obst Ginecol, v. 86, n. 5, p. 739-743, 1995. BRONSHTEIN, M.; NIZAR, K.; WEINER, Z. Significance of early prenatal diagnosis of fetal hepatic cyst. J Clin Ultras, v. 37, n. 2, p. 65-68, 2009. CHAN, K. W.; LEE, K. H.; TAM, Y. H.; YEUNG, C. K. Minimal invasive surgery in pediatric solid tumors. J Laparoendoscopic Advanced Surg Tec, v. 17, n. 6, p. 817-820, 2007. CHARDOT, C. Biliary atresia. Orphanet encyclopedia, oct 2005. 15p. Disponível em: http://www.orpha.net/data/pathc/GB/uk-Biliary/Atresia.pdf. CHARLESWORTH, P.; ADE-AJAYI, N.; DAVENPORT, M. Natural history and longterm follow-up of antenatally detected liver cysts. J Pediat Surg, v. 42, p. 494-499, 2007. CHRISTISON-LAGAY, E. R.; BURROWS, P. E.; ALOMARI, A.; DUBOIS, J.; KOZAKEWICH, H. P.; LANE, T. S.; et al. Hepatic hemangiomas: subtype 69 classification and development of a clinical practice algorithm and registry. J Pediatr Surg, v. 42, p. 62-68, 2007. CITAK, E. Ç.; ERGENEKON, E.; ALPASLAN, H. F.; ATALAY, Y.; KOÇ, E.; ZENGIN, A. Asymptomatic neonatal cholelithiasis. Indian J Pediatr, v. 68, n. 1, p. 91-93, 2001. COLLARDEAU-FRACHON, S.; SCOAZEC, JY. Vascular development and differentation during human liver organogenesis. Anat Rec, v. 291, p. 614-627, 2008. DE BRUYNE, R.; VAN BIERVLIET, S.; VANDE VELDE, S.; VAN WINCKEL, M. Neonatal cholestasis. Eur J Pediatr (online), 2010. DELEVE, L. D.; VALLA, D. C.; GRACIA-TSAO, G. G. Vascular disorder of the liver. Hepatol, v. 49, n. 5, p. 1729-1764, 2009. FASOULIOTIS, S. J.; ACHIRON, R.; KIVILEVITCH, Z.; YAGEL, S. The human fetal venous system. Normal embryologic, anatomic, and physiologic characteristics and developmental abnormalities. J Ultrasound Med, v. 21, p. 1145-1158, 2002. FLORIO, F.; NARDELLA, M.; BALZANO, S.; GIACOBBE, A.; PERRI, F. Congenital intrahepatic portosystemic shunt. Cardiovasc Intervent Radiol, v. 21, p. 421-424, 1998. FOLEY, P.T.; SITHASANAN, N.; MCEWING, R.; LIPSETTC, J.; FORDA, W. D. A; FURNESS, M. Enteric duplications presenting as antenatally detected abdominal cysts. Is delayed resection appropriate? J Pediatr Surg, v. 38, n. 12, p. 1810-1813, 2003. FRIESEN, C.; ROBERTS, C. C. Cholelithiasis: clinical characteristics in children. Clin Pediatr, v. 28, p. 294-298, 1989. 70 FUCHS, J.; WARMANN, S. W.; SIEVERDING, L.; HABER, H. P.; SCHÄFER, J.; SEITZ, G.; et al. Impact of virtual imaging procedures on treatment strategies in children with hepatic vascular malformations. JPGN, v. 50, n. 1, p. 67-73, 2010. FUJISHIRO, J.; IWANAKA, T.; ARAI, M.; KAWASHIMA, H.; KUDOU, S.; IMAIZUMI, S.; et al. Disappearing cyst of the hepatic hilum in uncorrectable biliary atresia. Pediatr Surg Int, v. 21, p. 116-118, 2005. GALLEGO, C.; MIRALLES, M.; MARÍN, C.; MUYOR, P.; GONZÁLEZ, G.; GARCÍAHIDALGO, E. Congenital hepatic shunts. RadioGraphics, v. 24, p. 755-772, 2004. GERTNER, M.; FARMER, D. L. Laparoscopic cholecystecomy in a 16-day-old infant with chronic cholelithiasis. J Pediatr Surg, v. 39, n. 1, p. 17-19, 2004. GOW, K. W.; LEE, L.; PRUTHI, S.; PATTERSON, K.; HEALEY, P. J. Mesenchymal hamartoma of the liver. J Pediat Surg, v. 44, p. 468-470, 2009. HACKMON-RAM, R.; WIZNITZER, A.; GOHAR, J.; MAZOR, M. Prenatal diagnosis of a fetal abdominal cyst. Eur J Obstet Gynecol Reprod Biol, v. 91, p. 79-81, 2000. HALLER, J. O. Sonography of the biliary tract in infants and children. AJR, v. 157, p. 1051-1058, 1991. HARTLEY, J. L.; DAVENPORT, M.; KELLY, D. A. Biliary atresia. Lancet, v. 374, p. 1704-1713, 2009. HAWASS, N. D.; BADAWI, M. G.; FATANI, J. A.; AL-MESHARI, A.; MAKANJOULA, D.; EDRESS, Y. B. Fetal hepatic calcification. Pediatr Radiol, v. 20, p. 528-535, 1990. ISAACS JR, H. Fetal and neonatal hepatic tumors. J Pediatr Surg, v. 42, p. 17971803, 2007. 71 KAHN, E. Biliary atresia revisited. Ped Develop Pathol, v. 7, p. 109-124, 2004. KAMISAWA, T.; TAKUMA, K.; ANJIKI, H.; EGAWA, N.; KURATA, M.; HONDA, G.; et al. Pancreaticobiliary maljunction. Clin Gastroenterol Hepatol, v. 7, p. S84-S88, 2009. KESLAR, P. J.; BUCK, J. L.; SELBY, D. M. From the archives of the AFIP. Infantile hemangioendothelioma of the liver revisited. Radiographics, v. 13, p. 657-670, 1993. KISERUD, T.; ACHARYA, G. The fetal circulation. Prenat Diagn, v. 24, p. 10491059, 2004. KITANO, Y.; RUCHELLI, E.; WEINER, S.; et al. Hepatic mesenchymal hamartoma associated with mesenchymal stem villous hyperplasia of the placenta. Fetal Diagn Ther, v. 15, p. 134-138, 2000. LABERGE, JM.; PATENAUDE, Y.; DESILETS, V.; CARTIER, L.; KHALIFE, S.; JUTRAS, L.; et al. Large hepatic mesenchymal hamartoma leading to mid-trimester fetal demise. Fetal Diagn Ther, v. 20, n. 2, p. 141-145, 2005. LANGMAN, J. Embriologia médica. 4. ed. São Paulo: Atheneu, 1985. 354p. LEE, M.; SZE, D. Y.; BONHAM, C. A.; DAUGHERTY, T. J. Hepatic arteriovenous malformations from hereditary hemorrhagic telangiectasia: treatment with liver transplantation. Dig Dis Sci, v. 55, p. 3059-3062, 2010. LU, X.; NOBLE, F.; YUAN, L.; JIANG, Q.; DE LAFARGE, B.; SUGIYAMA, D.; et al. The netrin receptor UNC5B mediates guidance events controlling morphogenesis of the vascular system. Nature, v. 432, p. 179-186, 2004. 72 MABRUT, JY, BOZIO, G.; HUBERT, C.; GIGOT, J. F. Management of congenital bile duct cysts. Dig Surg, v. 27, p. 12-18, 2010. MACKEN, M. B.; WRIGHT JR, J. R.; LAU, H.; COOPER, M. C.; GRANTMYRE, E. B.; THOMPSON, D. L.; et al. Prenatal sonographic detection of congenital hepatic cyst in third trimester after normal second-trimester sonographic examination. J Clin Ultras, v. 28, n. 6, p. 307-310, 2000. MAISELS, M. J. Neonatal jaundice. Pediatr Rev, v. 27, n. 12, p. 443-454, 2006. MASCARELLO, J. T.; KROUS, H. F. Second report os a translocation involving 19q13.4 in a mesenchymal hamartoma of the liver. Cancer Genet Cytogenet, v. 58, p. 141-142, 1992. MITTERMAYER, C.; BETTELHEIM, D.; HORCHER, E.; FAKHARI, M.; DEUTINGER, J.; BERNASCHEK, G. Prenatal sonographic detection of a giant multiseptate hepatic cyst in the third trimester. Ultras Obstet Gynecol, v. 20, n. 1, p. 97-98, 2002. NAGORNEY, D. M. Biliary and liver cysts. In: BLUMGART, L. H.; FONG, Y. Surgery of the liver and biliary tract. 3. ed. Londres: Saunders, 2000. NAKANUMA, Y.; HOSO, M.; SANZEN, T.; SASAKI, M. Microstructure and development of the normal and pathologic biliary tract in humans, including blood supply. Microsc Res Tech, v. 38, p.552-570, 1997. NGUYEN, D. LEONARD, J. C. Ischemic hepatic necrosis: a cause of fetal liver calcification. AJR, v. 147, p. 596-597, 1986. NYAMANNAWAR, B. M.; DAS, K. Spontaneous infantile choledochal cyst perforation. Indian J Pediatr, v. 74, p. 299-300, 2007. 73 OKEDA, R. Mesenchymal hamartoma of the liver-an autopsy case with serial sections and some comments on its pathogenesis. Acta Path Jpn, v. 26, p. 229-236, 1976. ONO, H.; MAWATARI, H.; MIZOGUCHI, N.; EGUCHI, T.; SAKURA, N. Clinical features and outcome of eight infants with intrahepatic porto-venous shunts detected in neonatal screening for galactosaemia. Acta Paediatr, v. 87, p. 631-634, 1998. RAKHEJA, D.; MARGRAF, L. R.; TOMLINSON, G. E.; SCHNEIDER, N. R. Hepatic mesenchymal hamartoma with translocation involving chromosome band 19q13.4: a recurrent abnormality. Cancer Genet Cytogenet, v. 153, p. 60-63, 2004. ROGERS, T. N.; WOODLEY, H.; RAMSDEN, W.; WYATT, J. I.; STRINGER, M. D. Solitary liver cysts in children: not always so simple. J Pediat Surg, v. 42, p. 333339, 2007. ROQUETE, M. L. V. Neonatal cholestasis. J Pediatr Rio de Janeiro, v. 76, Supl. 2, p. S187-S197, 2000. ROSKAMS, T.; DESMET, V. Embryology of extra- and intrahepatic bile ducts, the ductal plate. Anat Record, v. 291, p. 628-635, 2008. SAKURA, N.; MIZOGUCHI, N.; ONO, H.; NISHIMURA, Y.; NAITO, K. Congenital porto-systemic shunt as a major cause of galactosemia. Intern Pediatr, v. 16, n. 4, p. 206-210, 2001. SAXENA, A. K.; VON TUIL, C. Laparoscopic resection of solitary congenital liver cyst in a neonate. Surg Laparoscop Endoscop Percutan Tech, v. 16, n. 2, p. 99-101, 2006. SINHÁ, C. K.; DAVENPORT, M. Billiary atresia. J Indian Assoc Pediatr Surg, v. 13, n. 2, p. 49-56, 2008. 74 STRINGER, M. D. The clinical anatomy of congenital portosystemic venous shunts. Clin Anat, v. 21, p. 147-157, 2008. STRINGER, M. D.; LIM, P.; CAVE, M.; MARTINEZ, D.; LEEDS, R. J. L. Fetal gallstones. J Pediatr Surg, v. 31, n. 11, p. 1589-1591, 1996. TODANI, T. Congenital choledochal dilatation: classification, clinical features, and long term results. J Hepatobiliary Pancreat Surg, v. 4, p. 276-282, 1997. TSAO, K.; HIROSE, S.; SYDORAK, R.; et al. Fetal therapy for giant hepatic cysts. J Pediatr Surg, v. 37, p. E31, 2002. WAX, J. R.; BLACKSTONE, J.; PINETTE, M. G.; CARTIN, A. Hepatic vascular calcification: An early second trimester sonographic feature of idiopathic infantile arterial calcinosis. Obstet Gynecol, v. 185, p. 1267-1268, 2001. WAX, J. R.; GRIMES, C. K.; BLACKSTONE, J.; PINETTE, M. G.; CARTIN, A. Twoand three-dimensional prenatal sonographic diagnosis of hepatics cysts. J Clin Ultras, v. 37, n. 2, p. 96-99, 2009. WILLERT, J. R.; DAHL, G. Hepatoblastoma. eMedicine, 2010. Disponível em: http://emedicine.medscape.com/article/986802-print. Acesso em: 27/01/2011. WITTERS, P.; MALEUX, G.; GEORGE, C.; DELCROIX, M.; HOFFMAN, I.; GEWILLIG, M.; et al. Congenital veno-venous malformations of the liver: widely variable clinical presentations. J Gastroenterol Hepatol, v. 23, p. e390-e394, 2008. YAGEL, S.; KIVILEVITCH, Z.; COHEN, S. M.; VALSKY, D. V.; MESSING, B.; SHEN, O.; et al. The fetal venous system, Part II: ultrasound evaluation of the fetus with congenital venous system malformation or developing circulatory compromise. Ultrasound Obstet Gynecol, v. 36, p. 93-111, 2010.
Documentos relacionados
Hepatopatias na criança:
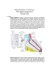 v. Defesa orgânica: Fagocitose pelos macrófagos dos sinusóides (células de Kupffer).
2. Diagnóstico das hepatopatias: Quais as dificuldades?: O fígado tem grande capacidade de
regeneração estrutura...
v. Defesa orgânica: Fagocitose pelos macrófagos dos sinusóides (células de Kupffer).
2. Diagnóstico das hepatopatias: Quais as dificuldades?: O fígado tem grande capacidade de
regeneração estrutura...








