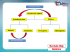
x H3O+ + - turmaoq2011
Transcrição
x H3O+ + - turmaoq2011
Tema: FUNÇÕES INORGÂNICAS - ÁCIDOS AULA: 05 VALOR: NOTA: NOME:...................................................................... Prof: ANDRÉ LUIS Data:............./.............../ 2011 ÁCIDOS CONCEITO: São compostos que em solução aquosa se + ionizam produzindo o cátion H3O Propriedades: (cátion hidrônio) A) Os ácidos reagem com as bases produzindo segundo Arrenhius. sal e água. ( Reação de neutralização ) Segundo Arrhenius, baseado em seu conceito Ex: sobre os ácidos, em geral todo ácido começa com H e HCl + + NaOH → NaCl H2O + em solução aquosa libera para o meio o cátion H . B) Reagem com os óxidos básicos produzindo Ex: HCl → H2O + + H3O + Cl - sal e água. Ex: FÓRMULA GERAL : H XA Onde: H = hidrogênio. 2 HCl + BaO → C) Os ácidos são A = ânion coloração X = NOX do ânion ou nº de carga do ânion. indicadores: Ex: Cátion + H → Radical aniônico Cl em BaCl2 + H2O caracterizados presença de pela certos - Fórmula do ácido: HCl Indicador Cor em meio básico Papel de tornassol Vermelho Fenolftaleína Incolor CLASSIFICAÇÃO DOS ÁCIDOS Os ácidos podem ser classificados em: D) Os ácidos fortes reagem com os carbonatos ( compostos que possuem o íon CO32- ) produzindo sal, gás carbônico e água. 1 – Hidrácidos: São ácidos não oxigenados. Ex: HCl , HBr, H2S Ex: 2 – Oxiácidos: São ácidos oxigenados. Ex: H2SO4, 2 HCl + CaCO3 → CaCl2 + H2CO3 HClO, H3PO4 , H2CO3 Obs: O H2CO3 decompõe-se em CO2 e H2O, logo a EQUAÇÃO GERAL DE IONIZAÇÃO DE UM ÁCIDO HXA + ( Ácido ) x H2O → x H3O+ + (cátion hidrônio ) A-x (ânion) equação acima fica: 2 HCl CaCO3 → CaCl2 + CO2 + H2O E) Os ácidos fortes reagem com metais não nobres produzindo sal e gás hidrogênio (H2). Ou, HXA ( Ácido ) + H 2O → + H (cátion ) + -x A (ânion) Ex: 6 HCl + 2 Al → 2 AlCl3 + 3 H2 ÂNIONS BIVALENTES EXERCÍCIOS SOBRE ÁCIDOS 1 – Conceituar e exemplificar: a) Ácido b) Hidrácido 2- CO3 → Carbonato c) Oxiácido S 2- → Sulfeto -2 SO3 2 – Escreva a equação de ionização dos seguintes ácidos: SO4 CrO4 a) HCl b) HBr c) H2S d) HF e) HBrO3 f) H2CrO4 g) HCl O4 e) HMnO4 → Sulfito -2 → Sulfato -2 → Cromato -2 Cr2O7 → Bicromato -2 MnO4 → Manganato NOMENCLATURA CLÁSSICA DOS ÁCIDOS Para escrever a fórmula de um ácido deve-se 3 – Qual o comportamento dos ácidos frente a: somar água ( H2O ) ao anidrido correspondente. O nome será o mesmo do anidrido substituindo-se a a) Carbonatos b) Fenolftaleína e papel tornassol palavra anidrido pela palavra ácido. c) Metais d) Óxidos básicos 1º Caso – ácidos de elementos que formam 1 anidrido CO2 e) Bases CrO3 TABELA DE ÂNIONS + + H2O H2O → H2CO3 → Ácido carbônico H2CrO4 Ácido crômico 2º Caso – ácidos de elementos que formam 2 anidridos. Caso dos elementos das colunas 4A, 5A e 6A ÂNIONS MONOVALENTES F- → Fluoreto - Cl → Cloreto SO2 + H2O → H2SO3 Ácido sulfuroso SO3 + H2O → H2SO4 Ácido sulfúrico - Br → Brometo - I → Iodeto - ClO → HipoClorito 3º Caso – ácidos derivados de anidridos formados por elementos da coluna 7A - ClO2 → Clorito ClO3- → Clorato - ClO4 → Perclorato Cl2O + H2O → H2Cl2O2 → HClO Cl2O3 + H2O → H2Cl 2O4 → HClO2 Ácido hipocloroso Ácido cloroso BrO → Hipobromito Cl2O5 + H2O → H2Cl 2O6 → HClO3 Ácido clórico BrO2 → Bromito Cl2O7 + H2O → H2Cl 2O8 → HClO4 Ácido perclórico BrO3 → Bromato BrO4- → Perbromato - 4º Caso – ácidos formados por anidridos do manganês - IO → Hipoiodito - IO2 → Iodito MnO2 + H2O → H2MnO3 Ácido manganoso IO3- → Iodato MnO3 + H2O → H2MnO4 Ácido mangânico IO4 → Periodato Mn2O7 + H2O → H2Mn2O8 → HMnO4 NO2 → Nitrito NO3- → Nitrato Ácido permangânico Obs: Todo elemento que tem NOX +7, formará compostos ( anidridos ou ácidos ), cujo nome leva o prefixo per. COMO DAR O NOME DE UM ÁCIDO 1) Calcule o NOX do elemento central. 2) Com o NOX do elemento central utilize critérios da nomenclatura dos anidridos trocando a palavra anidrido por ácido. Ex: HClO NOX do Cl = + 1 O anidrido correspondente é o hipocloroso, logo HClO será o Ácido hipocloroso. 3) Quando o ácido for um hidrácido ( ácido não oxigenado ) a correspondente terminação deve ser eto do substituída ânion pela terminação ídrico. Ânion correspondente é o Cl – ( Cloreto) Ex: HCl Ácido clorídrico EXERCÍCIOS SOBRE ÁCIDOS 01 – Dar o nome dos seguintes ácidos a) HF b) HClO c) HClO3 d) HBrO2 e) HIO f ) H2CO3 g) H2CrO4 h) H2SO4 i ) HIO2 j) HMnO4 l) HIO4 m) HBrO4 02 – Escreva a fórmula dos seguintes ácidos a) Ácido iodídrico b) Ácido bromídrico c) Ácido clorídrico d) Ácido sulfúrico e) Ácido perclórico f ) Ácido sulfuroso g) Ácido brômico h) Ácido nítrico i) Ácido hipobromoso j) Ácido cloroso l) Ácido nitroso m) Ácido iódico RASCUNHO
Documentos relacionados
Funções inorgânicas - Ácidos - Química para o Vestibular
 Podemos concluir que o ácido mais forte é:
a) HF
b) HCl
c) HCN
d) H2SO4
e) H3PO4
14. (FATEC) Dos ácidos abaixo, o mais fraco é
a) HI
b) HCl
c) HClO4
d) HClO3
e) H3BO3
15. (UECE) Considere os seguin...
Podemos concluir que o ácido mais forte é:
a) HF
b) HCl
c) HCN
d) H2SO4
e) H3PO4
14. (FATEC) Dos ácidos abaixo, o mais fraco é
a) HI
b) HCl
c) HClO4
d) HClO3
e) H3BO3
15. (UECE) Considere os seguin...
Exercícios sobre Ácidos
 b) ácido sulfúrico.
c) ácido fosfórico.
d) ácido carbônico.
e) ácido clorídrico.
05. (PUCPR) A fórmula estrutural:
b) ácido sulfúrico.
c) ácido fosfórico.
d) ácido carbônico.
e) ácido clorídrico.
05. (PUCPR) A fórmula estrutural: