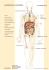Der Sentinel-Lymphknoten - Abteilung Nuklearmedizin
Transcrição
Der Sentinel-Lymphknoten - Abteilung Nuklearmedizin
Der Sentinel-Lymphknoten Universitätsmedizin Göttingen, Abteilung für Nuklearmedizin 1. 2. 3. 4. 5. Hintergrund Mammakarzinom Andere Tumorentitäten Probleme und Lösungen Fazit 1. Hintergrund Hintergrund • Der Begriff des Sentinel-Lymphknotens wurde erstmals 1977 von Cabanas im Zusammenhang mit Lymphabstromwegen beim Peniskarzinom eingeführt. • Mit Lymphangiographien fand er einen reproduzierbaren Lymphknoten inguinal an der Mündung zur Vena saphena magna, der zunächst als generelle Prädilektionsstelle für Metastasen des Peniskarzinomes galt • 1992 konnten Morton et al. Nachweisen, dass auch beim malignen Melanom eine lymphogene Metastasierung in spezifischen Lymphkntoen beginnt. Cabanas, RM. Cancer 39:456-66, 1977 Morton, DL et al., Arch Surg 127, 392-9 (1992) Hintergrund • Morton et al. definierten den Sentinel-Lymphknoten als den ersten bzw. vordersten drainierenden Lymphknoten eines malignen Tumors • Erste Arbeiten zum Sentinel-Lymphknoten des Mammakarzinoms stammen von Giuliano et al. und Krag et al. • Während Giuliano et al. Markierungen intraoperativ mit Patentblau durchführte, etablierten Krag et al. den Einsatz von 99mTc-Humanalbumin und die Verwendung einer Gammasonde Giuliano AE, et al. Ann Surg 220: 391-8 (1994) Krag DN et al., Surg Oncol 2:335-9 (1993) Hintergrund • Seit 1998 Evaluation der Sentinel-Lymphknotenszintigraphie beim Prostatakarzinom • Evaluation der Methode für weitere Tumore, z.B. Magenkarzinom, HNO-Tumore, etc. • Auf der internationalen Konsensuskonferenz in St. Gallen 2003 „Primary Therapy of Early Breast Cancer“ wurde die SentinelLymphknotenszintigraphie vom Panel als diagnostische Methode bei negativem Sentinel Node anerkannt. Definition Der Sentinel-Lymphknoten ist der erste Lymphknoten über den ein Primärtumor drainiert wird. Heidenreich P et al. Verfahrensanweisung für die nuklearmedizinische Wächter-Lymphknoten (sentinel lymph node; SLN) - Diagnostik. in Geworski L et al. Empfehlungen zur Qualitätskontrolle in der Nuklearmedizin. Schattauer (2003), S. 154-159. Die szintigraphische Festlegung der SLN geschieht nach folgenden Kriterien,wobei die Reihenfolge ihrer Wertigkeit entspricht: • • • • Erscheinungszeit Eigene Bahn(en) Anatomische Lage zum Tumor Relativer Uptake 2. Mammakarzinom Mammakarzinom Standardindikation (klinische Routine) Optionale Indikation (individuelle Entscheidung) Keine Indikation (außer klinische Studien) Kontraindikationen Unifokales MammaKarzinom ≤2cm Ausgedehntes DICS (Mastektomie erforderlich) Neoadjuvante Chemotherapie Primäre Operation T2-Tumore1 Sekundäre Operation nach brusterhaltendem Eingriff Multifokale Läsionen - Schwangerschaft - Unverträglichkeit des Tracers (CAVE! Human-Albumin!) - Multizentrizität - Entzündung - Ausgedehnte vorherige Brustoperationen - Vorangegangene Operation der Axilla - Klinische verdächtige axilläre Lymphknoten2 DICS: Ductales Carzinoma in situ 1: Individuelle Entscheidung nach Risiko für axilläre Beteiligung und persönliche Erfahrung (falsch-negativ-Rate) 2: Ultraschall der Axilla empfohlen, wenn die Lymphknotenstruktur erhalten ist: SLN-Biopsie möglich Kuehn T et al. A Concept for the Clinical Implementation of Sentinel Lymph Node Biopsy in Patients with Breast Carcinoma with Special Regard to Quality Assurance. Cancer 2005;103:451–61 Mammakarzinom Ablauf: Aufklärung und Einwilligung des Patienten BEVOR der Patient in der Nuklearmedizin erscheint. Der Patient muss vom untersuchenden Arzt über den Ablauf der Untersuchung, die Anzahl der Injektionen, den Gebrauch eines radioaktiven Tracers, über die Untersuchungszeiten und die Lagerung aufgeklärt werden. Der Patient muss den Oberkörper vollständig entkleiden. Mammakarzinom Notwendige klinische Informationen: • Anamnese, klinischer Befund, ggf. Ergebnisse bildgebender Untersuchungen des Lymphsystems, kürzlich applizierte andere Radiopharmaka • Lage, Größe und Art des Tumors, uni- oder multifokales Wachstum • Ergebnisse vorangegangener Biopsien, Operationen oder anderweitiger Manipulationen im Tumorbereich Mammakarzinom Notwendige klinische Informationen: • Vorangegangene Therapien (z.B. Strahlentherapie, Chemotherapie, Hormontherapie etc.) • Zusätzliche Erkrankungen des betreffenden Organs und/oder seiner Umgebung, welche den Lymphabstrom beeinflussen könnten (z.B. Entzündungen, Hämatome, andere Tumore) • Schwangerschaft, Laktation Mammakarzinom Lagerung: Der Patient liegt auf dem Rücken auf der Untersuchungsliege, der Arm der betroffenen Seite wird im 90°-Winkel ab gespreizt. Unter dem Patienten wird ein 57Co-Flächenphantom so platziert, dass die Konturen der Axilla der betroffenen Seite sichtbar werden (optional Markierung der Kontouren mit Hilfe einer gefüllten Aktivitätsspritze). Lagerung möglichst wie bei OP! Mammakarzinom Radiopharmakon: 99mTc-markierte Kolloide mit einer Partikelgröße von 20-100 nm und einem Injektionsvolumen von 0.2-1.0 ml werden verwendet (Markierung mit hoher spezifischer Aktivität). Effektive Äquivalentdosis: 0.46 - 0.92 mSv Spielt die Partikelgröße eine Rolle? Mammakarzinom Sato K, et al. Breast Cancer, 2004 Zink-Kolloid 100 nm vs. 700 nm Kleinere Partikel führen zu einem höheren kolloidalen Uptake in Sentinel-Lymphknoten. Ältere Patienten zeigen mehr Sentinel-Lymphknoten. Die Detektionsrate ist gleich. Marjut H, et al. Nucl Med Comm, 2004 Albu-Res vs. Nanocoll (<80 nm vs. 200-300 nm) Die Erfolgsrate scheint bei kleineren Partikeln größer zu sein. Mirzaei S, et al. Eur J Nucl Med, 2003 SentiScint (100-600 nm) Große Partikel führen zur Darstellung von nur 1-2 Sentinel Lymphknoten und erleichtern das intraoperative Auffinden. Mammakarzinom • Kleine Partikel (Kolloid < 50 nm): – Schnelle Migration in den Lymphbahnen – geringe Retention im Lymphknoten – Markierung einer großen Anzahl nachgeschalteter LK • Große Partikel (Kolloid > 300 nm): – Langsame Migration in den Lymphbahnen – hohe Retention im Lymphknoten – Geringe Markierung nachgeschalteter LK • Nanokolloid (20 nm bis 100 nm): – Ausreichend schnelle Migration in den Lymphbahnen – Ausreichend hohe Retention im Lymphknoten – Meist Markierung 2-5 nachgeschalteter LK Mammakarzinom 2-Tages-Protokoll Tumorlokalisation (Quadrant) Art der Injektion Anzahl der Injektionen Gesamtaktivität 12 Uhr-9 Uhr (oben innen, unten innen, unten außen) peritumoral und/oder subdermal, bzw. subareolär 4 150-250 MBq 9 Uhr-12 Uhr (oben außen) subareolär 1 160 MBq 1-Tages-Protokoll Tumorlokalisation (Quadrant) Art der Injektion Anzahl der Injektionen Gesamtaktivität 12 Uhr-9 Uhr (oben innen, unten innen, unten außen) peritumoral und/oder subdermal, bzw. subareolär 4 50 MBq 9 Uhr-12 Uhr (oben außen) subareolär 1 10-20 MBq * Bei ausschließlich subdermaler oder subareolärer Injektion ist die Darstellung parasternaler Lymphknoten nicht gewährleistet. Mammakarzinom Akquisition: Dynamische Aufnahmen des Thorax und der ipsilateralen Axilla von ventral über 10 Minuten (Beginn: Nach Injektion, 40 Frames a 15 sec., Matrix 128x128), danach Statische Aufnahmen des Thorax und der ipsilateralen Axilla in 2 Ebenen (Wiederholung 3h p.i.) (Aufnahmezeit 180 sec., Matrix 256x256) Mammakarzinom Mammakarzinom Mammakarzinom Mammakarzinom Verbesserung der Lokalisation möglich? Van der Ploeg IMC et al., World J Surg, 2008 Review SPECT/CT 4 Studien mit insgesamt 449 Patienten wurden eingeschlossen. 2 Studien mit T0-2N0M0 mit 74 bzw. 80 MBq 99mTc-rhenium und -nanocolloid 1 Studie mit übergewichtigen Patienten und 74 MBq 99mTcrhenium Kolloid 1 Studie mit Patienten bei denen kein Sentinel gefunden worden war oder der Sentinel in atypischer Lokalisation lag mit 120 MBq 99mTc-Nanocolloid Mammakarzinom Der Zugewinn der SPECT/CT ist schwer abzuschätzen, da verschiedene Methoden angewendet wurden und die Patienten sehr selektiert waren. SPECT/CT verbessert die präoperative Lymphszintigraphie und hat das Potential als klinische Routine etabliert zu werden, was zu einem besseren Staging bei Patienten mit Mammakarzinom führt. Aber: höhere Kosten und längere Untersuchungszeiten, da es zusätzlich zur konventionellen Diagnostik eingesetzt wird. Der Vorteil der SPECT/CT wird vor allem bei problematischen Fällen ausgenutzt 3. Andere Tumorentitäten Andere Tumorentitäten • • • • • • • • Malignes Melanom Peniskarzinom Prostatakarzinom Harnblasenkarzinom Hodentumore Vulvakarzinom HNO-Tumore Schilddrüsenkarzinom Malignes Melanom • Indikation: • Kutanes Melanom, Tumordicke nach Breslow >1mm (unabhängig vom Invasionsgrad nach Clark) Klinisch kein Hinweis auf Metastasen • Injektion von jeweils 50 MBq 99mTc-Nanokolloid am Resektionsrand bzw. am Tumorrand, intradermal in 2 Fraktionen mit jeweils 0,05-0,2 ml Volumen • Aufnahmeprotokoll wie beim Mammakarzinom, Patient wird jedoch bereits bei der Injektion unter der Kamera gelagert • Wahrscheinlich deutlicher Nutzen der SPECT/CT (z.B. illiakale Lymhknoten/Eröffung des Peritoneums) Malignes Melanom Malignes Melanom Malignes Melanom Peniskarzinom/Prostatakarzinom • Peniskarzinom: • Am Vortag der Operation: nach Lokalanästhesie peritumorale intradermale Injektion (4x) von 60-80 MBq 99mTc-Nanokolloid mit 0,2 ml Volumen • Aufnahmeprotokoll wie beim Malignen Melanom • Prostatakarzinom: • Am Vortag der Operation: unter sonographischer Kontrolle kapselnahe intraprostatische Injektion (1-3) von 200-300 MBq 99mTc-Nanokolloid mit 0,2 ml Volumen • Aufnahmen nach 2 h p.i. ohne Bleiabdeckung der Prostata, ggf. Fusion bei Einsatz von SPECT hilfreich Harnblasenkarzinom/Hodentumore • Harnblasenkarzinom: • Bisher nur 1-Tages-Protokoll veröffentlicht • In Narkose Injektion von 70 MBq 99mTc-Nanokolloid in 1 ml Volumen mit 1 ml Methylenblau vermischt, um den Tumor in den Detrusormuskel • Keine Bildgebung, aus dem Präparat werden die radioaktiven Lymphknoten entfernt und getrennt histologisch aufgearbeitet • Stand: Pilotstudie • Hodentumore: • Bislang nur in Japan, Pilotstudie Vulvakarzinom/HNO-Tumore • Vulvakarzinom: • Injektion von jeweils 50 MBq 99mTc-Nanokolloid am Resektionsrand bzw. am Tumorrand, intradermal in 2 Fraktionen mit jeweils 0,05-0,2 ml Volumen • Aufnahmeprotokoll wie beim Malignen Melanom • HNO-Tumore: • Injektion von jeweils 40-100 MBq 99mTc-Nanokolloid intramukosal bzw. peritumoral in 3-4 Fraktionen mit jeweils 0,05-0,2 ml Volumen, danach ausspülen der Mundhöhle • Aufnahmeprotokoll wie beim Malignen Melanom Schilddrüsenkarzinom Raijmakers PGHM et al., World J Surg (2008) Meta-Analyse • Meta-Analyse mit 14 eingeschlossenen Studien mit insgesamt 457 Patienten • 10 Studien (N=329 Pat.) mit Methylenblau • 4 Studien (N= 128 Pat.) mit 99mTc-Nanokolloid • Gepoolte Sentinel-Detektion: • Methylenblau: 83% • 99mTc-Nanokolloid: 96% • Injektion von 0,1-0,2 ml 99mTc-Nanokolloid mit 6,15 und 20 MBq (intratumoral, dynamische und statische Aufnahmen) • Injektion von 0,3 ml 99mTc-Nanokolloid mit 120 MBq (peritumoral, ultraschallkontrolliert, statische Aufnahmen) 4. Probleme und Lösungen Probleme und Lösungen • Problem: In den frühen Aufnahmen (bis 10 min. p.i., z.T. bis 30 min. p.i.) findet sich beim Mammakarzinom kein SentinelLymphknoten, während in den Aufnahmen bis 3h p.i. in der Regel mehrere Lymphknoten dargestellt werden können. • Lösung: Keine! Hier sollte darauf aufmerksam gemacht werden, dass formal der Sentinel-Lymphknoten nicht identifiziert werden kann. Die wahrscheinlichsten SentinelLymphknoten sollten allerdings markiert werden. • Vorschlag: Nach den frühen Aufnahmen sollte der Patient bis zu den späten Aufnahmen mit Wärme (Wärmflasche) und Massage, den Lymphabfluss anregen (CAVE! Verbrühung!) Probleme und Lösungen • Problem: Injektion des Radiopharmakons nach Stanze der Mamma mit konsekutivem Hämatom/Serom. • Lösung: Ggf. vorsichtig aspirieren. Sollte seröse Flüssigkeit aspirierbar sein, Injektion ggf. subareolär durchführen! • Erklärung: Wird das Radiopharmakon in ein Serom bzw. in die Nähe eines Seromes injiziert, so verhindert der hohe interstitielle Druck ein Abfließen über die Lymphgefäße Probleme und Lösungen • Problem: Bei subareolärer und subdermaler Injektion des Radiopharmakons stellen sich evtl. parasternale Lymphknoten nicht dar. • Lösung: Keine! • Erklärung: 90-95% der Lymphknotenmetastasen des Mammakarzinoms werden axillär gefunden. V.a. im Rahmen peritumoraler Injektionen kommt es in 10%-40% zur Anreicherung parasternaler Lymphknoten unabhängig von der Lokalisation des Tumors. Eine Entfernung evtl. in der Szintigrafie anreichernder parasternaler Lymphknoten wird nach aktueller Datenlage wegen geringer therapeutischer Relevanz und hoher Morbidität (Pneumothorax, Blutung aus Arteria Mammaria interna etc.) überwiegend nicht empfohlen. Probleme und Lösungen • Problem: Identifikation von cubitalen sowie poplietalen Sentinel-Lymphknoten des Malignen Melanomes (Gefahr von In-Transit-Metastasen!) bei Benutzung eines Flächenphantoms • Lösung: Grundsätzlich Anfertigung von Aufnahmen cubital und politeal OHNE Flächenphantom und aus dorsaler bzw. cubitaler Sicht! • Erklärung: Cubitale und polpliteale Lymphknoten können z.B. durch den Knochen und/oder das Phantom überlagert werden! • Ein „Landmarking“ mit z.B. 99mTc-DPD ist obsolet!!! Probleme und Lösungen Probleme und Lösungen • Problem: Injektion in der Ferse beim Malignen Melanom. Die Hornhautdicke verhindert einen Abfluss, bzw. macht eine Injektion z.T. unmöglich. • Lösung: Rücksprache mit dem Operateur! Ggf. Injektion in der nächstgelegenen „weichen“ Haut! • Erklärung: Injektionen in derbe Hautareale können durch den starken interstitiellen Druck zu einem Austreten des Radiopharmakons (CAVE! Kontamination!) führen. Injektion mit Hilfe einer MTRA durchführen, die nach der Injektion und vor dem herausziehen der Nadel aus dem Gewebe mit einem Tupfer kräftig drückt! 5. Fazit Fazit • Die Sentinel-Lymphknotenszintigraphie ist eine sehr sensitive Methode, die zu einer deutlichen Senkung der Komorbidität bei Mammakarzinom- und Malignen Melanom-Operationen beiträgt • Der Nutzen bezüglich der Verbesserung des Langzeitüberlebens mit Hilfe der Sentinel-Lymphknotenbiopsie ist bislang nicht ausreichend belegt • Wichtig ist vor allen Dingen die interdisziplinäre Zusammenarbeit und der enge Kontakt zu den Operateuren!