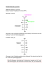Das lac-Operon von Escherichia coli als klassisches Beispiel für
Transcrição
Das lac-Operon von Escherichia coli als klassisches Beispiel für
Genetisches Grundpraktikum 7. Kurstag 09.06.05 Das lac-Operon von Escherichia coli als klassisches Beispiel für Genregulation Die Expression von Genen wird in den meisten Fällen auf der Transkriptionsebene reguliert. Im Prinzip gibt es zwei Mechanismen dieser Regulation. Bei der negativen Regulation wird die Transkription von einem Repressor verhindert, der entfernt werden muß, um die Genexpression zu ermöglichen. Bei der positiven Regulation wird die Transkription durch einen Aktivator ermöglicht, ohne den die Gene nicht oder nur in geringem Maße abgelesen werden. Beide Mechanismen können auch zusammenwirken. Dies ist bei der Regulation des lac-Operons in E. coli der Fall. p o lacI lacZ lacY lacA X X keine Transkription Repressor p o lacI lacY lacZ lacA Induktor löst Repressor ab, RNA-Polymerase bindet lacI p o lacY lacZ lacA RNA Transkription und Translation erfolgen: ß-Galaktosidase Permease Transacetylase Abbildung 1: Negative Regulation des lac-Operons Das lac-Operon (Abb. 1) ist eine Kette von drei Genen, lacZ, lacY und lacA, die gemeinsam abgelesen und reguliert werden. Vor der Gengruppe liegt der Promotor (p), das Erkennungssignal für die RNA-Polymerase. Er wird vom Operator (o) überlappt. Dies ist die Bindungsstelle des Repressors, eines negativ regulierenden Proteins. Es wird von einem nicht im Operon liegenden Gen lacI codiert. Der Repressor verhindert also die Transkription des Operons. Ein Induktor kann an den Repressor binden und ihn dadurch vom Operator entfernen. Dann wird das Operon transkribiert. Der Induktor ist ein kleines Molekül, das in der Regel vom Substrat abgeleitet ist, das von den im Operon codierten Enzymsystem verwertet wird. In unserem Fall ist das Substrat die Lactose, die durch das lacZ-Genprodukt, 7-1 die ß-Galactosidase, gespalten wird. Lactose im Medium führt tatsächlich zu einer Induktion des Operons. Dazu muß sie mit Hilfe eines Aufnahmeproteins, der Permease, dem Produkt des lacY-Gens in die Zelle transportiert werden. Fällt die Permease aus, kann das Operon nicht mehr durch Lactose induziert werden. Es gibt aber Induktoren, die Struturanaloga der Lactose sind, wie das IPTG, die ohne Permease in die Zelle gelangen und die Transkription induzieren. Die Funktion des dritten Gens, lacA, der sog. Transacetylase ist in unserem Zusammenhang uninteressant. Die Aufhebung der negativen Regulation des lac-Operons durch die Induktion reicht nicht zur vollen Expression. Das Operon ist außerdem abhängig von einer Aktivierung (Abb.2). Dazu muß der Aktivator, das Produkt des Gens crp an eine Bindestelle neben dem Promotor binden. Das kann er nur zusammen mit einem kleinen Molekül, cAMP, das mit Hilfe der Adenylatcyclase, dem Genprodukt des cya-Gens, gebildet wird. Der Vorteil dieses scheinbar komplizierten Systems für die Zelle ist, daß sie entscheiden kann, ob die Induktion des Lactoseabbauwegs sinnvoll ist. Gibt es nämlich viel Glucose im Medium, so ist deren Verwendung für die Zelle ökonomischer. Die Verwendung der Glucose führt in der Zelle zur Abnahme der cAMP-Konzentration. Dadurch wird die Aktivierung der Transkription des lacOperons vermieden. Dieser Mechanismus wird daher "Glucoseeffekt" genannt, aber auch Katabolitrepression, weil tatsächlich Stoffwechselprodukte der Glucose den Effekt auslösen. RNA Polymerase crp cya ATP lacI cbs p o lacZ lacY lacA cAMP Adenylatcyclase cya RNA Polymerase CRP crp lacI cbs p o lacZ lacY lacA Abbildung 2: Positive Regulation des lac-Operons. Selbst in Abwesenheit des Repressors wird das lacOperon nicht maximal exprimiert, weil die RNA-Polymerase nur unstabil am Promotor bindet. Erst die Bindung des CRP-Proteins an seinen Bindungsort (cbs) neben der RNA-Polymerase stabilisiert deren Bindung und führt so zur Aktivierung der Transkription. Dazu ist noch das Effektormolekül cAMP nötig, das durch die Adenylatcyclase aus ATP gemacht wird. 7-2 Genetisches Grundpraktikum 7. Kurstag 09.06.05 Versuchsziele In diesem Versuch soll gezeigt werden, dass das lac-Operon mit Lactose oder dem künstlichen Induktor Isopropyl-ß-thiogalactosid (IPTG) induziert werden kann und dass Glucose diese Induktion herabsetzt, weil die Aktivierung des Operons unterbleibt. Außerdem soll eine Mutante identifiziert werden, die ein verändertes Induktionsverhalten zeigt. Versuchsdurchführung Es werden drei E. coli-Kulturen mit einer Dichte von 3 x 108/ml ausgegeben, eine WildtypKultur (Hfr3000), eine lacZ-Mutante (als Negativkontrolle) und eine unbekannte Mutante, deren Natur untersucht wird. Die Zellen sind in glucosefreiem Medium gewachsen. 1 ml der Bakterien werden 30 min bei 37 °C mit den verschiedene Induktoren mit oder ohne Vorinkubation in Anwesenheit von Glucose weiter inkubiert. Danach werden die Zellen durchlässig gemacht und ihr ß-Galactosidasegehalt gemessen. 1. Induktion Wildtyp: Probe WT Glu/Lac: 100 µl Glucose zugeben, 30 min inkubieren, 100 µl Lactose zugeben, 20 min inkubieren Probe WT Glu/IPTG: 100 µl Glucose zugeben, 30 min inkubieren, 10 µl IPTG zugeben, 20 min inkubieren Probe WT Lac: 100 µl Lactose zugeben, 20 min inkubieren Probe WT IPTG: 10 µl IPTG zugeben, 20 min inkubieren (Konzentrationen der Lösungen: Glucose 10%; Lactose 10%; IPTG 10-2 M). Unbekannte Mutante: Vier Proben, Mut Glu/Lac, Mut Glu/IPTG, Mut Lac und Mut IPTG, analog zu den entsprechenden Wildtypproben behandeln. 7-3 lacZ-Mutante: Die Proben mit Glucose entfallen. Es werden nur die Proben LacZ Lac und LacZ IPTG analog den entsprechenden Wildtypproben hergestellt und 20 min inkubiert. Nach der Inkubation werden die Proben 5 min abzentrifugiert und das Medium wird entfernt. 2. ß-Galactosidasetest Die Zellen werden in 1 ml Testpuffer aufgenommen, mit 10 µl Chloroform versetzt, kräftig gemischt und 30 min bei 37 °C bebrütet. Dadurch werden die Zellen durchlässig und abgetötet Anschließend wird 100 µl o-Nitrophenyl-ß-Galactosid (ONPG)-Lösung (10 mg/ml) zugegeben und bei 30 °C weiter inkubiert. Dabei entsteht bei Anwesenheit von ßGalactosidase das gelbe Nitrophenol. Seine Bildung wird anhand von Vergleichsproben verfolgt. Rezepte: Wachstumsmedium: 10 g Trypton, 5 g Hefeextrakt, 10 g NaCl auf 1 l Wasser, pH auf 7,5 einstellen. Testpuffer: 0,06 M Na2HPO4; 0,04 M NaH2PO4; 0,01 M KCl; 1 mM MgSO4 ; 50 mM Mercaptoethanol; pH 7,0. Vergleichsproben: ONPG in 10-2 M NaOH, Verdünnungsreihe in Schritten um den Faktor 4. 7-4